- 1.81 MB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第二章 化学物质及其变化
[考纲解读] 1.了解分子、原子、离子和原子团等概念的含义。2.理解物理变化与化学变化的区别与联系。3.理解混合物和纯净物、单质和化合物、金属和非金属的概念。4.理解酸、碱、盐、氧化物的概念及其相互关系。5.了解胶体是一种常见的分散系;了解溶液和胶体的区别。6.了解电解质的概念,了解强电解质和弱电解质的概念。7.理解电解质在水溶液中的电离以及电解质溶液的导电性。8.了解离子反应的概念、离子反应发生的条件,能正确书写离子方程式,并能进行有关计算。9.掌握常见离子的检验方法。10.能正确判断常见离子在溶液中能否大量共存。11.了解氧化还原反应的本质。12.了解常见的氧化还原反应。13.掌握常见氧化还原反应的配平和相关计算。
第4讲 物质的组成、分类及性质
一、物质的组成
1.宏观上物质是由元素组成的,微观上物质是由分子、原子或离子构成的。
①元素:具有相同核电荷数的同一类原子的总称。
②原子是化学变化中的最小微粒。
③分子是保持物质化学性质的最小微粒,一般分子由原子通过共价键构成,但稀有气体是单原子分子。
④离子:带电荷的原子或原子团,有阳离子和阴离子之分。
2.元素与物质的关系
元素
3.元素在物质中的存在形态
(1)游离态:元素以单质形式存在的状态。
(2)化合态:元素以化合物形式存在的状态。
4.同素异形体
二、物质的分类
- 19 -
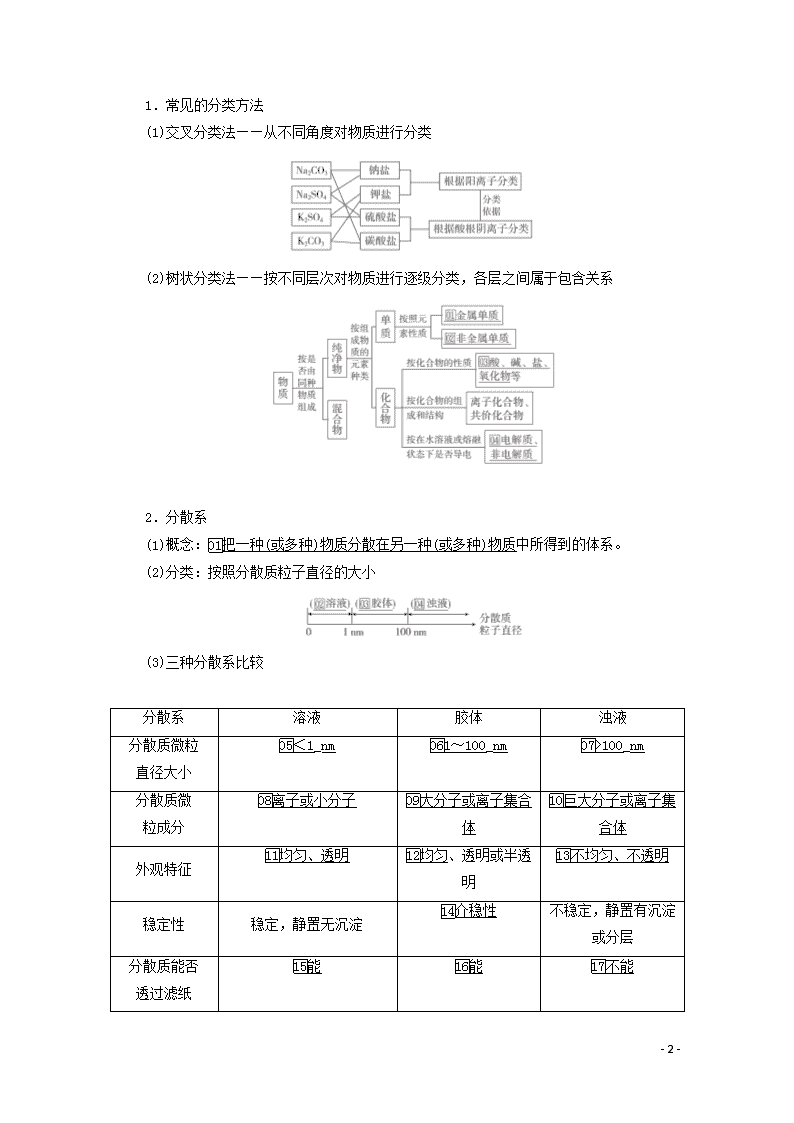
1.常见的分类方法
(1)交叉分类法——从不同角度对物质进行分类
(2)树状分类法——按不同层次对物质进行逐级分类,各层之间属于包含关系
2.分散系
(1)概念:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系。
(2)分类:按照分散质粒子直径的大小
(3)三种分散系比较
分散系
溶液
胶体
浊液
分散质微粒
直径大小
<1_nm
1~100_nm
>100_nm
分散质微
粒成分
离子或小分子
大分子或离子集合体
巨大分子或离子集合体
外观特征
均匀、透明
均匀、透明或半透明
不均匀、不透明
稳定性
稳定,静置无沉淀
介稳性
不稳定,静置有沉淀或分层
分散质能否
透过滤纸
能
能
不能
- 19 -
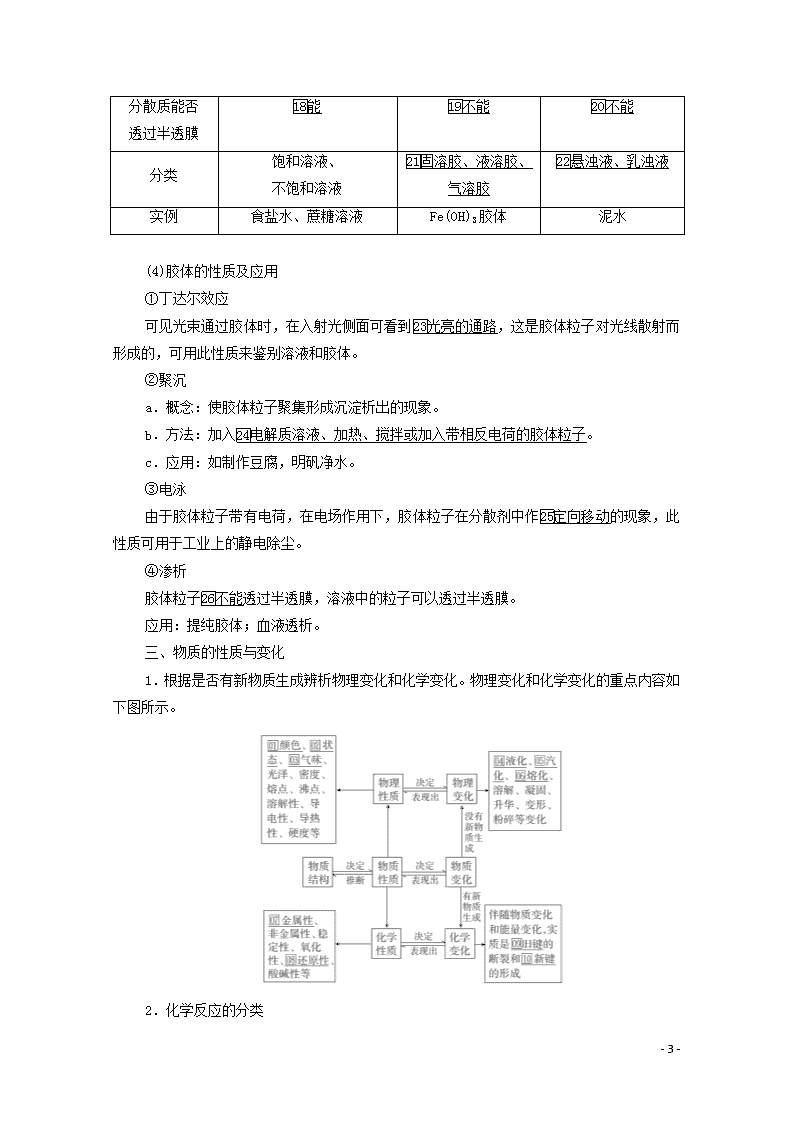
分散质能否
透过半透膜
能
不能
不能
分类
饱和溶液、
不饱和溶液
固溶胶、液溶胶、气溶胶
悬浊液、乳浊液
实例
食盐水、蔗糖溶液
Fe(OH)3胶体
泥水
(4)胶体的性质及应用
①丁达尔效应
可见光束通过胶体时,在入射光侧面可看到光亮的通路,这是胶体粒子对光线散射而形成的,可用此性质来鉴别溶液和胶体。
②聚沉
a.概念:使胶体粒子聚集形成沉淀析出的现象。
b.方法:加入电解质溶液、加热、搅拌或加入带相反电荷的胶体粒子。
c.应用:如制作豆腐,明矾净水。
③电泳
由于胶体粒子带有电荷,在电场作用下,胶体粒子在分散剂中作定向移动的现象,此性质可用于工业上的静电除尘。
④渗析
胶体粒子不能透过半透膜,溶液中的粒子可以透过半透膜。
应用:提纯胶体;血液透析。
三、物质的性质与变化
1.根据是否有新物质生成辨析物理变化和化学变化。物理变化和化学变化的重点内容如下图所示。
2.化学反应的分类
- 19 -
1.判断正误,正确的画“√”,错误的画“×”,并指明错因。
(1)人们可以利用先进的化学技术,选择适宜的条件,利用化学反应制造新的原子。(×)
错因:化学反应是原子的重新组合,原子种类不变。
(2)Na、NaCl、SiO2、H2SO4都称为分子式。(×)
错因:Na、NaCl、SiO2是化学式,它们不是由分子组成的,无分子式。
(3)胆矾(CuSO4·5H2O)属于混合物。(×)
错因:CuSO4·5H2O是由固定微粒组成的,是纯净物。
(4)能与酸反应的氧化物,一定是碱性氧化物。(×)
错因:Al2O3与酸反应,是两性氧化物,Na2O2与酸反应,是特殊氧化物——过氧化物。
(5)纯碱属于碱,硫酸氢钠、碳酸氢钠属于酸式盐。(×)
错因:纯碱是Na2CO3,属于碳酸盐。
(6)溶液是电中性的,胶体是带电的。(×)
错因:胶体呈电中性,胶粒带电。
(7)将1 mL 1 mol·L-1的FeCl3溶液滴入沸水中制备Fe(OH)3胶体,若FeCl3完全水解,则可制得0.001NA个Fe(OH)3胶体粒子。(×)
错因:Fe(OH)3胶体粒子是大量Fe3+和大量OH-聚集而成的粒子(其直径介于1~100_nm之间),故数目远远小于10-3NA个。
(8)某物质经科学测定只含有一种元素,可以断定该物质一定是一种单质。(×)
错因:O2和O3的混合气体只含一种元素但属于混合物,不是单质。
2.教材改编题
- 19 -
(据人教必修一P42T1)现有下列4组物质:
A.CaO、NO、CO2、Al2O3
B.H2、Cl2、N2、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
(1)填写下表空白。
A组
B组
C组
D组
分类标准
酸性氧化物
金属单质
非金属单质
弱电解质
属于该类
别的物质
(2)若(1)表中的4种物质相互作用可生成一种新物质——碱式碳酸铜[化学式为Cu2(OH)2CO3],请写出该反应的化学方程式:______________________________________。
答案 (1)CO2 Cu O2 H2O
(2)2Cu+O2+CO2+H2O===Cu2(OH)2CO3
3.“纳米材料”是粒子直径为1~100 nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到蒸馏水中,所形成的物质具有的性质有( )
①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过滤纸 ⑤不能透过滤纸 ⑥静置后会析出黑色沉淀
A.①④⑤ B.②③⑤
C.②③④ D.①③④⑥
答案 C
考点一 物质的组成和分类
- 19 -
[解析] ①冰水混合物的成分为水,为纯净物;②爆鸣气是氢气和氧气的混合物;③铝热剂是铝和金属氧化物的混合物;④普通玻璃是硅酸钠、硅酸钙、二氧化硅的混合物;⑤水玻璃是硅酸钠的水溶液,属于混合物;⑥漂白粉是氯化钙、次氯酸钙的混合物;⑦二甲苯不一定是纯净物,可能是邻二甲苯、对二甲苯、间二甲苯的混合物;⑧TNT是三硝基甲苯的俗称,属于纯净物;⑨溴苯是纯净物;⑩C5H12不一定表示纯净物,可能是正戊烷、异戊烷、新戊烷的混合物;⑪氧化镁中氧的含量为40%,故含氧40%的氧化镁是纯净物;⑫花生油有多种成分,是混合物;⑬福尔马林是甲醛的水溶液,属于混合物;⑭密封保存的NO2气体,存在2NO2N2O4平衡体系,为混合物。综上所述,①⑧⑨⑪一定属于纯净物,A正确。
[答案] A
1.纯净物和混合物的区别
纯净物
混合物
有固定的组成和结构
无固定的组成和结构
有一定的熔、沸点
无一定的熔、沸点
保持一种物质的性质
保持原有物质各自的性质
常见混合物:(1)分散系(如溶液、胶体、浊液等);(2)高分子化合物(如蛋白质、纤维素、聚合物、淀粉等);(3)常见特殊名称的混合物:石油、石油的各种馏分、煤、漂白粉、碱石灰、福尔马林、油脂、天然气、水煤气、铝热剂、氨水、氯水、王水等;(4)合金。
注意 由同位素组成的单质或化合物为纯净物。如H2、D2、T2;H2O、D2O。
- 19 -
2.把握物质分类的四个“标准”
(1)混合物与纯净物——是否由同种物质组成。
(2)酸性氧化物、碱性氧化物与两性氧化物——是否与碱、酸反应只生成盐和水。
(3)电解质与非电解质——水溶液或熔融状态下能否导电的化合物。
(4)溶液、浊液与胶体——分散质粒子直径的大小。
1.Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是( )
①化合物 ②能与硝酸反应 ③钠盐 ④电解质 ⑤离子化合物 ⑥氧化物
A.②⑤⑥ B.①②⑥
C.①③④ D.①④⑤
答案 D
解析 ①Na2O、NaOH、Na2CO3、NaCl、Na2SO4都是由两种或两种以上元素构成的纯净物,属于化合物,①正确。②NaCl、Na2SO4与硝酸不反应,②错误。Na2O属于钠的氧化物,NaOH属于碱,故③⑥错误。④Na2O、NaOH、Na2CO3、NaCl、Na2SO4在水溶液中或熔融状态下能导电,属于电解质,④正确。⑤Na2O、NaOH、Na2CO3、NaCl、Na2SO4都属于离子化合物,⑤正确。
2.下列物质的分类正确的是( )
选项
碱
酸
盐
碱性氧化物
酸性氧化物
A
Na2CO3
H2SO4
NaOH
SO2
CO2
B
NaOH
HCl
NaCl
Na2O
NO
C
KOH
HNO3
CaCO3
CaO
Mn2O7
D
NaOH
HCl
CaF2
Na2O2
SO2
答案 C
正确理解“一定”“不一定”,规避概念失分点
1.碱性氧化物一定是金属氧化物,但金属氧化物不一定是碱性氧化物(如Mn2O7为酸性氧化物、Al2O3为两性氧化物、Na2O2为过氧化物)。
2.酸性氧化物不一定是非金属氧化物(如Mn2O7);非金属氧化物也不一定是酸性氧化物(如CO、NO)。
3.酸性氧化物、碱性氧化物不一定都能与水反应生成相应的酸、碱(如SiO2、Fe2O3)。
4.酸性氧化物都是对应酸的酸酐,但酸酐不一定都是酸性氧化物,如乙酸酐[(CH3CO)2O]。
- 19 -
5.酸(或碱)的水溶液一定呈酸(或碱)性,但呈酸(或碱)性的溶液不一定是酸(或碱)的溶液。
6.一个一元强酸分子在水溶液中一定能电离出一个H+,在水溶液中电离出一个H+的不一定是一元强酸(如NaHSO4)。
考点二 物质的性质和变化
[解析] 淘金要千遍万遍的过滤,不涉及化学变化,故A符合题意;提炼CuSO4·5H2O时,煎熬泉水的锅用久了就会在其表面析出一层红色物质(铜),其原因为:CuSO4+Fe===Cu+FeSO4,发生了化学反应,故B不符合题意;石灰石高温煅烧后能制得生石灰,发生了化学反应,故C不符合题意;丹砂(HgS)烧之成水银,即红色的硫化汞(即丹砂)在空气中灼烧有汞生成,积变又成丹砂,即汞和硫在一起又生成硫化汞,发生了化学反应,故D不符合题意。
[答案] A
- 19 -
物理变化和化学变化的判断
1.判断依据:根据是否有新物质生成来辨析物理变化和化学变化。
2.常见的物理变化和化学变化
物理变化
化学变化
三馏
分馏、蒸馏
干馏
三色
焰色反应
显色反应、颜色反应
五解
潮解
分解、电解、水解、裂解
十五化
熔化、汽化、
液化
氢化、氧化、水化、风化、炭化、钝化、煤的气化、煤的液化、皂化、硝化、酯化、裂化
3.下列我国古代的技术应用中,其工作原理不涉及化学反应的是( )
A.火药使用
B.粮食酿酒
C.转轮排字
D.铁的冶炼
答案 C
4.(2019·贵州重点中学高考教学质量测评)化学与生活密切相关,下列说法错误的是( )
A.煤的干馏、气化和液化均属于物理变化
B.科学家提出了光催化水分解制备氢气,此法比电解水制备氢气更环保、更经济
C.明矾可作净水剂是因为明矾溶于水时铝离子水解生成氢氧化铝胶体,可以吸附杂质
D.粮食酿酒的过程中涉及了淀粉→葡萄糖→乙醇的化学变化过程
答案 A
解析 煤的干馏是将煤隔绝空气加强热,生成焦炭、煤焦油、出炉煤气等产物的过程;煤的气化是让煤在高温条件下与水蒸气反应生成氢气和一氧化碳;煤的液化是利用煤制取液体燃料,均为化学变化,A错误。
- 19 -
1.化学变化中一定存在化学键的断裂和形成,但存在化学键断裂或形成的变化不一定是化学变化,如金属熔化、NaCl溶于水、NaCl晶体从溶液中析出、从浓盐酸中挥发出HCl气体等均属于物理变化。
2.电解质的电离是物理变化,电解质溶液导电是化学变化。
3.金属与酸反应不一定生成氢气,如铁与足量稀硝酸反应:Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O。
4.金属与盐溶液反应不一定生成另一种金属和另一种盐,如:2FeCl3+Cu===2FeCl2+CuCl2。
考点三 分散系 胶体
[解析] 由题意可知,甲、乙分散系都是胶体,A错误;氢氧化铝溶于氢氧化钠溶液,而氢氧化铁不溶,B错误;FeCl3中的Fe3+能氧化I-生成I2,I2溶于水呈深褐色,C正确;蒸干、灼烧氯化铁溶液得到氧化铁,蒸干、灼烧明矾溶液得到KAl(SO4)2,D错误。
[答案] C
1.胶体
(1)胶体区别于其他分散系的本质特征是分散质粒子直径大小(1~100 nm)。
(2)胶体不带电,胶体中的胶粒能够吸附体系中的带电离子而使胶粒带电荷,但整个分散系仍呈电中性。
(3)胶体中的分散质微粒能透过滤纸,但不能透过半透膜,因此可用过滤的方法分离胶体和浊液,用渗析的方法分离胶体和溶液中的分散质。
(4)鉴别胶体和溶液的最简单方法是利用丁达尔效应。
2.胶体的制备方法
(1)物理研磨法——如大豆制豆浆
(2)Fe(OH)3胶体制备
- 19 -
①制备Fe(OH)3胶体时,不能用Fe3+与碱反应制得;利用饱和FeCl3溶液制备时,不能长时间加热。
②书写Fe(OH)3胶体制备化学方程式的四个易错点:
a.用“===”而不用“”;
b.Fe(OH)3分子式后注明胶体而不使用“↓”;
c.反应条件是“△”;
d.HCl后不能标“↑”。
3.胶体性质的主要应用
(1)盐卤点豆腐。
(2)江河入海口处沙洲的形成。
(3)静电除尘。
(4)血液透析。
(5)明矾、氯化铁晶体净水。
(6)蛋白质的盐析。
5.下列事实与胶体的性质有关的是( )
①用盐卤点豆腐 ②用明矾净水 ③医学上用三氯化铁止血 ④江河入海口形成三角洲
A.只有①②③ B.只有①②④
C.只有②③ D.全部
答案 D
解析 ①用盐卤点豆腐是利用电解质使胶体发生聚沉;②明矾的水溶液中含Al3+,Al3+水解生成Al(OH)3胶体,Al(OH)3胶粒吸附作用很强,能吸附水中的杂质和其他胶粒,凝聚成较大的微粒而沉淀,使水得到净化;③血浆是一种液溶胶,三氯化铁是电解质,用三氯化铁止血就是利用电解质促使血液聚沉;④江河中含有大量泥沙,也含有大量土壤胶体,海洋中含有NaCl等电解质,电解质促使胶体聚沉,与泥沙一起形成三角洲。
6.磁流体是电子材料的新秀,它是由直径为纳米量级(1到10纳米之间)的磁性固体颗粒、基载液以及界面活性剂三者混合而成的分散系,既具有固体的磁性,又具有液体的流动性,下列关于纳米Fe3O4磁流体的说法中不正确的是( )
A.纳米Fe3O4磁流体分散系属于溶液
B.纳米Fe3O4磁流体可以通过半透膜得到提纯
C.当一束可见光通过该磁流体时会出现光亮的通路
D.纳米Fe3O4磁流体比较稳定
答案 A
解析
- 19 -
根据题意,磁流体分散系分散质粒子直径在1到10纳米之间,属于胶体的范畴,具备胶体的性质。
传统文化中物质的性质与分类 对应学生用书P019
根据古代典籍中的材料,考查有关物质的名称、成分,基本的物理和化学性质是近几年高考的常考点,这类题难度不大,主要考查我国古代化学成就及相关化学史,经典史籍中的化学成就。考生需认真阅读题干中的文言文信息,抓住关键的字词进行解答。
[答案] D
[体验1] 《周礼》记载“煤饼烧蛎房成灰”(“蛎房”即牡蛎壳),并把这种灰称为“蜃”,古人蔡伦以“蜃”改进了造纸术。下列说法错误的是( )
A.贝壳的主要成分为CaCO3
B.“砺房成灰”是氧化还原反应
C.“蜃”与水混合,溶液呈碱性
D.纸张主要成分是纤维素
答案 B
解析 牡蛎壳为贝壳,贝壳主要成分为碳酸钙,A正确;“砺房成灰”是碳酸钙灼烧生成氧化钙和CO2,反应中各元素化合价不变,不属于氧化还原反应,B错误;“蜃”主要成分是氧化钙,氧化钙溶于水即可得到氢氧化钙,氢氧化钙溶液呈碱性,C正确;纸张主要成分是纤维素,D正确。
- 19 -
[解析] 氧化铁的颜色为红棕色,不是青色,A错误;秦兵马俑是陶制品,由黏土经高温烧结而成。陶瓷的主要成分是硅酸盐,具有耐酸碱侵蚀、抗氧化等优点,B、C、D正确。
[答案] A
[体验2] (2020·湖北八校高三联考)化学与社会、生活、技术密切相关,下列说法错误的是( )
A.有人称“一带一路”是“现代丝绸之路”,丝绸的主要成分是纤维素,属于天然高分子化合物
B.商代后期铸造出工艺精湛的后母戊鼎,该鼎属于铜合金制品
C.静置后的淘米水能产生丁达尔效应,这种淘米水具有胶体的性质
D.在元素周期表的金属和非金属分界线附近可寻找锗、硅、硒等半导体材料
答案 A
建议用时:40分钟 满分:100分
一、选择题(每题6分,共72分)
1.下列各组物质能真实表示物质分子组成的是( )
A.NO、C2H5OH、HNO3、I2
B.CaO、N2、HCl、H2O
C.NH3、H2S、Si、CO
D.CO2、SiO2、CH3COOH、H2SO4
答案 A
- 19 -
解析 CaO是离子化合物,不存在分子;而Si和SiO2都是由原子直接构成。
2.(2019·湖北省鄂州市、黄冈市高三调研)化学与人类的生产生活密切相关,下列有关说法错误的是( )
A.天然气既是高效清洁的化石燃料,也是重要的化工原料
B.地沟油在碱性条件下水解可以生成高级脂肪酸盐和甘油
C.用于光缆通信的光导纤维是新型无机非金属材料
D.明矾常用作漂白剂,因为明矾溶于水后,水解生成氢氧化铝胶体
答案 D
解析 明矾溶于水电离出的Al3+水解生成氢氧化铝胶体,胶体具有吸附性,因此明矾可以净水,但不能用作漂白剂,故D错误。
3.某合作学习小组讨论辨析以下说法,其中正确的是( )
①粗盐和酸雨都是混合物 ②沼气和水煤气都是可再生能源 ③冰和干冰既是纯净物又是化合物 ④不锈钢和目前流通的硬币都是合金 ⑤纯碱和熟石灰都是碱
⑥豆浆和雾都是胶体
A.①②③④ B.①②⑤⑥
C.③⑤⑥ D.①③④⑥
答案 D
解析 水煤气不是可再生能源,纯碱为Na2CO3是一种盐而不是碱,因此②⑤错误。
4.如图为雾霾的主要成分示意图。下列说法不正确的是( )
A.重金属离子可导致蛋白质变性
B.苯是最简单的芳香烃
C.SO2和NxOy都属于酸性氧化物
D.汽车尾气的大量排放是造成雾霾天气的人为因素之一
答案 C
解析 NO、NO2都不属于酸性氧化物。
5.下列关于溶液和胶体的叙述,正确的是( )
A.溶液是电中性的,胶体是带电的
B.通电时,溶液中的溶质粒子分别向两极移动,胶体中的分散质粒子向某一极移动
C.溶液中溶质粒子的运动有规律,胶体中分散质粒子的运动无规律,即布朗运动
- 19 -
D.一束光线分别通过溶液和胶体时,后者会出现一条光亮的“通路”,前者则没有
答案 D
解析 A项,胶体粒子带电荷,而胶体是电中性的;B项,通电时,溶液中的阴、阳离子分别向两极移动,而不是溶质粒子分别向两极移动;C项,溶液中溶质粒子的运动是无规律的。
6.下表所列物质或概念间的从属关系符合下图所示关系的是( )
选项
X
Y
Z
A
光导纤维
酸性氧化物
传统无机非金属材料
B
纯碱
碱
化合物
C
电解质
化合物
纯净物
D
H2SO4
含氧酸
强酸
答案 C
解析 A项,光导纤维属于酸性氧化物,是新型无机非金属材料;B项,纯碱不是碱而是盐;C项,电解质是化合物,化合物都是纯净物;D项,H2SO4是含氧酸,但含氧酸不一定都是强酸。
7.下列实验装置或操作与粒子的大小无直接关系的是( )
答案 C
解析 直径大于1 nm而小于100 nm的胶体粒子能透过滤纸,但不能透过半透膜,溶液中的粒子直径小于1 nm,可透过半透膜和滤纸,而浊液的分散质粒子直径大于100
- 19 -
nm,不能透过滤纸和半透膜;丁达尔效应是胶体粒子对光线的散射作用形成的,而溶液中的小分子或粒子对光线的散射作用非常微弱,故无此现象;萃取是利用了物质在不同溶剂中溶解性的不同,与分散质粒子大小无关。
8.(2019·安徽五校联盟高三质检)根据所给的信息和标志,判断下列说法错误的是( )
A
B
C
D
《神农本草经》记载,麻黄能“止咳逆上气”
古代中国人已用麻黄治疗咳嗽
该药是抗酸药,服用时喝些醋能提高药效
看到有该标志的丢弃物,应远离并报警
贴有该标志的物品是可回收物
答案 B
解析 碳酸氢钠能与胃酸反应,可用作抗酸药,但服用时喝些醋,醋与碳酸氢钠反应,则会降低药效,B项错误。
9.中华民族有着光辉灿烂的发明史,下列发明创造不涉及化学反应的是( )
A.用胆矾炼铜 B.用铁矿石炼铁
C.烧结粘土制陶瓷 D.打磨磁石制指南针
答案 D
解析 CuSO4·5H2O→Cu是由化合物转化成单质,肯定发生化学反应,A不符合题意;炼铁是将铁从其氧化物中还原出来,发生了化学反应,B不符合题意;烧结粘土制陶瓷的过程发生了复杂的化学反应,C不符合题意;磁石制指南针,只是物质的形态发生了变化,属于物理过程,不涉及化学反应,D符合题意。
10.下列古代文献的记载中,涉及化学变化的是( )
A.《本草纲目》记载“烧酒非古法也,自元时创始其法,用浓酒精和糟入甑(指蒸锅),蒸令气上,用器承滴露”
B.《肘后备急方》记载“青蒿一握,以水二升渍,绞取汁”
C.《泉州府志》物产条记载“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之”
D.《梦溪笔谈》记载“信州铅山县有苦泉……挹其水熬之,则成胆矾……熬胆矾铁釜,久之亦化为铜”
答案 D
解析
- 19 -
白酒的制取是利用沸点不同进行分离,为蒸馏操作,没有涉及化学变化,A错误;《肘后备急方》中记载“青蒿一握,以水二升渍,绞取汁”,利用萃取原理,没有新物质生成,属于物理变化,B错误;黄泥具有吸附作用,可除杂质,没有涉及化学变化,C错误;“熬胆矾铁釜,久之亦化为铜”说明Fe和CuSO4反应生成Cu,该反应为置换反应,D正确。
11.德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是( )
A.水、双氧水、水玻璃都是纯净物
B.石墨和C60互称为同位素
C.磷酸钙是可溶性强电解质
D.一定条件下石墨转化为C60是化学变化
答案 D
解析 水是纯净物;双氧水是H2O2的水溶液,水玻璃是硅酸钠的水溶液,都属于混合物,A错误。同位素是质子数相同、中子数不同的同种元素的不同原子,而石墨和C60是碳元素的不同单质,二者互为同素异形体,B错误。由题目信息可知磷酸钙难溶于水,因此是难溶性强电解质,C错误。石墨和C60互为同素异形体,同素异形体之间的转化有新物质生成,属于化学变化,D正确。
12.下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )
A.打开盛装NO的集气瓶;冷却NO2气体
B.用冰水混合物冷却SO3气体;加热氯化铵晶体
C.木炭吸附NO2气体;将氯气通入品红溶液中
D.向品红溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液
答案 C
解析 打开盛装NO的集气瓶和冷却NO2气体都发生化学反应,A不符合题意;用冰水混合物冷却SO3气体、加热氯化铵晶体,前者是物理变化,后者是化学变化,但均无颜色变化,B不符合题意;木炭吸附NO2气体是物理变化,将氯气通入品红溶液中发生化学反应,且均有颜色变化,C符合题意;向品红溶液中加入Na2O2和向FeCl3溶液中滴加KSCN溶液均为化学变化,D不符合题意。
二、非选择题(共28分)
13.(14分)某化学兴趣小组的同学们按照下面的实验方法制备氢氧化铁胶体:首先取少量蒸馏水于洁净的烧杯中,用酒精灯加热至沸腾,向烧杯中逐滴滴加饱和的FeCl3溶液继续煮沸,至液体呈透明的红褐色。
FeCl3+3H2OFe(OH)3(胶体)+3HCl
(1)判断胶体制备是否成功,可利用胶体的________。
(2)在做制备氢氧化铁胶体的实验时,有些同学没有按要求进行,结果没有观察到胶体,请你预测其现象并分析原因:
- 19 -
①甲同学没有选用饱和氯化铁溶液,而是将稀氯化铁溶液滴入沸水中,结果没有观察到________________,其原因是___________________________________________________________。
②乙同学在实验中没有使用蒸馏水,而是用自来水,结果会____________,原因是________________________________________________________________________。
③丙同学向沸水中滴加饱和氯化铁溶液后,长时间加热,结果会______________,原因是______________________________。
(3)丁同学按要求制备了Fe(OH)3胶体,但是他又向Fe(OH)3胶体中逐滴加入了稀H2SO4溶液,结果出现了一系列变化。
①先出现红褐色沉淀,原因______________________________________。
②随后沉淀溶解,此反应的离子方程式是____________________________________________
________________________________________________________________________。
答案 (1)丁达尔效应
(2)①红褐色液体 FeCl3溶液太稀,生成的Fe(OH)3太少 ②生成红褐色沉淀 自来水中含有电解质,胶体发生聚沉 ③生成红褐色沉淀 长时间加热胶体发生聚沉
(3)①电解质H2SO4使Fe(OH)3胶体聚沉而产生沉淀
②Fe(OH)3+3H+===Fe3++3H2O
14.(14分)现有NH3、CO、Na、Na2O2、Fe、NO、NO2、F2、SO2等物质,根据它们的组成及性质进行如下分类:
请回答下列问题:
(1)图中所示的分类方法叫____________。
(2)淡黄色固体最终位于________组,它的电子式为____________________。
(3)C组有一种气体常用作工业上冶炼铁的还原剂,写出高温下它还原Fe2O3的化学方程式:____________________________________。
(4)Ⅱ组中的某种物质能与水发生氧化还原反应,该反应中被氧化与被还原的元素的质量比为________。
(5)B组中有一种物质在高温下能与水蒸气反应,若该反应过程中有8×6.02×1023
- 19 -
个电子发生转移,则有________g该物质参加反应。
答案 (1)树状分类法
(2)Ⅰ Na+[]2-Na+
(3)3CO+Fe2O32Fe+3CO2 (4)2∶1 (5)168
解析 (1)由分类图知,该分类方法为树状分类法,结合相关信息可知分类如下:
(3)CO为还原性气体,在高温下还原Fe2O3,反应的化学方程式为3CO+Fe2O32Fe+3CO2。
(4)3NO2+H2O===2HNO3+NO,NO2发生了自身的氧化还原反应,被氧化和被还原的氮元素的质量比为2∶1。
(5)铁在高温下能够与水蒸气发生反应:3Fe+4H2O(g)Fe3O4+4H2。根据化学方程式可知转移8 mol电子时,有3 mol Fe参加反应,质量为168 g。
- 19 -
相关文档
- 试题君之课时同步君2016-2017学年2021-07-0513页
- 2018-2019学年湖北省沙市中学高二2021-07-0514页
- 化学卷·2019届甘肃省兰州新区舟曲2021-07-059页
- 2020届一轮复习人教版物质的量在化2021-07-057页
- 高二化学下学期开学考试试题(含解析2021-07-0527页
- 【化学】安徽省定远县育才学校20192021-07-057页
- 山西省忻州市第一中学2019-2020学2021-07-057页
- 2017-2018学年甘肃省武威第十八中2021-07-056页
- 广东大埔华侨二中2020届高三1月月2021-07-0510页
- 备战2021 高考化学 考点26 元素周2021-07-058页