- 189.50 KB
- 2021-07-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2节 水的电离和溶液的酸碱性
[综合训练]
一、选择题
1.374 ℃、22.1 MPa以上的超临界水具有很强的溶解有机物的能力,并含有较多的H+和OH-,由此可知超临界水( )
A.显中性,pH等于7 B.Kw小于10-14
C.显酸性,pH小于7 D.导电能力增强
答案 D
解析 温度为374 ℃超临界水显中性,pH<7,A、C两项错误;水的电离程度增大了,离子浓度增大了,导电能力增强,D项正确,B项错误。
2.与纯水的电离相似,液氨中也存在微弱的电离:2NH3NH+NH。据此判断,以下叙述错误的是( )
A.液氨中含有NH3、NH、NH
B.一定温度下,液氨中c(NH)·c(NH)是定值
C.液氨中电离达到平衡时c(NH3)=c(NH)=c(NH)
D.只要不加入其他物质,液氨中c(NH)=c(NH)
答案 C
解析 液氨中存在电离平衡,所以液氨中含有NH3、NH、NH,A项正确;液氨中c(NH)与c(NH)的乘积只与温度有关,所以只要温度一定,液氨中c(NH)与c(NH)的乘积为定值,B项正确;液氨的电离是微弱的,所以液氨中电离达到平衡时,c(NH)=c(NH)10-7 mol·L-1时,用10-14除以这个浓度的数值即得到水电离的c(H+)的数值,如pH=2的硫酸溶液中水电离出的
- 8 -
c水(H+)=c水(OH-)= mol·L-1=10-12 mol·L-1。
12.室温下,若溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO、Cl-
B.K+、Na+、Cl-、NO
C.K+、Na+、Cl-、AlO
D.K+、NH、SO、NO
答案 B
解析 溶液中由水电离产生的c(OH-)=1×10-14 mol·L-1,溶液的pH为0或14,在A项中Al3+与OH-不共存;在C项中AlO与H+不共存;在D项中NH与OH-不共存;所以一定能够存在的离子组为B项。
二、非选择题
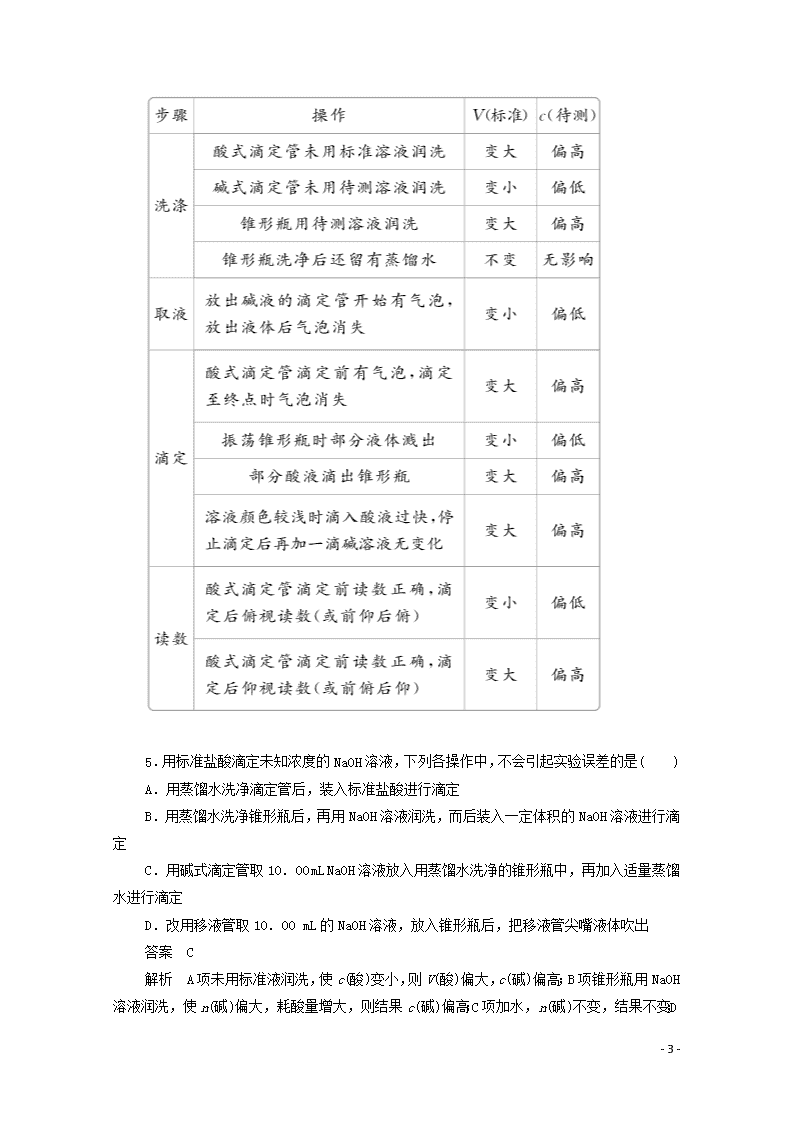
13.在中和滴定操作过程中,有以下各项因操作不当而引起的实验误差,用“偏高”“偏低”或“无影响”等填空:
(1)滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果________。
(2)锥形瓶用蒸馏水洗净后,又用待测溶液润洗,使滴定结果________。
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果________。
(4)滴定前平视,滴定终点俯视,使滴定结果____________。
(5)用NaOH溶液滴定盐酸(酚酞作指示剂),当加入一滴NaOH溶液时溶液呈浅红色,此时便停止滴定,后又发现浅红色消失,使滴定结果________。
(6)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度________。
(7)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度________。
答案 (1)偏高 (2)偏高 (3)偏高 (4)偏低 (5)偏低 (6)偏低 (7)偏高
解析 中和滴定误差分析的依据是c待=,若向待测溶液(置于锥形瓶)中滴加标准溶液(置于滴定管),则由V标来分析实验误差。
(1)滴定管装液前未用标准溶液润洗,会使标准溶液被冲稀,导致所耗V标偏大,使测定的c待偏高。
(2)锥形瓶装液前用待测溶液润洗,会使锥形瓶内待测的溶质增加,导致所耗V标偏大,使测定的c待偏高。
(3)气泡的体积计入了标准溶液,结果偏高。
- 8 -
(4)滴定终点俯视读数,将终点读数读小了,V标偏低因而c待偏低。
(5)终点判断提前(应保持半分钟不褪色),结果偏低。
(6)NaOH中含有Na2O,则标准溶液的浓度已经偏高(62 g Na2O相当于80 g NaOH),因而所需滴入的标准溶液的体积偏小,测得结果偏低。
(7)把标准溶液视为Na2CO3溶液,由于53 g Na2CO3相当于40 g NaOH,所以中和相同量的盐酸所需Na2CO3溶液的体积比NaOH溶液大,使V标偏高,结果偏高。
14.已知水在25 ℃和95 ℃时,其电离平衡曲线如图所示。
(1)25 ℃时水的电离平衡曲线应为________(填“A”或“B”),请说明理由:__________________________________________________________________。
(2)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为________。
(3)95 ℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是________________。
(4)曲线B所对应的温度下,pH=2的某HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。请分析其原因:________________________________________________________________________________________________________________________________________________________________________________________________________________________。
答案 (1)A 水的电离是吸热过程,温度低时,电离程度较小,c(H+)、c(OH-)较小
(2)10∶1
(3)pH1+pH2=14或a+b=14
(4)曲线B对应95 ℃,此时水的离子积为10-12,HA为弱酸,HA中和NaOH后,混合溶液中还剩余较多的HA,可继续电离出H+,使溶液的pH=5
解析 (1)当温度升高时,促进水的电离,水的离子积增大,水中H+浓度、OH-浓度都增大,水的pH减小,但溶液仍然呈中性。因此25 ℃时水的电离平衡曲线应为A。
(2)25 ℃时所得混合溶液的pH=7,溶液呈中性,即酸碱恰好中和,n(OH-)=n(H+),则V(NaOH)·10-5 mol·L-1=V(H2SO4)·10-4 mol·L-1,得V(NaOH)∶V(H2SO4)=10∶1。
(3)要注意95 ℃时,水的离子积为10-12,即等体积强酸、强碱反应至中性时pH(酸)+pH(碱)=12,即10-a mol·L-1×100=10-(l2-b) mol·L-1×1所以a+b=14或pH1+pH2
- 8 -
=14。
(4)在曲线B对应温度下,因pH(酸)+pH(碱)=12,可得酸碱两溶液中c(H+)=c(OH-),如果是强酸、强碱,两溶液等体积混合后,溶液应呈中性,现混合溶液的pH=5,即等体积混合后溶液显酸性,说明酸过量,所以HA是弱酸。
- 8 -
相关文档
- 2018届二轮复习水溶液中的离子平衡2021-07-0551页
- 2018届二轮复习第8讲 水溶液中的2021-07-0551页
- 2019届二轮复习9水溶液中的离子平2021-07-0584页
- 高中化学第3章水溶液中的离子平衡2021-07-057页
- 高中化学第3章水溶液中的离子平衡2021-07-057页
- 高中化学水溶液中的离子平衡第节水2021-07-0534页
- 高中化学第三章水溶液中的离子平衡2021-07-055页
- 高中化学第三章水溶液中的离子平衡2021-07-059页
- 高中化学第三章水溶液中的离子平衡2021-07-054页
- 高中化学第三章水溶液中的离子平衡2021-07-0515页