- 178.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
选择题标准练(十二)
满分:42分
每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列分析不正确的是( B )
A.“木与木相摩则然(燃)”的“然”是化学能转变为热能
B.“司烜氏,掌以夫遂(青铜凹镜)取明火于日”的“夫遂”是单质
C.“著作酒醴(甜酒),尔惟曲蘖(酒曲)”的“曲蘖”是催化剂
D.“浮梁巧烧瓷,颜色比琼玖”的“瓷”是硅酸盐产品
解析:A项,“木与木相摩则然(燃)”,燃烧是化学能转变为热能,正确;B项,“夫遂”是古人用于日下取火的凹形铜镜,属于合金,为混合物,不是单质,错误;C项,“曲蘖”是酶,为催化剂,正确;D项,“瓷”是硅酸盐产品,属于无机非金属材料,正确。
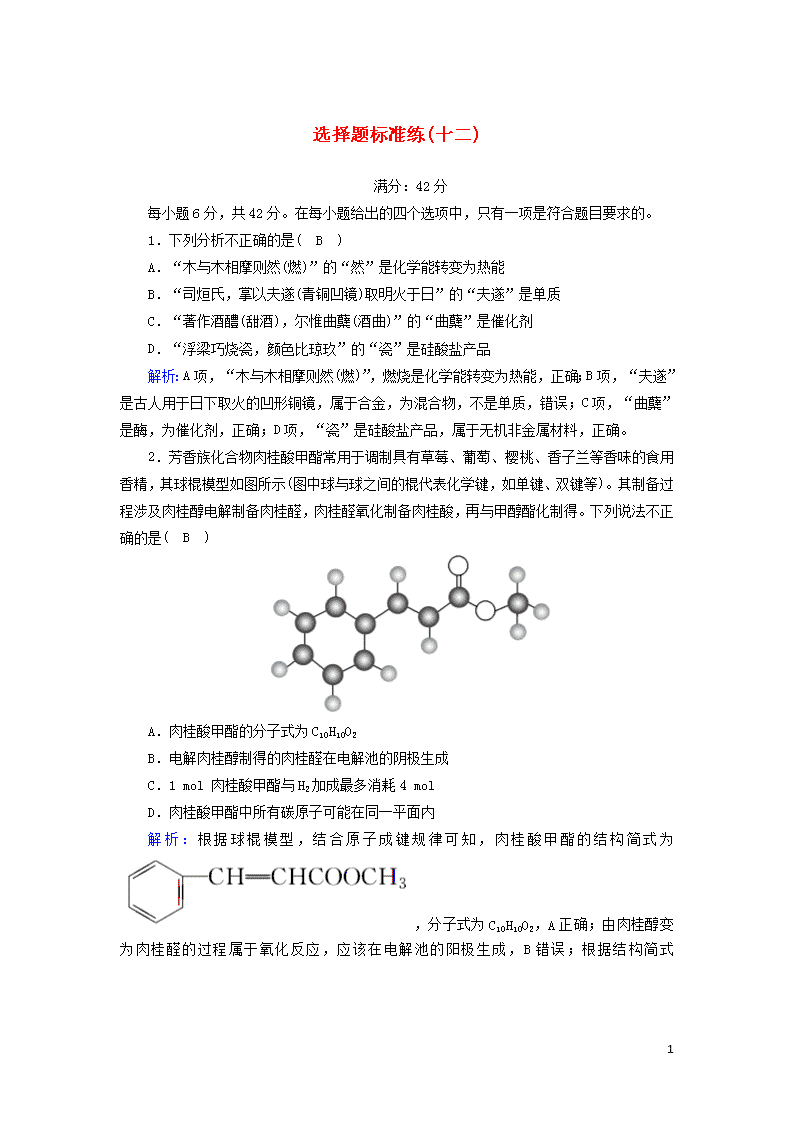
2.芳香族化合物肉桂酸甲酯常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,其球棍模型如图所示(图中球与球之间的棍代表化学键,如单键、双键等)。其制备过程涉及肉桂醇电解制备肉桂醛,肉桂醛氧化制备肉桂酸,再与甲醇酯化制得。下列说法不正确的是( B )
A.肉桂酸甲酯的分子式为C10H10O2
B.电解肉桂醇制得的肉桂醛在电解池的阴极生成
C.1 mol 肉桂酸甲酯与H2加成最多消耗4 mol
D.肉桂酸甲酯中所有碳原子可能在同一平面内
解析:根据球棍模型,结合原子成键规律可知,肉桂酸甲酯的结构简式为,分子式为C10H10O2,A正确;由肉桂醇变为肉桂醛的过程属于氧化反应,应该在电解池的阳极生成,B错误;根据结构简式
4
可知,1 mol 苯环与3 mol 氢气加成,1 mol 碳碳双键与1 mol 氢气加成,共消耗氢气4 mol,C正确;苯环与碳碳双键中的一个碳原子直接相连,CH3OOC—与碳碳双键上的另外一个碳原子直接相连,单键可以旋转,因此肉桂酸甲酯中所有碳原子可能在同一平面内,D正确。
3.短周期主族元素X、Y、Z、W的原子半径依次增大,且原子最外层电子数之和为15,Y是地壳中含量最高的元素,Y与Z同主族,Z与W同周期。下列说法正确的是( D )
A.简单氢化物的还原性:Y>Z
B.Z的简单离子与W的简单离子具有相同的电子层结构
C.化合物WX2中既存在离子键,又存在共价键
D.X与Y形成的化合物可能使酸性KMnO4溶液褪色
解析:原子最外层电子数之和为15,Y是地壳中含量最高的元素,Y是O元素,Y与Z同主族,Z是S元素;X的半径小于O原子,所以X是H元素;Z与W同周期,W是Mg元素。A项,简单氢化物的还原性:H2S>H2O,错误;B项,S2-有3个电子层、Mg2+有2个电子层,错误;C项,MgH2只存在离子键,错误;D项,H2O2能使酸性KMnO4溶液褪色,正确。
4.我国有广阔的海上疆域,海水综合利用要符合可持续发展的要求,其联合工业体系(部分)如图所示,下列说法错误的是( A )
A.从苦卤中制溴和制盐的过程中都存在氧化还原反应
B.海水淡化的方法中,以日光为能源的蒸馏法最符合可持续发展的要求
C.海水制镁过程中用到的沉淀剂是石灰乳
D.氯碱工业的产品可用于生产盐酸、漂白液等
解析:A项,从苦卤中制盐的过程中不涉及化学变化,错误。
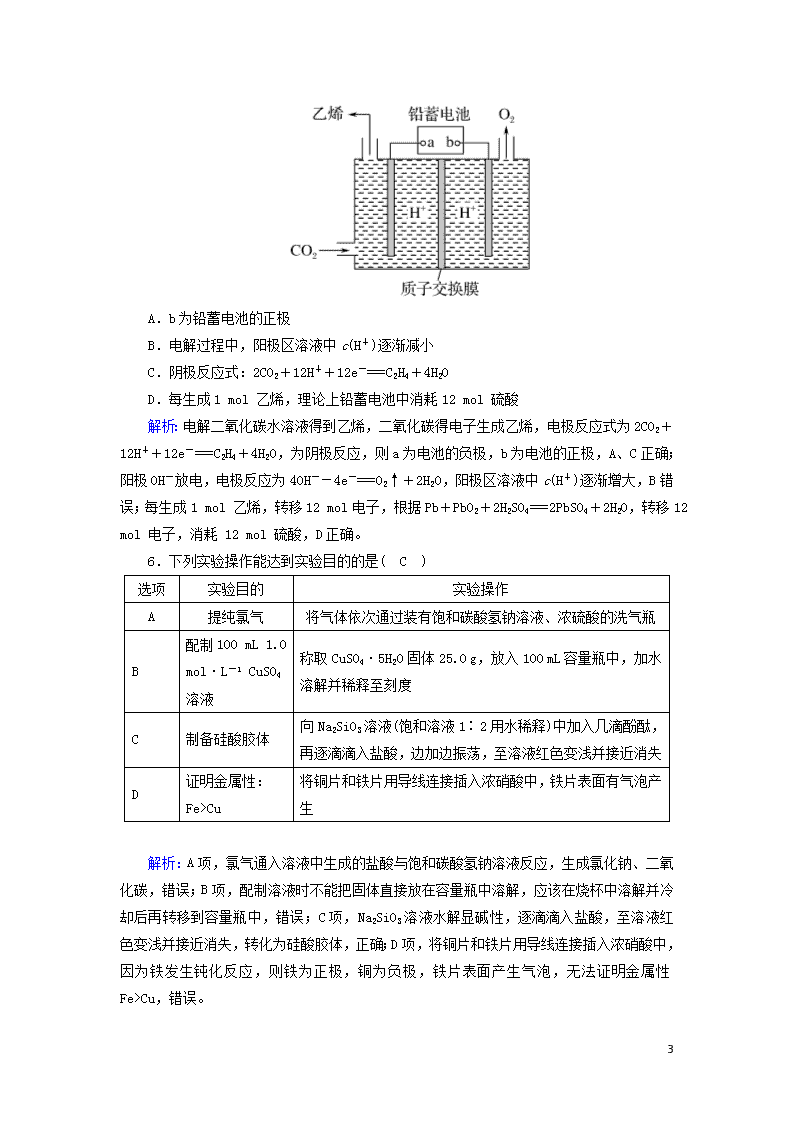
5.以铅蓄电池为电源将CO2转化为乙烯的装置如图所示,电解所用电极材料均为惰性电极。下列说法不正确的是( B )
4
A.b为铅蓄电池的正极
B.电解过程中,阳极区溶液中c(H+)逐渐减小
C.阴极反应式:2CO2+12H++12e-===C2H4+4H2O
D.每生成1 mol 乙烯,理论上铅蓄电池中消耗12 mol 硫酸
解析:电解二氧化碳水溶液得到乙烯,二氧化碳得电子生成乙烯,电极反应式为2CO2+12H++12e-===C2H4+4H2O,为阴极反应,则a为电池的负极,b为电池的正极,A、C正确;阳极OH-放电,电极反应为4OH--4e-===O2↑+2H2O,阳极区溶液中c(H+)逐渐增大,B错误;每生成1 mol 乙烯,转移12 mol电子,根据Pb+PbO2+2H2SO4===2PbSO4+2H2O,转移12 mol 电子,消耗 12 mol 硫酸,D正确。
6.下列实验操作能达到实验目的的是( C )
选项
实验目的
实验操作
A
提纯氯气
将气体依次通过装有饱和碳酸氢钠溶液、浓硫酸的洗气瓶
B
配制100 mL 1.0 mol·L-1 CuSO4溶液
称取CuSO4·5H2O固体25.0 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
C
制备硅酸胶体
向Na2SiO3溶液(饱和溶液1∶2用水稀释)中加入几滴酚酞,再逐滴滴入盐酸,边加边振荡,至溶液红色变浅并接近消失
D
证明金属性:
Fe>Cu
将铜片和铁片用导线连接插入浓硝酸中,铁片表面有气泡产生
解析:A项,氯气通入溶液中生成的盐酸与饱和碳酸氢钠溶液反应,生成氯化钠、二氧化碳,错误;B项,配制溶液时不能把固体直接放在容量瓶中溶解,应该在烧杯中溶解并冷却后再转移到容量瓶中,错误;C项,Na2SiO3溶液水解显碱性,逐滴滴入盐酸,至溶液红色变浅并接近消失,转化为硅酸胶体,正确;D项,将铜片和铁片用导线连接插入浓硝酸中,因为铁发生钝化反应,则铁为正极,铜为负极,铁片表面产生气泡,无法证明金属性Fe>Cu,错误。
4
7.若定义pc是溶液中微粒物质的量浓度的负对数,则常温下,一定浓度的某酸(H2A)水溶液中pc(H2A)、pc(HA-)、pc(A2-)随着溶液pH的变化曲线如图所示。下列说法一定正确的是( C )
A.pH=4时,c(HA-)c(A2-),故A错误;调节溶液pH的方法不确定,所以c(H2A)+c(HA-)+c(A2-)不一定是定值,故B错误;根据图示c(H2A)=c(HA-)时,pH=1.3,所以Ka1==c(H+)=10-1.3,故C正确;根据图示c(A2-)=c(HA-)时,pH=4.3,Ka2==c(H+)=10-4.3,HA-的水解常数Kh==10-12.7,电离大于水解,所以NaHA的水溶液呈酸性,故D错误。
4
相关文档
- 2020高考化学二轮复习选择题标准练2021-07-065页
- 2020高考化学冲刺600分选择题标准2021-07-054页
- 2020高考化学二轮复习选择题标准练2021-07-055页
- 2020高考化学冲刺600分选择题标准2021-07-054页
- 2020高考化学冲刺600分选择题标准2021-07-034页
- 2020高考化学冲刺600分选择题标准2021-07-024页
- 2020高考化学二轮复习选择题标准练2021-07-025页
- 2020高考化学二轮复习选择题标准练2021-07-023页
- 2020高考化学冲刺600分选择题标准2021-07-024页
- 2020高考化学二轮复习选择题标准练2021-07-023页