- 908.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
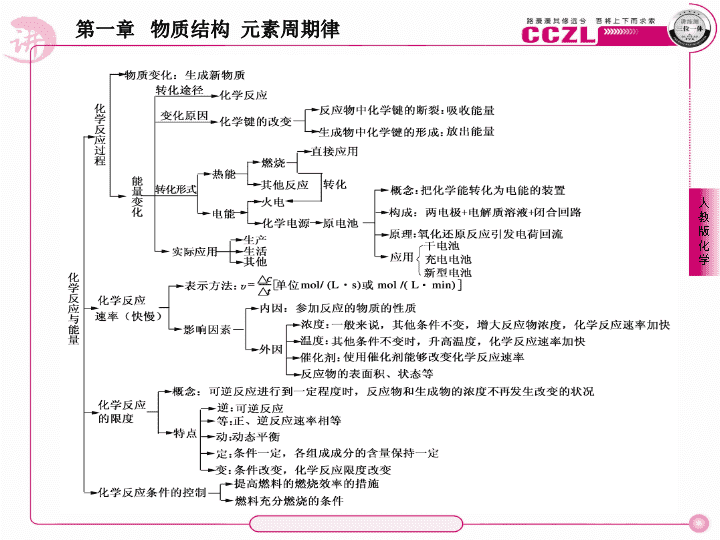
1.
化学反应的实质
化学反应的过程是旧物质的消耗和新物质生成的过程,因此化学反应的本质就是旧化学键断裂和新化学键形成的过程。
(1)
化学反应过程中反应物的化学键被破坏。如
H
2
+
F
2
===2HF
,
H
—
H
、
F
—
F
键均被破坏。
(2)
对离子化合物,其溶于水后,便成为自由移动的阴、阳离子,离子键被破坏。其熔化后,也成为自由移动的阴、阳离子,离子键被破坏。
(3)
对于共价化合物,有些共价化合物溶于水后,能与水作用,其分子内共价键被破坏。如
HCl
、
HBr
等。
2
.吸热反应与放热反应
吸热反应,从字面上讲就是吸收热量的反应,而放热反应,就是放出热量的反应。若从本质上分析,则可以从两个角度进行理解。一是从化学键的断裂与形成角度;二是从物质本身具有的能量角度。下面就逐一举例说明。
●
典例精析
【例
1
】 在人类生产、生活所需能量日益增多的今天,研究化学反应及其能量变化对合理利用常规能源和开发新能源具有十分重要的意义。下列说法中不正确的是
(
)
A
.任何化学反应都伴随着能量的变化
B
.化学反应中的能量变化都表现为热量的变化
C
.反应物的总能量高于生成物的总能量,反应释放能量
D
.若化学键形成时释放的能量小于旧化学键被破坏时需要吸收的能量,反应吸收能量
【解析
】
任何化学反应都伴随着能量的变化,但这种能量变化除了转化为热能的形式外,还可以转化为光能、电能等,因此
A
正确,
B
错误。一个确定的化学反应是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小或化学键形成时释放的能量与化学键被破坏时需要吸收的能量的相对大小,若反应物的总能量高于生成物的总能量或化学键形成时释放的能量大于化学键被破坏时需要吸收的能量则反应放出能量,否则吸收能量,故
C
、
D
均正确。
【答案
】
B
【例
2
】 下表中的数据是破坏
1 mol
物质中的化学键所吸收的能量
(kJ)
:
物质
Cl
2
Br
2
I
2
HCl
HBr
HI
H
2
能量
(kJ/mol)
243
193
151
432
366
301
436
根据上述数据回答下列问题。
(1)
下列氢化物中最稳定的是
(
)
A
.
HCl
B
.
HBr
C
.
HI
(2)
在相同条件下,
X
2
(X
代表
Cl
、
Br
、
I)
分别与氢气反应,当消耗等物质的量的氢气时,释放的能量最多的是
____________
。
【解析
】
(1)
在三种氢化物中,破坏
1 mol HCl
中的化学键所吸收的能量最大,说明
HCl
最稳定,
A
项正确。
(2)1 mol H
2
与
Cl
2
反应释放的能量为
2
×
432 kJ
-
(243 kJ
+
436 kJ)
=
185 kJ
;
1 mol H
2
与
Br
2
反应释放的能量为
2
×
366 kJ
-
(193 kJ
+
436 kJ)
=
103 kJ
;
1 mol H
2
与
I
2
反应释放的能量为
2
×
301 kJ
-
(151 kJ
+
436 kJ)
=
15 kJ
,综上可知
Cl
2
与
H
2
反应时释放的能量最多。
【答案
】
A
Cl
2
用下图所示的装置进行下列实验:
(
为便于观察,预先将
U
形管内的少量水染成红色
)
,完成下列空白。
(1)
向锥形瓶内加入一小片铝片和一定量的稀盐酸,一段时间后,可观察到
U
形管内液面的变化情况是
____________
,原因是
________________________
。
(2)
向锥形瓶内改加氢氧化钡晶体与氯化铵晶体的混合物,一段时间后,可观察到
U
形管内液面的变化情况是
________________________________
,原因是
__________________________________________
。
【解析
】
若锥形瓶内物质间不发生化学反应,则锥形瓶内的压强与大气压强相等,
U
形管两边的液面相平;若发生化学反应并放热,则会使锥形瓶内的空气受热膨胀,压强增大,此时
U
形管内左边液面下降,右边液面上升;若发生化学反应并吸热,则会使锥形瓶内的空气遇冷收缩,压强减小,此时
U
形管内左边液面上升,右边液面下降。
【答案
】
(1)
左边液面下降,右边液面上升 铝与稀盐酸反应产生气体并且放热,从而使锥形瓶内的气体压强增大
(2)
左边液面上升,右边液面下降
Ba(OH)
2
·
8H
2
O
与
NH
4
Cl
的反应是吸热反应,从而使锥形瓶内的气体压强减小
某同学在盛有少量
NaHCO
3
固体和
Na
2
CO
3
固体的试管中分别加入稀盐酸,反应后发现盛
NaHCO
3
固体的试管的温度有所下降,而盛
Na
2
CO
3
固体的试管的温度有所升高。由此他得出:不管其状态如何,
NaHCO
3
与稀盐酸的反应为吸热反应,而
Na
2
CO
3
与稀盐酸的反应为放热反应。
该同学得出结论的方法
____________(
填
“
正确
”
或
“
不正确
”
)
。
为研究上述反应是吸热反应还是放热反应,该同学又继续进行下列实验
(
每个实验各做
3
次平行实验,取平均值
)
:
序号
试剂
1
试剂
2
混合前的温度
混合后的最高
或最低温度
①
50 mL
水
2.5 g NaHCO
3
固体
20
℃
18.5
℃
②
50 mL
水
3.2 g Na
2
CO
3
固体
20
℃
23.0
℃
③
35 mL
稀盐酸
含
2.5 g NaHCO
3
的饱和溶液
15 mL
20
℃
18.8
℃
④
35 mL
稀盐酸
含
3.2 g Na
2
CO
3
的饱和溶液
15 mL
20
℃
20.6
℃
⑤
50 mL
稀盐酸
2.5 g NaHCO
3
固体
20
℃
17.4
℃
⑥
50 mL
稀盐酸
3.2 g Na
2
CO
3
固体
20
℃
23.5
℃
请填写下列空白。
(1)
该实验报告的题目是
《
____________
》
。
(2)
该实验中所用的仪器除试管、药匙
(
或
V
形纸槽
)
、气球、玻璃棒、烧杯、量筒、保温瓶外,还需要的仪器是
____________
和
____________
。
(3)
通过上述实验可得如下结论:
A
.
NaHCO
3
固体的溶解是
____________(
填
“
吸热
”
或
“
放热
”
,下同
)
过程。
B
.饱和
Na
2
CO
3
溶液与稀盐酸的反应是
________
反应。
C
.
NaHCO
3
固体与稀盐酸反应的能量变化约是
____________
的能量变化之和。
【解析
】
反应热与物质的状态有关,在电解质的溶解过程中,除了存在扩散作用
(
吸收热量
)
和水合作用
(
放出热量
)
外,还有电离过程
(
吸收热量
)
,而温度的变化反映的是整个变化过程中热量变化的总结果。
(1)
实验报告的题目要能反映整个实验的目的。
(2)
实验中要称量
NaHCO
3
和
Na
2
CO
3
的质量,要测量溶液的温度,所以还需要托盘天平和温度计。
(3)
分析时可以将实验
①③⑤
的三组数据联系起来比较。实验
①
说明
2.5 g NaHCO
3
固体溶于
50 mL
水后溶液的温度降低
1.5
℃
。实验
③
说明含
2.5 g NaHCO
3
的溶液与足量稀盐酸反应后溶液的温度降低
1.2
℃
。实验
⑤
包括两个过程:一是
NaHCO
3
固体溶于水;二是
NaHCO
3
与
HCl
反应。当反应物的量和溶液的体积相同时,反应后溶液的温度降低
2.6
℃
,与实验
①
和实验
③
降低的温度之和大致相等。同理可以分析实验
②④⑥
,最终得出相应的结论。
【答案
】
不正确
(1)NaHCO
3
固体、
Na
2
CO
3
固体与稀盐酸反应过程中能量变化的研究
(2)
托盘天平 温度计
(3)A.
吸热
B
.放热
C
.
NaHCO
3
固体溶解和
NaHCO
3
饱和溶液与稀盐酸反应
1.
化学能与电能的转化
工业发电是将燃料燃烧转化为热能,再通过蒸汽机转化为机械能,最后通过发电机转化为电能,电能也是使用方便、无污染的二次能源。
原电池是将化学能转化为电能的装量,其构成前提是能自发地进行氧化还原反应,其构成条件是两个活泼性不同的电极,电解溶液,形成闭合回路。电极构成一般为:负极
—
还原性相对较强的材料,负极向外电路提供电子,发生氧化反应,正极
—
还原性相对较弱的材料,正极从外电路得到电子,发生还原反应。判断正负极要特别注意电解质溶液的影响。
2
.原电池原理的应用
(1)
比较还原性的强弱
在原电池的两极中,负极金属失电子被氧化。一般来说,负极金属的还原性强于正极金属。
(2)
比较反应速率的大小
对于同一个氧化还原反应,组成原电池时的反应速率一般比直接发生反应时的大,且电解质溶液浓度越大,反应速率越大。
(3)
比较金属腐蚀的快慢
在电解质溶液中,负极金属先被腐蚀,两种金属还原性差别越大,负极金属被腐蚀得就越快。
(4)
设计原电池理论上说,任何一个氧化还原反应都可以设计成原电池。
【例
3
】
(
浙江金华市
2009
~
2010
学年度高一下学期期末试题,
16)
将相同表面积的纯锌片和纯铜片按图所示同时插入相同浓度的稀硫酸中,以下有关叙述正确的是
(
)
A
.甲装置中电能转化为化学能
B
.乙装置产生气泡速率比甲装置快
C
.乙装置中铜片上发生
2H
+
+
2e
-
===H
2
↑
D
.甲装置中铜片表面有气泡产生
【解析
】
甲装置形成原电池,而乙装置不是原电池。原电池的化学反应速率要快,它将化学能转化为电能,负极失去电子,正极得到电子发生还原反应,甲池中
Cu
极会产生
H
2
气泡。
【答案
】
D
【例
4
】 关于右图装置的叙述,正确的是
(
)
A
.铜是阳极,铜片上有气泡产生
B
.铜片质量减小
C
.电流从锌片经导线流向铜片
D
.氢离子在铜片表面被还原
【解析
】
电池的化学反应情况是:
总化学反应式:
Zn
+
2H
+
===Zn
2
+
+
H
2
负极
(Zn)
反应式:
Zn
-
2e
-
===Zn
2
+
正极
(Cu)
反应式:
2H
+
+
2e
-
===H
2
【答案
】
D
(2010
年福建福州市高一第二学期模拟考试,
19)
以下装置能形成原电池的是
(
)
【答案
】
D
如下图所示,电流表
G
发生偏转,同时
A
极逐渐变粗,
B
极逐渐变细,
C
为电解质溶液。则
A
、
B
、
C
分别为
(
)
A
.
A
是
Zn
,
B
是
Cu
,
C
是稀
H
2
SO
4
B
.
A
是
Cu
,
B
是
Zn
,
C
是稀
H
2
SO
4
C
.
A
是
Fe
,
B
是
Ag
,
C
是稀
AgNO
3
溶液
D
.
A
是
Ag
,
B
是
Fe
,
C
是稀
AgNO
3
溶液
【解析
】
由题意知,
A
为原电池正极,
B
为负极,故
B
金属性强于
A
,且电解质溶液中金属阳离子对应的单质的活泼性弱于
B
,则符合条件的是
D
。
【答案
】
D
1.
化学反应速率大小的比较
(1)
同一化学反应,如
a
A
+
b
B
=
c
D
+
d
D
,由于选用不同的物质的浓度的变化表示该反应速率,其速率值可能相同,也可能不同,但意义相同,表示的是同一反应速率,各物质的反应速率之比,等于它们在该反应化学方程式中的化学计量数之比,即
v
(A):
v
(B):
v
(C):
v
(D
)
=
a
;
b
:
c
:
d
。
(2)
比较反应速率大小时,决不能单纯地比较各物质反应速率数值大小
(
即数值大的速率不一定反应快
)
,还要结合化学方程式中各物质的化学计量数的大小进行比较。
(3)
比较同一个化学反应的反应速率大小时,应将所给的各物质的反应速率转化成同一种物质来比较大小。
(4)
注意单位是否统一。
2
.除温度、浓度、催化剂、固体表面积、光等,其他条件对化学反应速率的影响
(1)
固体物质对反应速率的影响
对于有固体参加的化学反应而言,由于在一定条件下,固体的浓度是固定的,所以有固体物质参加的化学反应中浓度不改变,因此在表示化学反应速率时,不能用固体物质。但因为固体物质的反应是在其表面进行的,故与其表面积有关,当固体颗粒变小时,会增大表面积,加快反应速率,固体量的增减对反应速率一般无影响。
(2)
稀有气体对反应速率的影响
稀有气体或其他非反应气体,充入反应容器中,分以下两种情况讨论:
①
若在恒温恒容条件下充入稀有气体或其他非反应气体,虽改变了容器内气体的压强,但各物质浓度不变,因而不影响化学反应速率。
②
若在恒温恒压条件下充入稀有气体或其他非反应气体,由于要保持压强不变,因而容器体积会增大,各反应物的浓度均减小,因而化学反应速率减慢。
(3)
原电池的形成对化学反应速率的影响
3
.常用于判断反应达到平衡的依据
(1)
直接判断法
①
体系中各组分的物质的量浓度或体积分数、物质的量分数保持不变。
②
依据
v
(
正
)
=
v
(
逆
)
判断反应达到平衡状态。
③
对同一物质而言,单位时间内,断裂化学键的物质的量与形成化学键的物质的量相等。
以可逆反应
a
A
+
b
B
c
C
+
d
D
为例,其反应速率
v
(
正
)
、
v
(
逆
)
分别有
4
种表示方法:
(2)
间接判断法
①
对于有气体参加或生成的体积可变反应,体系的压强不随时间而变化。例如:
N
2
+
3H
2
2NH
3
。
②
任何化学反应都伴随着能量变化,在其他条件不变的条件下,体系温度不随时间而变化。
③
对于有颜色物质参加或生成的可逆反应,体系的颜色不再随时间而变化,如
2NO
2
(g)
N
2
O
4
(g)
。
④
体系中某反应物的转化率或某生成物的产率达到最大值且不再随时间而变化。
温馨提示:
判断可逆反应是否达到化学平衡,首先必须对平衡的本质和达到平衡时的标志有深刻的理解,然后还需注意题中可逆反应的具体特征和反应所处的具体条件。如等温等压、等温等容等。
●
典例精析
【例
5
】 反应
A
+
3B===2C
+
2D
在四种不同情况下的反应速率分别为:
①
v
(A
)
=
0.15 mol/(L
·
s
)
②
v
(B
)
=
0.6 mol/(L
·
s
)
③
v
(C
)
=
0.4 mol/(L
·
s
)
④
v
(D
)
=
0.45 mol/(L
·
s
)
该反应进行的快慢顺序为
____________
。
【答案
】
④
>
③
=
②
>
①
【例
6
】
100 mL
浓度为
2 mol/L
的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
(
)
A
.加入适量的
6 mol/L
的盐酸
B
.加入数滴氯化铜溶液
C
.加入适量蒸馏水
D
.加入适量氯化钠溶液
【解析
】
题中告知
HCl
(
盐酸
)
是定量的,
Zn
是过量的;又规定只加快化学反应速率、不影响生成氢气的总量,所以
A
、
C
、
D
均不可选。加入数滴氯化铜溶液后,
Zn
与
Cu
2
+
反应生成
Cu
,
Zn
与
Cu
附着在一起在盐酸中形成了原电池,电极反应式是:
负极:
Zn
-
2e
-
===Zn
2
+
正极:
2H
+
+
2e
-
===H
2
【答案
】
B
【例
7
】
(
山东聊城市莘县实验高中
2009
~
2010
学年度第二学期期中,
12)
对处于化学平衡的体系,以化学平衡与化学反应速率的关系可知
(
)
A
.化学反应速率变化时,化学平衡一定发生移动
B
.化学平衡发生移动时,化学反应速率一定变化
C
.正反应速率增大时,化学平衡一定向右移动
D
.只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况
【解析
】
化学反应速率应发生相对变化时,化学平衡一定发生移动,若化学反应速率相同的变化时,变化后速率仍然相等,则化学平衡将不会发生移动,而只要化学平衡发生移动,则一定是反应速率发生了相对改变所致,故
A
项错、
B
项正确。对于正反应速率增大时,而逆反应速率变化怎样不知,故化学平衡是否移动或向哪移动则无法判断,故
C
项错误。不仅是只有催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况,若是反应前后气体的系数相等时,改变压强也会使化学反应速率变化,而化学平衡不移动的情况产生,故
D
项错误。
【答案
】
B
【例
8
】 把在空气中久置的铝片
5.0 g
投入盛有
500 mL 0.5 mol
·
L
-
1
硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用下图所示的坐标曲线来表示,完成下列问题:
(1)
曲线由
O
a
段不产生氢气的原因
____________________________
,有关的化学方程式为
____________________________
。
(2)
曲线由
a
c
段,产生氢气的速率增加较快的主要原因:
____________________________
。
(3)
曲线在
c
点以后,产生氢气的速率逐渐下降的主要原因
____________________________
。
【解析
】
(1)
在空气中久置的铝片表面有氧化铝薄膜,因此,硫酸首先和氧化铝反应,不产生氢气。
(2)a
c
段,虽然硫酸的浓度渐小,但是该反应是放热反应,使温度升高,化学反应速率加快。
(3)
曲线在
c
点以后,硫酸的浓度逐渐减小,成为影响化学反应速率的主要因素,因此,化学反应速率逐渐下降。
【答案
】
(1)
在空气中久置的铝片表面有氧化铝薄膜,因此,硫酸首先和氧化铝反应,不产生氢气
Al
2
O
3
+
3H
2
SO
4
===Al
2
(SO
4
)
3
+
3H
2
O
(2)
该反应是放热反应,使温度升高,化学反应速率加快
(3)
硫酸的浓度逐渐减小,化学反应速率逐渐下降
对于可逆反应
4NH
3
(g)
+
5O
2
(g)
4NO(g)
+
6H
2
O(g)
,下列叙述正确的是
(
)
A
.达到化学平衡时,
4
v
正
(O
2
)
=
5
v
逆
(NO)
B
.若单位时间内生成
x
mol NO
的同时,消耗
x
mol NH
3
,则反应达到平衡状态
C
.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D
.化学反应速率关系是:
2
v
正
(NH
3
)
=
3
v
正
(H
2
O)
【解析
】
根据化学反应中,各物质的计量数之比等于它们表示的反应速率之比且
v
正
=
v
逆
知
A
项正确;化学平衡状态的判定要本着体现
“
同时、双向进行
”
原则,
B
项中
x
mol NO
生成与
x
mol NH
3
消耗是单向即同向的,均表示
v
正
;增大容积相当于减小压强,正逆反应速率都减小;化学反应速率关系应为
3
v
正
(NH
3
)
=
2
v
正
(H
2
O)
。
【答案
】
A
在一定温度下发生如下反应:
N
2
(g)
+
3H
2
(g)
2NH
3
(g)
。起始时充入的
N
2
和
H
2
的物质的量分别是
3.0 mol
和
6.0 mol
,平衡时,生成
NH
3
的物质的量是
2.4 mol
,已知容器容积为
5.0 L
,试求:
(1)H
2
的转化率。
(2)
平衡时混合气体中
N
2
的体积分数。
【答案
】
(1)H
2
的转化率是
60%
。
(2)
平衡时混合气体中
N
2
的体积分数是
27%
。
●
资料备选
关于书写原电池电极反应式应注意的问题
1
.先准确判断出正、负极上谁得失电子,在这一点上可依据题干中内容或化学方程式来确定;
2
.关注正、负极得失电子后的产物,这一点可依据化学方程式中的生成物确定;
3
.关注电解质溶液,因个别电极反应式受电解质溶液影响,其生成物存在的形式往往发生改变;
4
.书写时应遵循正、负极得失电子数相等的原则,即两电池反应式相加可得总氧化还原反应方程式。
相关文档
- 2018-2019学年黑龙江省大庆实验中2021-07-0623页
- 宿迁市2018~2019学年第二学期期末2021-07-0610页
- 2021版化学名师讲练大一轮复习鲁科2021-07-066页
- 2018届一轮复习人教版化学反应进行2021-07-0619页
- 化学卷·2019届福建省莆田第九中学2021-07-069页
- 河北省南宫中学2019-2020学年高一2021-07-0610页
- 2019-2020学年广东省阳春市第一中2021-07-069页
- 山西大学附属中学2020-2021高二化2021-07-069页
- 2018-2019学年吉林省吉林市第五十2021-07-0612页
- 吉林省延边第二中学2019-2020学年2021-07-0620页