- 191.31 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业18 铝及铝合金
时间:45分钟 满分:100分
一、选择题(每小题4分,共48分)
1.1989年世界卫生组织把铝确定为食品污染源之一,而加以控制使用。铝在下列应用中应加以控制的是( B )
①制铝合金 ②制电线 ③制炊具 ④制银色漆颜料 ⑤明矾净水 ⑥明矾与苏打制食品膨松剂 ⑦制易拉罐 ⑧用Al(OH)3凝胶制胃舒平药片 ⑨包装糖果和小食品
A.③⑤⑧⑨ B.③⑤⑥⑦⑧⑨
C.③⑤⑨ D.⑥⑧⑨
解析:铝元素在人体内积累会造成伤害。铝在③制炊具、⑤明矾净水、⑥明矾与苏打制食品膨松剂、⑦制易拉罐、⑧用Al(OH)3凝胶制胃舒平药片、⑨包装糖果和小食品中需要加以控制,故选B。
2.下列各项操作中,发生“先产生沉淀,后沉淀又溶解”的现象的是( A )
①向AlCl3溶液中通入过量的NH3
②向Fe(OH)3胶体中逐滴加入过量的稀硫酸
③向NaOH溶液中逐滴加入过量的AlCl3溶液
④向Ca(OH)2溶液中通入过量的CO2
A.②④ B.②③④
C.②③ D.③④
解析:向AlCl3溶液中通入过量的NH3生成Al(OH)3沉淀,沉淀不溶解,故①错误。向Fe(OH)3胶体中逐滴加入过量的稀硫酸,胶体先产生聚沉现象,有沉淀生成;然后氢氧化铁和硫酸反应生成水和硫酸铁,最终沉淀溶解,故②正确。向NaOH溶液中逐滴加入过量的AlCl3溶液时先后发生反应Al3++4OH-===AlO+2H2O,3AlO+6H2O+Al3+===4Al(OH)3↓,现象是:先不产生沉淀,一段时间后产生沉淀,故③错误。向Ca(OH)2溶液中通入CO2,先反应生成CaCO3沉淀,Ca(OH)2完全转化为CaCO3后,继续通入的CO2会与CaCO3反应生成可溶的Ca(HCO3)2,沉淀又溶解,故④正确。
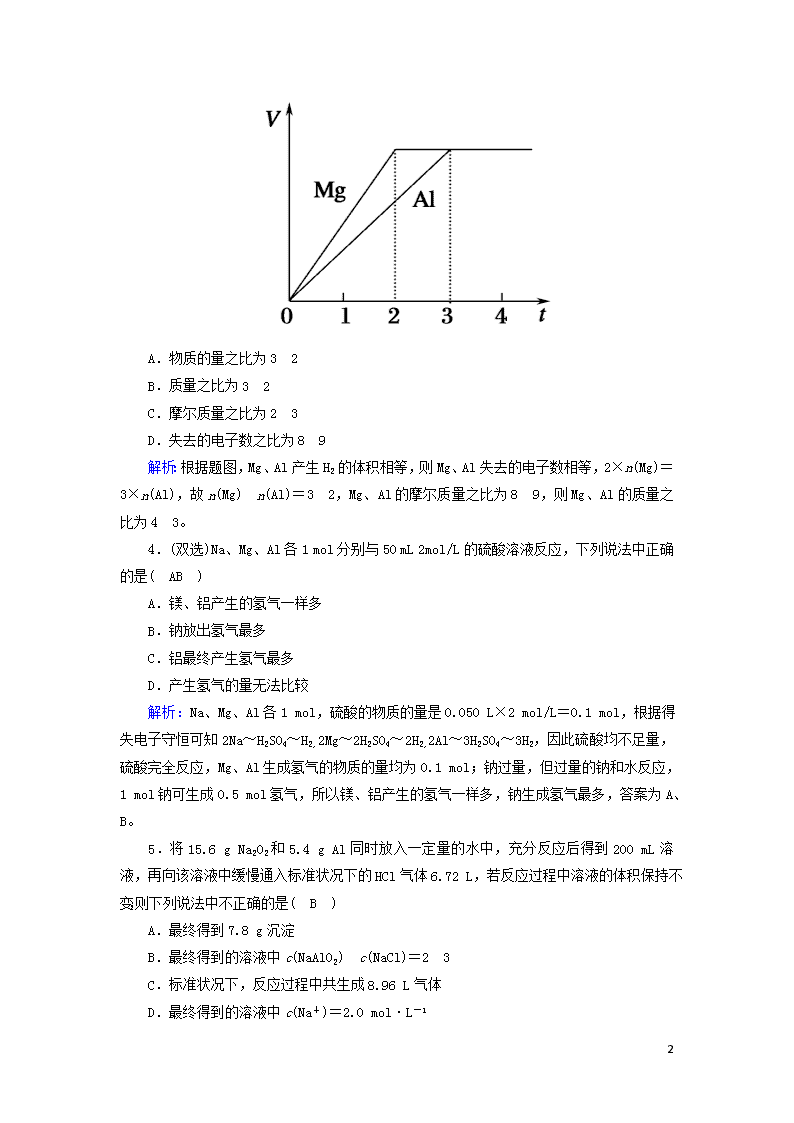
3.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示。反应中镁和铝的( A )
9
A.物质的量之比为32
B.质量之比为32
C.摩尔质量之比为23
D.失去的电子数之比为89
解析:根据题图,Mg、Al产生H2的体积相等,则Mg、Al失去的电子数相等,2×n(Mg)=3×n(Al),故n(Mg)n(Al)=32,Mg、Al的摩尔质量之比为89,则Mg、Al的质量之比为43。
4.(双选)Na、Mg、Al各1 mol分别与50 mL 2mol/L的硫酸溶液反应,下列说法中正确的是( AB )
A.镁、铝产生的氢气一样多
B.钠放出氢气最多
C.铝最终产生氢气最多
D.产生氢气的量无法比较
解析:Na、Mg、Al各1 mol,硫酸的物质的量是0.050 L×2 mol/L=0.1 mol,根据得失电子守恒可知2Na~H2SO4~H2,2Mg~2H2SO4~2H2,2Al~3H2SO4~3H2,因此硫酸均不足量,硫酸完全反应,Mg、Al生成氢气的物质的量均为0.1 mol;钠过量,但过量的钠和水反应,1 mol钠可生成0.5 mol氢气,所以镁、铝产生的氢气一样多,钠生成氢气最多,答案为A、B。
5.将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,若反应过程中溶液的体积保持不变,则下列说法中不正确的是( B )
A.最终得到7.8 g沉淀
B.最终得到的溶液中c(NaAlO2)c(NaCl)=23
C.标准状况下,反应过程中共生成8.96 L气体
D.最终得到的溶液中c(Na+)=2.0 mol·L-1
9
解析:15.6 g Na2O2的物质的量为0.2 mol,5.4 g Al的物质的量为0.2 mol。将两者同时放入一定量的水中,Na2O2与水反应生成0.4 mol NaOH和0.1 mol O2;0.2 mol Al要消耗0.2 mol NaOH生成0.2 mol NaAlO2和0.3 mol H2,所以还剩余0.2 mol NaOH;充分反应后得到200 mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72 L,即0.3 mol HCl,剩余的0.2 mol NaOH先消耗0.2 mol HCl,反应生成0.2 mol NaCl;剩余的0.1 mol HCl与0.1 mol NaAlO2反应生成0.1 mol Al(OH)3和0.1 mol NaCl;故最终溶液中含有0.3 mol NaCl和0.1 mol NaAlO2。最终得到0.1 mol Al(OH)3沉淀,其质量为7.8 g,A项正确;最终得到的溶液中c(NaAlO2)c(NaCl)=13,B项不正确;反应过程中共生成0.1 mol氧气和0.3 mol氢气,在标准状况下,气体的总体积为8.96 L,C项正确;由钠原子守恒可知,最终得到的溶液中c(Na+)=0.4 mol÷0.2 L=2.0 mol·L-1,D项正确。
6.将a mol钠和a mol铝一同投入m g足量水中,所得溶液密度为d g·mL-1,该溶液中溶质的质量分数为( C )
A.% B.%
C.% D.%
解析:由于2Na+2H2O===2NaOH+H2↑
a mol a mol mol
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
a mol a mol a mol a mol
即a mol钠与水反应生成的NaOH恰好被a mol Al消耗掉,所得溶液为NaAlO2溶液。
则w(NaAlO2)=×100%=%。
7.甲、乙两烧杯中分别盛有300 mL浓度均为1 mol·L-1的稀硫酸与NaOH溶液,向两烧杯中分别加入x g铝粉,充分反应后,收集到H2的体积分别为V(甲)、V(乙)(标准状况下),下列有关叙述正确的是( C )
A.若=,则x>8.1
B.若=1,则05.4
H2SO4不足量、Al过量
6.72 L
铝与氢氧化钠溶液反应的关系式为2Al~2NaOH~3H2,
铝粉质量x g
NaOH、Al反应情况
H2体积(标准状况下)
x=8.1
NaOH与Al恰好完全反应
10.08 L
x<8.1
NaOH过量、Al不足量
L
x>8.1
NaOH不足量、Al过量
10.08 L
综上所述,当x≥8.1时,==,A、D项错误;当0
相关文档
- 【化学】宁夏海原县第一中学2019-22021-07-068页
- 2019届一轮复习人教版有机化学基础2021-07-0612页
- 高中化学必修一必修二知识点总结2021-07-0631页
- 2018-2019学年河南省鹤壁市淇滨高2021-07-0618页
- 【化学】广东第二师范学院番禺附属2021-07-0613页
- 新疆奇台县 2016-2017 学年高二化2021-07-067页
- 北京市清华附中2019-2020学年高一2021-07-0629页
- 2019届一轮复习鲁科版化学能转化为2021-07-068页
- 2018-2019学年江西省上饶中学高二2021-07-068页
- 2020鲁科版高考化学复习规范练 (7)2021-07-068页