- 409.57 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
龙泉中学、荆州中学、宜昌一中2020年秋季学期
高三九月联考
化 学 试 题
本试卷共4页,共20题。满分100分,考试用时90分钟
★祝考试顺利★
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 K39 S32 Cl35.5
第I卷 选择题(共40分)
一、选择题:本题共10小题,每小题2分。共20分。每小题只有一个选项符合题意。
1.下列说法正确的是( )
A.冠状病毒粒子直径约60220nm,故介于溶液和胶体粒子之间
B.装有无水硫酸铜的透气袋可以用作食品干燥剂
C.二氧化硅可用做计算机芯片
D.免洗手消毒液的成分活性银离子、乙醇均能使蛋白质变性
2.下列表示正确的是( )
A.二氧化碳的比例模型: B.丙醛的键线式:
C.次氯酸的电子式: D.异丙醇的结构简式:CH3 CH(OH)CH3
3.下列属于非电解质,但溶于水所得溶液能导电的是( )
A.液氯 B.干冰 C.生石灰 D.冰醋酸
4.下列说法不正确的是( )
A.铝盐、铁盐水解形成胶体,可用于净水
B.臭氧具有强氧化性,可用于泳池消毒
C.浓硫酸可使胆矾失去结晶水,体现了脱水性
D.浓硝酸常因溶解了二氧化氮而呈黄色
5.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2.8g乙烯中含有的共用电子对数目为0.5NA
B.100 mL 18mol·L-1浓硫酸常温下与足量金属铜反应转移电子数为1.8NA
C.标况下,2.24L HF中含有的分子数目为0.1NA
D.18g C60和石墨的混合物中含有的碳原子数目为1.5NA
6.将磁性氧化铁放入稀HNO3中可发生如下反应:3Fe3O4 + 28HNO3 =9Fe(NO3)x + NO↑+ 14H2O下列判断不合理的是( )
A.Fe(NO3)x中的x为3
B.反应中每还原0.4 mol氧化剂,就有1.2 mol电子转移
C.稀HNO3在反应中表现氧化性和酸性
D.磁性氧化铁中的所有铁元素全部被氧化
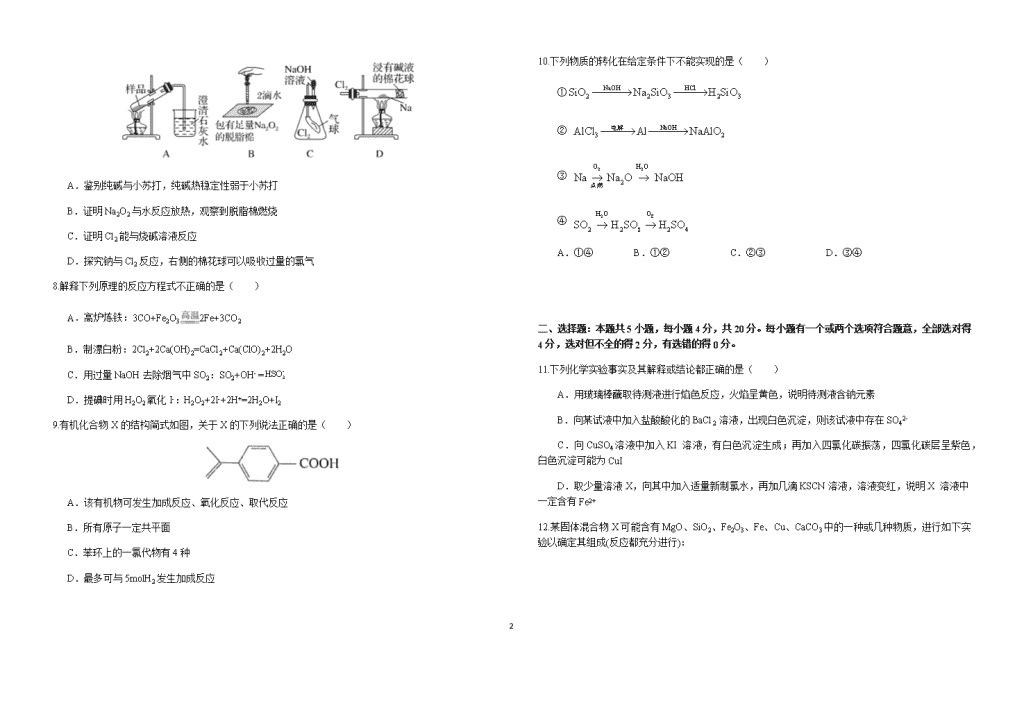
7.用如图所示实验装置进行相关实验探究,其中装置或结论不合理的是( )
8
A.鉴别纯碱与小苏打,纯碱热稳定性弱于小苏打
B.证明Na2O2与水反应放热,观察到脱脂棉燃烧
C.证明Cl2能与烧碱溶液反应
D.探究钠与Cl2反应,右侧的棉花球可以吸收过量的氯气
8.解释下列原理的反应方程式不正确的是( )
A.高炉炼铁:3CO+Fe2O32Fe+3CO2
B.制漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C.用过量NaOH去除烟气中SO2:SO2+OH- =
D.提碘时用H2O2氧化I
:H2O2+2I-+2H+=2H2O+I2
9.有机化合物X的结构简式如图,关于X的下列说法正确的是( )
A.该有机物可发生加成反应、氧化反应、取代反应
B.所有原子一定共平面
C.苯环上的一氯代物有4种
D.最多可与5molH2发生加成反应
10.下列物质的转化在给定条件下不能实现的是( )
①
②
③
④
A.①④ B.①② C.②③ D.③④
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列化学实验事实及其解释或结论都正确的是( )
A.用玻璃棒蘸取待测液进行焰色反应,火焰呈黄色,说明待测液含钠元素
B.向某试液中加入盐酸酸化的BaCl2 溶液,出现白色沉淀,则该试液中存在SO42-
C.向CuSO4溶液中加入KI 溶液,有白色沉淀生成;再加入四氯化碳振荡,四氯化碳层呈紫色,白色沉淀可能为CuI
D.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X 溶液中一定含有Fe2+
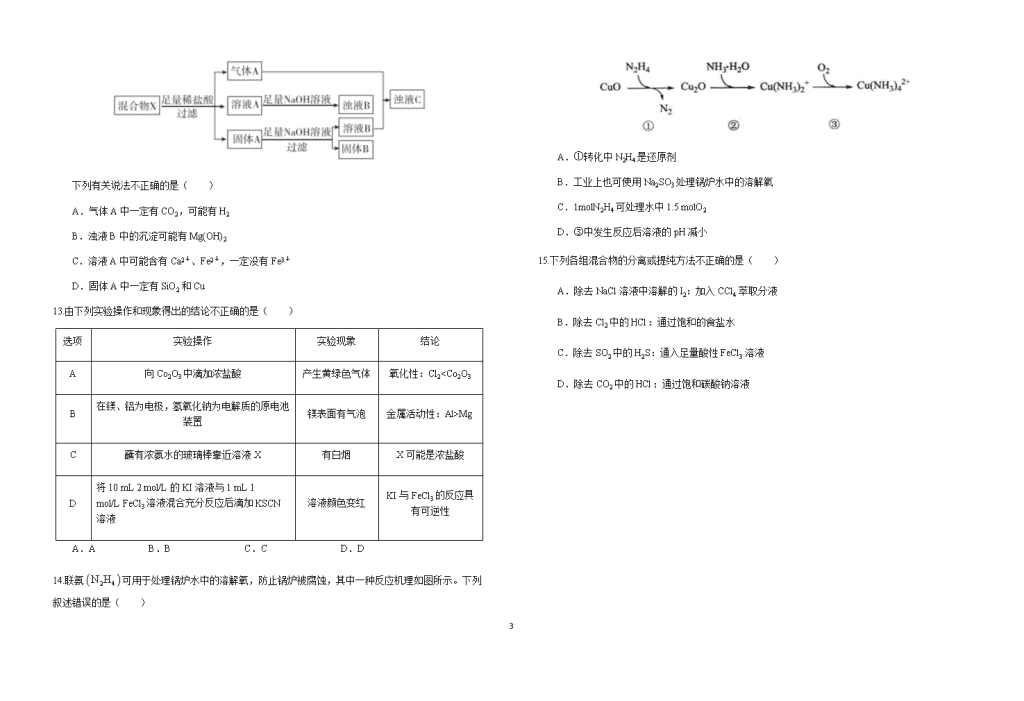
12.某固体混合物X可能含有MgO、SiO2、Fe2O3、Fe、Cu、CaCO3中的一种或几种物质,进行如下实验以确定其组成(反应都充分进行):
8
下列有关说法不正确的是( )
A.气体A中一定有CO2,可能有H2
B.浊液B中的沉淀可能有Mg(OH)2
C.溶液A中可能含有Ca2+、Fe2+,一定没有Fe3+
D.固体A中一定有SiO2和Cu
13.由下列实验操作和现象得出的结论不正确的是( )
选项
实验操作
实验现象
结论
A
向Co2O3中滴加浓盐酸
产生黄绿色气体
氧化性:Cl2Mg
C
蘸有浓氨水的玻璃棒靠近溶液X
有白烟
X可能是浓盐酸
D
将10 mL 2 mol/L的KI溶液与1 mL 1 mol/L FeCl3溶液混合充分反应后滴加KSCN溶液
溶液颜色变红
KI与FeCl3的反应具有可逆性
A.A B.B C.C D.D
14.联氨可用于处理锅炉水中的溶解氧,防止锅炉被腐蚀,其中一种反应机理如图所示。下列叙述错误的是( )
A.①转化中N2H4是还原剂
B.工业上也可使用Na2SO3处理锅炉水中的溶解氧
C.1molN2H4可处理水中1.5 molO2
D.③中发生反应后溶液的pH减小
15.下列各组混合物的分离或提纯方法不正确的是( )
A.除去NaCl溶液中溶解的I2:加入CCl4萃取分液
B.除去Cl2中的HCl:通过饱和的食盐水
C.除去SO2中的H2S:通入足量酸性FeCl3溶液
D.除去CO2中的HCl:通过饱和碳酸钠溶液
8
第Ⅱ卷 非选择题(共60分)
三、非选择题
16.(12分)二氧化氯(ClO2)是一种黄绿色气体,易溶于水,熔点为-59.5℃,沸点为11.0℃,浓度过高时易发生分解引起爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:___________________________________________。
(2)某小组设计了如图所示的实验装置用于制备ClO2。
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是________________。
②装置A用于生成ClO2气体,该反应的离子方程式为________________。
③装置B的作用是____________________
④当看到装置C中导管液面上升时应__________(选填“加快”或者“减慢”) 氮气的通入速率。
(3)设计以下装置测ClO2的质量。如图所示:
过程如下:
步骤1:在锥形瓶中加入足量的碘化钾,用100mL水溶解后,再加3mL硫酸溶液;
步骤2:按照右图组装好仪器;在玻璃液封管中加入①中溶液,浸没导管口;
步骤3:将生成的ClO2由导管通入锥形瓶的溶液中,充分吸收后,把玻璃液封管中的水封溶液倒入锥形瓶中,洗涤玻璃液封管2—3次,都倒入锥形瓶,再向锥形瓶中加入几滴淀粉溶液;
步骤4:用c mol·L−1 Na2S2O3标准液滴定锥形瓶中的液体,共用去V mL Na2S2O3溶液(已知:I2+2S2O32-=2I−+S4O62-)。
①装置中玻璃液封管的作用是_____________。
②测得通入ClO2的质量m(ClO2)=___________g(用整理过的含c、V的代数式表示)。
17. (14分) 对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应原理和装置图如下:
+MnO2
常温条件下的有关数据如下表所示:
相对分子质量
熔点/℃
沸点/℃
密度/g·cm-3
颜色
水溶性
8
对氯甲苯
126.5
7.5
162
1.07
无色
难溶
对氯苯甲酸
156.5
243
275
1.54
白色
微溶
对氯苯甲酸钾
194.5
具有盐的通性,属于可溶性盐
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g。
请回答下列问题:
(1)装置B的名称是____________,冷凝水由______(选填“a”或者“b”)处通入。
(2)量取6.00mL对氯甲苯应选用的仪器是____________。(填选仪器序号)
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是__________________。
(4)第一次过滤的目的是____________。滤液中加入稀硫酸酸化,可观察到的实验现象是________________________。
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是______________________________。
(6)本实验的产率是________________(保留3位有效数字)。
18.(11分)氟碳铈矿(主要成分为CeFCO3,还有其它稀土元素)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:
已知:铈的常见化合价为+3、+4。四价铈不易进入溶液,而三价铈易进入溶液。
(1)焙烧后生成CeO2 ,焙烧氟碳铈矿的目的是______________________。
(2)酸浸时双氧水的作用是____________。
(3)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_______________________________________。
(4)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为Ce3+ (水层)+3HT(有机层)CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:_________。
(5)已知,298K时,Ksp[Ce(OH)3]=5×l0-20,若溶液中c(Ce3+)=0.05mol·L-1,加碱调节pH到______________时Ce3+开始沉淀(忽略加碱过程中溶液体积变化)。
(6)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:________________________。
19.(13分)有机物G可用作光电材料,其一种合成路线如图:
已知:①(R,表示氢或烃基)
②+HI→+CH3I
回答下列问题:
(1)A是一种烃,化学名称为________,反应①的反应类型是__________。
8
(2)反应②的化学方程式为____________,C中官能团的名称是________、___________。
(3)D的结构简式是____________。反应③和⑤的目的是______________。
(4)E有多种同分异构体,请写出其中能同时满足以下条件的芳香化合物的结构简式:__________、_________。
①能与NaHCO3反应产生CO2;
②能发生银镜反应;
③能与FeCl3发生显色反应;
④核磁共振氢谱有4组峰。
(5)设计以1,2-二溴乙烷和甲醛为起始原料制备的合成路线:_____________(无机试剂任选)。
20. (10分)填空。
(1)根据下图回答相关问题:
该图所示进行的是过滤操作,图中还缺少的仪器是________,其作用是___________。
(2)填写仪器名称:
①制取蒸馏水的受热容器是________。
②石油蒸馏装置中通水冷却的仪器是____________。
③用于分液的关键仪器是____________。
(3)已知,NaBiO3是一种不溶于水的固体,将其加入含有Mn2+的酸性溶液中,溶液变为紫红色,Bi元素变为无色的Bi3+。写出该反应的离子反应方程式_____________________。
(4)比较酸性强弱:H2SO4______HClO4(填“>”、“=”或“<”)。 已知,次氯酸的酸性介于碳酸和碳酸氢根之间,比较ClO-、HCO3-结合氢离子的强弱 ____________。
8
龙泉中学、荆州中学、宜昌一中2020年秋季学期
高三九月联考化学参考答案
一、单选题
题号
1
2
3
4
5
6
7
8
9
10
答案
D
D
B
C
D
D
A
C
A
C
二、不定项选择题
题号
11
12
13
14
15
答案
C
C
B
CD
CD
三、非选择题
16.(12分)
(1)2ClO2+2CN-=2CO2+N2+2Cl-(2分)
(2)①稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸(2分)
② 2ClO3-+H2O2+2H+=2ClO2↑+O2↑+2H2O(2分)
③防止倒吸(或做安全瓶)(1分)
④加快(1分)
(3)①防止ClO2逸出,使ClO2全部反应,准确测定ClO2的质量(2分)
②1.35×10-2cV (2分)
17.(14分)
(1)球形冷凝管(1分)a (1分)
(2)C(2分)
(3)水浴加热(2分)
(4)除去MnO2(2分)产生白色浑浊(2分)
(5)除去对氯苯甲酸中的杂质并尽量减小其损耗(2分,一点1分)
(6)90.5%(2分)
18.(11分)
(1)将铈氧化为四价,与其它稀土元素分离(2分)
(2)还原剂(1分)
(3)温度升高,双氧水发生分解,造成浸出率偏小(2分)
(4)向混合液中加入稀硫酸,使c(H+)增大,平衡向形成Ce3+水溶液方向移动(2分)
(5) 8 (2分)
(6) 4Ce(OH)3+O2+2H2O=4Ce(OH)4(2分)
19. (13分)
(1)乙炔(1分)加成反应(1分)
(2)(2分)
碳碳三键 溴原子(2分,各1分)
8
(3)(1分)保护苯环上的(酚)羟基不被氧化(1分)
(4)
(2分,各1分)
(5)(3分)
20. (10分)
(1)玻璃棒(1分)引流(1分)
(2)蒸馏烧瓶(1分)冷凝管(1分)分液漏斗(1分)
(3)2Mn2++5NaBiO3+14H+=2MnO4-+5Na++5Bi3++7H2O (2分)
(4)<(1分)ClO->HCO3-(2分)
8
相关文档
- 安徽省全国示范高中名校2020届高三2021-07-0621页
- 湖北省宜昌市部分示范高中教学协作2021-07-0219页
- 湖北省龙泉中学2021届高三上学期82021-07-0210页
- 湖北省龙泉中学、荆州中学、宜昌一2021-06-244页
- 2021百师联盟高三9月联考(全国卷)2021-06-2410页
- 2019-2020学年湖北省龙泉中学、巴2021-06-199页
- 湖北省龙泉中学2021届高三上学期82021-06-154页
- 决胜新高考·名校交流2021届高三92021-06-095页
- 河北省衡水中学2021届高三9月联考(2021-06-0913页
- 【语文】湖北省龙泉中学、潜江中学2021-06-0915页