- 946.50 KB
- 2021-07-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
2019届高三模拟考试试卷
化学
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分120分,考试时间100分钟。
可能用到的相对原子质量:H—1 C—12 O—16 P—31 S—32 K—39 Mn—55 Fe—56
第Ⅰ卷(选择题 共40分)
单项选择题:本题包括10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1.2018年世界环境日主题为“塑战速决”。下列做法不应该提倡的是( )
A. 使用布袋替代一次性塑料袋购物 B. 焚烧废旧塑料以防止“白色污染”
C. 用CO2合成聚碳酸酯可降解塑料 D. 用高炉喷吹技术综合利用废塑料
【答案】B
【解析】
【详解】A、用布袋代替一次性塑料袋购,减少了塑料袋的使用能减少白色污染,减少化工生产产生的温室气体,选项A应提倡;
B.焚烧废旧塑料产生致癌性物质苯丙芘等,不能焚烧废旧塑料以防止“白色污染”,应使用塑料的替代品防止白色污染,如聚乳酸等,选项B不应提倡;
C.利用CO2合成聚碳酸酯类可降解塑料,实现“碳”的循环利用,减少二氧化碳的排放,选项C应提倡;
D、用高炉喷吹技术综合利用废塑料,减少白色污染,选项D应提倡;
答案选B。
2.用化学用语表示C2H2+HClC2H3Cl(氯乙烯)中的相关微粒,其中正确的是( )
A. 中子数为7的碳原子:C B. 氯乙烯的结构简式:CH2CHCl
C. 氯离子的结构示意图: D. HCl的电子式:H+[]-
【答案】C
【解析】
【详解】A. 中子数为7的碳原子为:,选项A错误;
B. 氯乙烯的结构简式为:CH2=CHCl,选项B错误;
- 26 -
C. 氯离子的结构示意图为:,选项C正确;
D. HCl为共价化合物,其电子式为:,选项D错误。
答案选C。
3.下列有关物质的性质与用途具有对应关系的是( )
A. Al2O3的熔点很高,可用作耐火材料
B. NH3具有还原性,可用作制冷剂
C. SO2具有氧化性,可用于纸浆的漂白
D. 钠钾合金的密度小,可用作快中子反应堆的热交换剂
【答案】A
【解析】
【详解】A、氧化铝熔点很高,所以可以做耐火材料,选项A正确;
B、氨气中的氮元素化合价是-3价,具有还原性,做制冷剂,是氨气易液化的原因,选项B错误;
C.二氧化硫可用于漂白纸浆是因为其具有漂白性,与二氧化硫的氧化性无关,选项C错误;
D.在快中子反应堆中,不能使用水来传递堆芯中的热量,因为它会减缓快中子的速度,钠和钾的合金可用于快中子反应堆作热交换剂,选项D错误;
答案选A。
4.常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 使pH试纸显蓝色的溶液中:Na+、Mg2+、ClO-、HSO3-
B. c(Fe3+)=0.1 mol·L-1的溶液中:K+、NH4+、SO42-、SCN-
C. =0.1 mol·L-1的溶液中:Na+、HCO3-、K+、NO3-
D. 0.1 mol·L-1的NaHCO3溶液中:NH4+、NO3-、Na+、SO42-
【答案】D
【解析】
【详解】A. 使pH试纸显蓝色的溶液呈碱性,HSO3-、Mg2+不能大量存在 ,且ClO-与HSO3-
- 26 -
因发生氧化还原反应而不能大量共存,选项A错误;
B. c(Fe3+)=0.1 mol·L-1的溶液中:Fe3+与SCN-发生络合反应而不能大量共存,选项B错误;
C. =0.1 mol·L-1的溶液中c(H+)=10-1mol/L,为强酸性溶液,HCO3-不能大量存在,选项C错误;
D. 0.1 mol·L-1的NaHCO3溶液中:NH4+、NO3-、Na+、SO42-、HCO3-相互之间不反应,能大量共存,选项D正确。
答案选D。
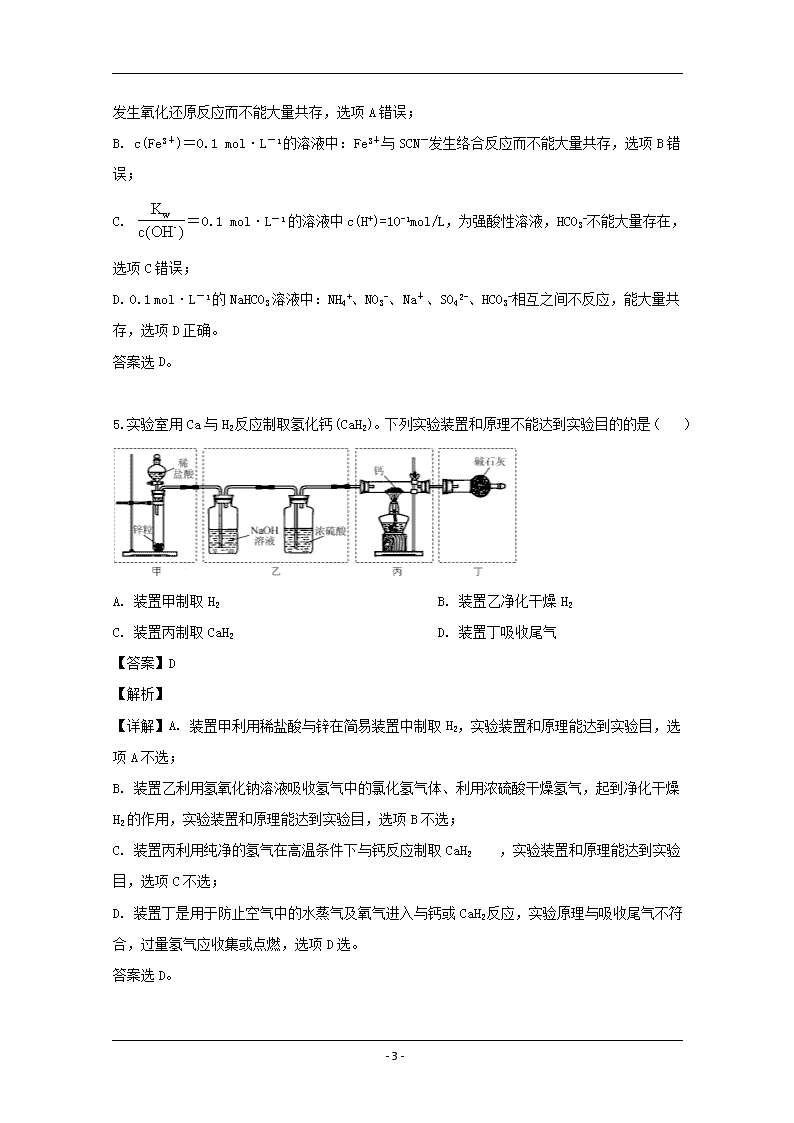
5.实验室用Ca与H2反应制取氢化钙(CaH2)。下列实验装置和原理不能达到实验目的的是( )
A. 装置甲制取H2 B. 装置乙净化干燥H2
C. 装置丙制取CaH2 D. 装置丁吸收尾气
【答案】D
【解析】
【详解】A. 装置甲利用稀盐酸与锌在简易装置中制取H2,实验装置和原理能达到实验目,选项A不选;
B. 装置乙利用氢氧化钠溶液吸收氢气中的氯化氢气体、利用浓硫酸干燥氢气,起到净化干燥H2的作用,实验装置和原理能达到实验目,选项B不选;
C. 装置丙利用纯净的氢气在高温条件下与钙反应制取CaH2 ,实验装置和原理能达到实验目,选项C不选;
D. 装置丁是用于防止空气中的水蒸气及氧气进入与钙或CaH2反应,实验原理与吸收尾气不符合,过量氢气应收集或点燃,选项D选。
答案选D。
- 26 -
6.下列指定反应的离子方程式正确的是( )
A. 用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2===I2+2OH-
B. 过量的铁粉溶于稀硝酸:Fe+4H++NO3-===Fe3++NO↑+2H2O
C. 用Na2S2O3溶液吸收水中的Cl2:4Cl2+S2O32-+5H2O===10H++2SO42-+8Cl-
D. 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O===2Al(OH)3↓+CO32-
【答案】C
【解析】
【详解】A. 用过氧化氢从酸化的海带灰浸出液中提取碘,反应的离子方程式为:2I-+H2O2+2H+=I2+2H2O,选项A错误;
B. 过量的铁粉溶于稀硝酸,反应的离子方程式为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,选项B错误;
C. 用Na2S2O3溶液吸收水中的Cl2,反应的离子方程式为:4Cl2+S2O32-+5H2O=10H++2SO42-+8Cl-,选项C正确;
D. 向NaAlO2溶液中通入过量CO2,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,选项D错误。
答案选C。
7.以太阳能为热源分解Fe3O4,经热化学铁氧化合物循环分解水制H2的过程如图所示。下列叙述不正确的是( )
A. 过程Ⅰ中的能量转化形式是太阳能→化学能
B. 过程Ⅰ中每消耗116 g Fe3O4转移2 mol电子
C. 过程Ⅱ的化学方程式为3FeO+H2OFe3O4+H2↑
D. 铁氧化合物循环制H2具有节约能源、产物易分离等优点
【答案】B
【解析】
【详解】A.
- 26 -
过程Ⅰ利用太阳能将四氧化三铁转化为氧气和氧化亚铁,实现的能量转化形式是太阳能→化学能,选项A正确;
B. 过程Ⅰ中四氧化三铁转化为氧气和氧化亚铁,每消耗116 g Fe3O4,即0.5mol,Fe由+3价变为+2价,转移 mol电子,选项B错误;
C. 过程Ⅱ实现了氧化亚铁与水反应生成四氧化三铁和氢气的转化,反应的化学方程式为3FeO+H2OFe3O4+H2↑,选项C正确;
D. 根据流程信息可知,铁氧化合物循环制H2具有节约能源、产物易分离等优点,选项D正确。
答案选B。
8.短周期主族元素W、X、Y、Z的原子序数依次增大,W的最外层电子数为内层电子数的3倍,X在短周期主族元素中金属性最强,W与Y属于同一主族。下列叙述正确的是( )
A. 原子半径:r(Z)>r(X)>r(W)
B. W的简单气态氢化物的热稳定性比Y的弱
C. 由W与X形成一种化合物可作供氧剂
D. Y的最高价氧化物对应的水化物的酸性比Z的强
【答案】C
【解析】
【分析】
短周期主族元素W、X、Y、Z的原子序数依次增大,W的最外层电子数为内层电子数的3倍,则W为氧元素,X在短周期主族元素中金属性最强,则X为钠元素,W与Y属于同一主族,则Y为硫元素,Z为短周期元素中原子序数比Y大,则Z为氯元素,据此分析。
【详解】短周期主族元素W、X、Y、Z的原子序数依次增大,W的最外层电子数为内层电子数的3倍,则W为氧元素,X在短周期主族元素中金属性最强,则X为钠元素,W与Y属于同一主族,则Y为硫元素,Z为短周期元素中原子序数比Y大,则Z为氯元素。
A.同主族从上而下原子半径依次增大,同周期从左而右原子半径依次减小,故原子半径:r(X)>r(Z)> r(W),选项A错误;
B. 非金属性越强简单气态氢化物的稳定性越强,则W的简单气态氢化物H2O的热稳定性比Y的简单气态氢化物H2S强,选项B错误;
C. 由W与X形成一种化合物Na2O2可作供氧剂,选项C正确;
D. 非金属性越强最高价氧化物的水化物的酸性越强,则H2SO4的酸性比HClO4
- 26 -
的弱,选项D错误;
答案选C。
9.在给定条件下,下列选项所示的物质间转化均能一步实现的是( )
A. SSO3H2SO4
B. NH3NO2HNO3
C. Cu2(OH)2CO3CuCl2(aq)Cu(s)
D. 饱和NaCl溶液NaHCO3(s)Na2CO3(s)
【答案】D
【解析】
【分析】
A、硫燃烧一步只能生成二氧化硫;
B、氨气一步反应只能得到一氧化氮;
C、钠非常活泼,与氯化铜溶液反应生成氢氧化铜、氯化钠和氢气,不能置换出铜;
D、饱和氯化钠溶液中先通入足量氨气,再通入足量二氧化碳反应生成碳酸氢钠,碳酸氢钠固体受热分解生成碳酸钠。
【详解】A、硫燃烧一步只能生成二氧化硫,不能生成三氧化硫,则转化关系不可以实现,选项A错误;
B、氨气一步反应只能得到一氧化氮,不能得到二氧化氮,则转化关系不可以实现,选项B错误;
C、钠非常活泼,与氯化铜溶液反应生成氢氧化铜、氯化钠和氢气,不能置换出铜,则转化关系不可以实现,选项C错误;
D、饱和氯化钠溶液中先通入足量氨气,再通入足量二氧化碳反应生成碳酸氢钠晶体、氯化铵,过滤得到碳酸氢钠晶体,碳酸氢钠固体受热分解生成碳酸钠,转化关系可以实现,选项D正确。
答案选D。
【点睛】本题考查金属元素单质及其化合物的综合应用,题目难度中等,注意把握物质的性质以及转化的特点、反应条件,C项为易错点,注意Na和盐溶液反应的特点。
- 26 -
10.下列叙述正确的是( )
A. 合成氨反应放热,采用低温可以提高氨的生成速率
B. 常温下,将pH=4的醋酸溶液加水稀释,溶液中所有离子的浓度均降低
C. 反应4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s)常温下能自发进行,该反应的ΔH<0
D. 在一容积可变的密闭容器中反应2SO2(g)+O2(g)2SO3(g)达平衡后,保持温度不变,缩小体积,平衡正向移动,的值增大
【答案】C
【解析】
【详解】A、降低温度,会减慢氨的生成速率,选项A错误;
B、常温下,将pH=4的醋酸溶液稀释后,溶液中氢离子的浓度降低,由c(OH-)=可知氢氧根离子的浓度增大,选项B错误;
C、反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s),△S<0,常温下能自发进行,说明△H-T•△S<0,因此可知△H<0,选项C正确;
D、可看作该反应的平衡常数的倒数,温度不变,平衡常数不变,则该值不变,选项D错误。
答案选C。
不定项选择题:本题包括5小题,每小题4分,共20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就得0分。
11.Y是合成药物查尔酮类抑制剂的中间体,可由X在一定条件下反应制得:
下列叙述正确的是( )
A. 反应过程中加入K2CO3,能提高X的转化率
- 26 -
B. Y与Br2的加成产物分子中不含手性碳原子
C. X和Y均能与新制的Cu(OH)2在加热条件下反应生成砖红色沉淀
D. 等物质的量的X、Y分别与H2反应,最多消耗H2的物质的量之比为3∶4
【答案】AC
【解析】
【分析】
X与发生取代反应生成Y和HBr,X中含有酚羟基和醛基,Y中含有醛基、碳碳双键和醚键,据此分析解答。
【详解】A、X与发生取代反应生成Y和HBr,反应过程中加入K2CO3,消耗HBr,使反应正向移动,能提高X的转化率,选项A正确;
B、Y与Br2的加成产物分子中含有两个手性碳原子,如图:(标*为手性碳原子),选项B错误;
C、X和Y均含有醛基,能与新制的Cu(OH)2在加热条件下反应生成砖红色沉淀,选项C正确;
D、等物质的量的X、Y分别与H2反应,最多消耗H2的物质的量之比为4∶5,选项D错误。
答案选AC。
12.根据下列图示所得出的结论正确的是( )
A. 图甲表示pH相同的NaOH溶液与氨水稀释过程pH的变化,曲线a对应氨水
B. 图乙表示某放热反应分别在有、无催化剂的情况下,反应过程中的能量变化
C. 图丙表示CO(g)+Cl2(g)COCl2(g)的反应速率随时间的变化,在t1时改变的条件是加入催化剂
D. 图丁表示用0.0100mol·L-1的硝酸银标准溶液滴定浓度均为0.1000mol·L-1 Cl-、Br-及I-的混合溶液时,先沉淀的是Cl-
【答案】AC
- 26 -
【解析】
【详解】A.pH相同的氢氧化钠溶液和氨水,稀释时一水合氨继续电离,则稀释时NaOH的pH变化大,所以a表示氨水稀释时pH的变化曲线,选项A正确;
B、反应物的总能量高于生成物的总能量为放热反应,图中反应物的总能量小于生成物的总能量,不相符,选项B错误;
C、催化剂同等程度改变正逆反应速率,在t1时改变的条件是加入催化剂,正逆反应速率均增大且相等,平衡不移动,与图中信息相符,选项C正确;
D.由图可知,c(I-)最小,先形成沉淀的是I-,选项D错误;
答案选AC。
13.根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀
X具有强氧化性
B
将稀盐酸滴入硅酸钠溶液中,充分振荡,有白色沉淀产生
非金属性:Cl>Si
C
常温下,分别测定浓度均为0.1 mol·L-1 NaF和NaClO溶液的pH,后者的pH大
酸性:HFc(HC2O4-)>c(H2C2O4)>c(C2O42-)
C. 20 mL 0.10 mol·L-1 CH3COONa溶液与10 mL 0.10 mol·L-1 HCl溶液混合得到的酸性溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
D. 向0.1mol·L-1 NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
【答案】C
【解析】
【详解】A、碳酸氢钠溶液中存在电荷守恒和物料守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),所以得c(OH-)=c(H+)+c(H2CO3)-c(CO32-),选项A错误;
B.0.1 mol•L-1NaHC2O4溶液呈酸性,说明HC2O4-的电离程度大于其水解程度,则c(C2O42-)>c(H2C2O4),正确的浓度大小为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),选项B错误;
C、20 mL 0.10 mol·L-1 CH3COONa溶液与10 mL 0.10 mol·L-1 HCl溶液混合得到CH3COONa与CH3COOH物质的量之比为1:1的混合物,CH3COOH电离程度大于CH3COO-的水解程度,由电荷守恒可知:n(CH3COO-)+n(OH-)=n(Na+)+n(H+);根据物料守恒知n(CH3COO-)+n(CH3COOH)=2×10-3 mol,n(Na+)=10-3mol,n(CH3COO-)+n(OH-)=[n(CH3COO-)+n(CH3COOH)]+n(H+),所以c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),选项C正确;
D.0.1 mol/LNH4HSO4溶液中滴加NaOH至溶液恰好呈中性,则NH4+水解会减少,SO42-
- 26 -
无变化,所以离子浓度关系是:c(Na+) >c(SO42-)>c(NH4+)>c(OH-) =c(H+),选项D错误。
答案选C。
【点睛】本题考查了离子浓度大小比较、酸碱混合的定性判断,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法。
15.一定温度下,在三个容积均为1 L恒容密闭容器中按不同方式投入反应物,发生反应CO(g)+2H2(g)CH3OH(g)(正反应放热),测得反应的相关数据如下:
容器
容器1
容器2
容器3
反应温度T/K
500
500
600
反应物投入量
1 mol CO、
2 mol H2
2 mol CH3OH
1 mol CO、
2 mol H2
平衡v正(H2)/(mol·L-1·s-1)
v1
v2
v3
平衡c(CH3OH)/(mol·L-1)
c1
c2
c3
平衡体系总压强p/Pa
p1
p2
p3
物质的转化率α
α1(CO)
α2(CH3OH)
α3(CO)
平衡常数K
K1
K2
K3
下列叙述正确的是( )
A. v1c2 B. α1(CO)>α3(CO),v12p3,K12c3,α2(CH3OH)+α3(CO)<1
【答案】BD
【解析】
分析】
采用比较的方法分析,对照容器的特点,将容器1和容器2对比,将容器1和容器3对比。
- 26 -
【详解】采用比较的方法分析,对照容器的特点,将容器1和容器2对比,将容器1和容器3对比。容器2中加入2 mol CH3OH等效于在相同条件下反应物投入量为1 mol CO、2 mol H2,容器2中起始反应物物质的量为容器1的2倍,容器2相当于在容器1达到平衡后增大压强,将容器的体积缩小到原来的一半,增大压强反应速率加快,则v10.05mg,所以不合格。
【解析】
【分析】
(1) 根据PH3是气体,滞留在装置中会影响粮食中残留磷化物含量的测定分析;
(2) 结合空气中氧气的氧化性和PH3的还原性分析;
(3) 利用题目已知信息,及KMnO4在酸性环境中常见的还原产物,利用电荷守恒、电子守恒及原子守恒书写反应的离子方程式;
(4)根据氧化还原反应中电子守恒计算出PH3的质量,利用产品合格分析判断即可。
【详解】(1)装置A中的KMnO4溶液具有强氧化性,其作用是吸收空气中的还原性气体,防止其干扰pH3的测定;
- 26 -
(2)装置B中盛装焦性没食子酸的碱性溶液吸收空气中的O2。若去掉该装置,空气中的氧气就会氧化PH3气体,则测得的磷化物的残留量偏低;
(3)在装置E中PH3被酸性KMnO4溶液氧化成磷酸,KMnO4 被还原为MnSO4, 同时产生水,根据电荷守恒、电子守恒及原子守恒,可得该反应的离子方程式为5PH3+8MnO4-+24H+=5H3PO4+8Mn2++12H2O;
(4)25mL溶液中未反应的n(KMnO4)=×4×10-5mol·L-1×0.020L=3.2×10-7mol,250mL溶液中未反应的n(KMnO4)=3.2×10-6mol,与PH3反应的n(KMnO4)=0.02L×2.50×10-4 mol·L-1-3.2×10-6 mol=1.8×10-6 mol,n(PH3)=n(KMnO4)=×1.8×10-6 mol=1.125×10-6mol,100g原粮中m(PH3)=1.125×10-6 mol×34g·mol-1=3.825×10-5 g,1kg原粮中磷化氢质量=3.825×10-4 g=0.382 5 mg>0.05mg,所以不合格。
【点睛】本题以粮食中残留磷化氢的含量测定为线索,考查元素化合物、氧化还原反应滴定及有关计算、误差分析等。滴定操作中物质稀释倍数的换算是本题解答的易错点。
19.连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种漂白剂、脱氧剂和防腐剂。某研究小组对Na2S2O4的性质与制备进行了如下探究。
(1)测定0.05mol·L-1 Na2S2O4溶液在空气中pH的变化如图所示。
①写出0~t1段发生反应的化学方程式:_____。
②t2~t3段溶液的pH变小的原因是______。
(2)已知:S2O32-+2H+===SO2↑+S↓+H2O。Na2S2O4固体在隔绝空气的条件下加热至75℃以上完全分解得到Na2SO3、Na2S2O3和SO2,检验产物中是否含有Na2SO4,实验方法是__________。
(3)由工业废气制备Na2S2O4的实验原理如下:
①向装置Ⅱ中加入Ce4+的目的是________。
- 26 -
②写出装置Ⅲ中发生反应的离子方程式:________。
(4)由锌粉法制备Na2S2O4的实验装置如图所示。主要步骤如下:
步骤1:将SO2通入锌粉的水悬浮液中,于35~45℃下反应生成连二亚硫酸锌。
步骤2:加入过量烧碱溶液,于28~35 ℃下反应生成Na2S2O4和氢氧化锌悬浮溶液。
由上述实验进一步提纯得到Na2S2O4(s)的实验方案是取一定量的Na2S2O4和氢氧化锌悬浮溶液,______(实验中须使用的试剂有:氯化钠、乙醇;除常规仪器外须使用的仪器有:真空干燥箱)。
【答案】 (1). 2Na2S2O4+O2+2H2O===4NaHSO3 (2). NaHSO3被氧化为NaHSO4使溶液酸性增强 (3). 取少量固体溶于足量稀盐酸,向上层清液中滴加BaCl2溶液,若有白色沉淀,则产物中含Na2SO4 (4). 将NO氧化为NO2-和NO3- (5). 2SO32-+2Ce2++2H2OS2O42-+2Ce4++4OH- (6). 过滤,向滤液中加入一定量的氯化钠进行盐析,过滤,用乙醇洗涤固体,置于真空干燥箱中干燥
【解析】
【详解】(1)①Na2S2O4溶液在空气中易被氧化生成亚硫酸氢钠,则0~t1段发生反应的化学方程式为:2Na2S2O4+O2+2H2O=4NaHSO3;
②t2~t3段溶液的pH变小的原因是NaHSO3被氧化为NaHSO4使溶液酸性增强;
(2)检验产物中是否含有Na2SO4,实验方法是取少量固体溶于足量稀盐酸,向上层清液中滴加BaCl2溶液,若有白色沉淀,则产物中含Na2SO4;
(3)由工业废气制备Na2S2O4的流程图可知:
①向装置Ⅱ中加入Ce4+,将NO氧化为NO2-和NO3-;
②装置Ⅲ中电解条件下亚硫酸根离子与Ce2+发生反应生成Ce4+和过硫酸根离子,发生反应的离子方程式为:2SO32-+2Ce2++2H2OS2O42-+2Ce4++4OH-;
(4)由上述实验进一步提纯得到Na2S2O4(s)的实验方案是取一定量的Na2S2O4和氢氧化锌悬浮溶液,过滤,向滤液中加入一定量的氯化钠进行盐析,过滤,用乙醇洗涤固体,置于真空干燥箱中干燥。
- 26 -
20.铝的利用成为人们研究的热点,是新型电池研发中重要的材料。
(1)通过以下反应制备金属铝。
反应1:Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反应2:Al2O3(s)+3C(s)===2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反应3:3AlCl(g)===2Al(l)+AlCl3(g);ΔH3
①反应3的ΔH3=_______kJ·mol-1。
②950℃时,铝土矿与足量的焦炭和Cl2反应可制得AlCl3。该反应的化学方程式是_______。
(2)在高温条件下进行反应:2Al(l)+AlCl3(g)3AlCl(g)。
①向图1所示的等容积A、B密闭容器中加入足量的Al粉,再分别充入1 mol AlCl3(g),在相同的高温下进行反应。图2表示A容器内的AlCl3(g)体积分数随时间的变化图,在图2中画出B容器内AlCl3(g)体积分数随时间的变化曲线。__________
②1100℃时,向2 L密闭容器中通入3 mol AlCl(g),发生反应:3AlCl(g)=2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,则该反应的平衡常数K=________。
③加入3molAlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。此反应选择温度为900℃的原因是_______________。
(3)用铝制作的快速放电铝离子二次电池的原理如图4所示。
①该电池充电时,阴极的电极反应式为_____。
②AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,其他离子不参与电极反应。NaCl的作用是_____。
- 26 -
【答案】 (1). b-a (2). Al2O3+3C+3Cl22AlCl3+3CO (3). (4). (5). 900℃时,产率已经较高,升高温度产率增幅不大,但能耗升高,经济效益降低 (6). 4Al2Cl7-+3e-===Al+7AlCl4- (7). 生成AlCl4-和Al2Cl7-增强导电性
【解析】
【详解】(1)①已知反应①:Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g);ΔH1=akJ·mol-1
反应②:Al2O3(s)+3C(s)=2Al(l)+3CO(g);ΔH2=bkJ·mol-1
反应③:3AlCl(g)=2Al(l)+AlCl3(g);ΔH3
根据盖斯定律,由②-①得反应③3AlCl(g)=2Al(l)+AlCl3(g) ΔH3=ΔH2-ΔH1= bkJ·mol-1- akJ·mol-1= (b-a) kJ·mol-1;
②950℃时,铝土矿与足量的焦炭和Cl2反应可制得AlCl3,同时高温条件下生成一氧化碳,反应的化学方程式是Al2O3+3C+3Cl22AlCl3+3CO;
(2)①向图1所示的等容积A、B密闭容器中加入足量的Al粉,再分别充入1 mol AlCl3(g),在相同的高温下进行反应。图2表示A容器内的AlCl3(g)体积分数随时间的变化图,B容器内体积可变,正反应为气体体积增大的反应,随着反应的进行气体总量增大,相对于容器A则容器B压强减小,反应速率减慢且平衡向气体体积增大的正反应方向移动,平衡时AlCl3(g)的体积分数减小,在图2中画出B容器内AlCl3(g)体积分数随时间的变化曲线如下:;
②1100℃时,向2 L密闭容器中通入3 mol AlCl(g),发生反应:3AlCl(g)=2Al(l)+AlCl3(g)。已知该温度下AlCl(g)的平衡转化率为80%,根据三段式有:
3AlCl(g)=2Al(l)+AlCl3(g)。
开始时浓度(mol/L)1.5 0
改变的浓度(mol/L)1.2 0.4
平衡时浓度(mol/L)0.3 0.4
- 26 -
则该反应的平衡常数K=;
③加入3molAlCl(g),在不同压强下发生反应,温度对产率的影响如图3所示。反应选择温度为900℃的原因是900℃时,产率已经较高,升高温度产率增幅不大,但能耗升高,经济效益降低;
(3)①电池充电时,阴极上Al2Cl7-得电子产生铝和AlCl4-,电极反应式为4Al2Cl7-+3e-===Al+7AlCl4-;
②AlCl3和NaCl的熔融盐常用于镀铝电解池,电镀时AlCl4-和Al2Cl7-两种离子在电极上相互转化,NaCl的作用是生成AlCl4-和Al2Cl7-增强导电性,其他离子不参与电极反应。
21.锰元素的化合物在多个领域中均有重要应用。
(1)Mn2+基态核外电子排布式为________,SO42-中S原子轨道的杂化类型为________。
(2)二价锰的3种离子化合物的熔点如下表:
物质
MnCl2
MnS
MnO
熔点
650℃
1610℃
2800℃
上表3种物质中晶格能最大的是________。
(3)某锰氧化物的晶胞结构如图所示,该氧化物的化学式为________。
(4)在化合物K3[Mn(CN)6]中,微粒之间存在的作用力有________(填字母)。
a. 离子键 b. 共价键 c. 配位键 d. 氢键
(5)制备LiMn2O4的实验过程如下:将MnO2和Li2CO3按4∶1的物质的量之比配料,球磨3~5 h,然后升温,高温加热,保温24 h,冷却至室温。写出该反应的化学方程式:____________。
【答案】 (1). 1s22s22p63s23p63d5 (2). sp3 (3). MnO (4). MnO2 (5). abc (6). 8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑
- 26 -
【解析】
【详解】(1)Mn是25号元素,核外电子排布式为1s22s22p63s23p63d54s2,Mn2+基态的电子排布式为1s22s22p63s23p63d5;
SO42-中S原子的价层电子数=4+(6+2-3×2)=4,所以采取sp3杂化方式;
(2)三种物质都是离子晶体,离子半径越小,离子键就越强,离子晶体的晶格能就越大,物质的熔点就越高,根据表格数据可知上表三种物质中晶格能最大的是MnO;
(3)在该晶体中含有的Mn原子个数为8×+1=2,含有的O原子数目为:4×+2=4,Mn:O=2:4=1:2,所以该锰的氧化物的化学式为MnO2;
(4)K3[Fe(CN)6]是配位化合物,也是离子化合物,则该化合物中一定存在配位键、离子键,C、N之间存在极性共价键,所以存在的作用力有abc;
(5)MnO2和Li2CO3反应后只有Mn的价态降低,必然有元素的化合价升高,C元素处在最高价态,不能升高,则只能是O元素价态升高,所以还有O2生成.该反应的方程式为:8MnO2+2Li2CO34LiMn2O4+2CO2↑+O2↑。
22.B. [实验化学]
乙酰苯胺具有退热镇痛作用,是较早使用的解热镇痛药,有“退热冰”之称。其制备原理如下:
已知:
①苯胺易被氧化;
②乙酰苯胺、苯胺和醋酸的部分物理性质如下表:
物质
熔点
沸点
溶解度(20 ℃)
乙酰苯胺
114.3℃
305℃
0.46
苯胺
-6℃
184.4℃
3.4
醋酸
16.6℃
118℃
易溶
- 26 -
实验步骤如下:
步骤1:在50 mL圆底烧瓶中,加入5 mL苯胺、7.5 mL冰醋酸及少许锌粉,依照如图装置组装仪器。
步骤2:控制温度计示数约105 ℃,小火加热回流1 h。
步骤3:趁热将反应混合物倒入盛有100 mL冷水的烧杯中,冷却后抽滤,洗涤,得到粗产品。
(1)步骤1中加入锌粉的作用是________。
(2)步骤2中控制温度计示数约105℃的原因是________。
(3)步骤3中趁热将混合物倒入盛有冷水的烧杯中,“趁热”的原因是__________________。抽滤装置所包含的仪器除减压系统外,还有________、________(填仪器名称)。
(4)步骤3得到的粗产品需进一步提纯,该提纯方法是________。
【答案】(12分)
(1)防止苯胺被氧化,同时起着沸石的作用(2分)
(2)温度过高,未反应的乙酸蒸出,降低反应物的利用率(2分);温度过低,又不能除去反应生成的水(2分)
(3)若让反应混合物冷却,则固体析出沾在瓶壁上不易处理(2分)
吸滤瓶(1分) 布氏漏斗(1分)
(4)重结晶(2分)
【解析】
试题分析:(1)锌粉起抗氧化剂作用,防苯胺氧化,另外混合液加热,加固体还起到防爆沸作用。
(2)乙酸有挥发性,不易温度太高,另外考虑到水的沸点为100℃,太低不易水份蒸发除去。
(3)“趁热”很明显是防冷却,而一旦冷却就会有固体析出。
- 26 -
(4)混合溶液中固体溶质得到的方法是重结晶。如果使用冷却结晶应该也可以。
考点:实验的基本操作,仪器的使用及混合物的分离提纯。实验的评价与分析
- 26 -
- 26 -
相关文档
- 北京市昌平区昌平区第一中学2020届2021-07-0620页
- 黑龙江省哈师大附中2020届高三下学2021-07-0114页
- 数学理卷·2017届四川省仁寿一中高2021-07-0111页
- 湖南省湘潭市2020届高三下学期第三2021-07-0122页
- 【数学】宁夏银川唐徕回民中学20202021-07-0117页
- 数学文卷·2018届湖南省永州市高三2021-06-309页
- 湖南省永州市2018届高三下学期第三2021-06-3010页
- 【数学】宁夏银川唐徕回民中学20202021-06-3018页
- 【数学】江苏省苏锡常镇四市2020届2021-06-2518页
- 江苏省苏锡常镇四市2020届高三第二2021-06-2417页