- 580.50 KB
- 2021-07-07 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1讲 原子结构与性质
【2020·备考】
最新考纲:1.了解原子核外电子的运动状态、能级分布和排布原理,能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表示式。2.了解电离能的含义,并能用以说明元素的某些性质。3.了解电子在原子轨道之间的跃迁及其简单应用。4.了解电负性的概念,并能用以说明元素的某些性质。
核心素养:1.宏观辨识与微观探析:能从能层、能级等不同层次认识原子的结构,以及核外电子的排布规律,能从宏观和微观相结合的视角分析原子结构与元素性质的关系。2.科学探究与创新意识:能发现和提出有探究价值的原子结构及性质的问题,如核外电子排布、元素第一电离能的特殊性等,面对异常现象敢于提出自己的见解。
考点一 原子核外电子排布原理
(频数:★★★ 难度:★☆☆)
名师课堂导语 本考点主要考查核外电子排布规律,特别是基态原子的核外电子排布式是考查重点,复习时加以关注。
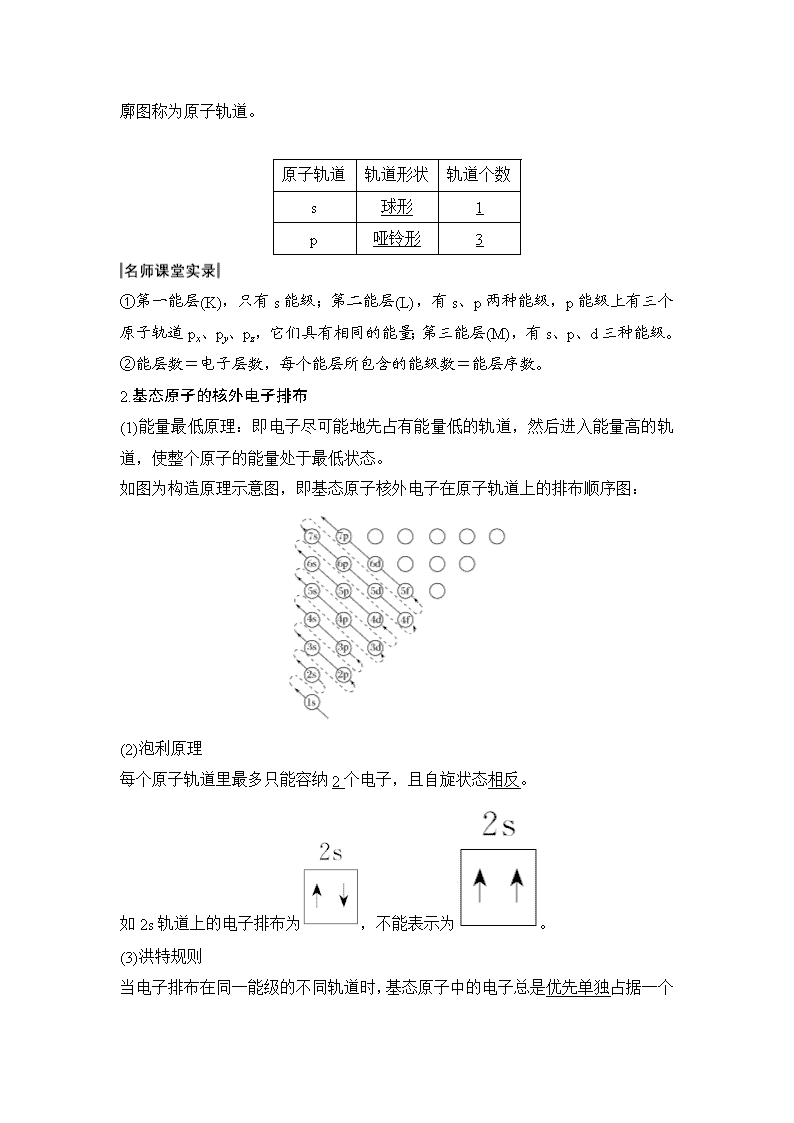
1.能层、能级与原子轨道
(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。通常用K、L、M、N……表示,能量依次升高。
(2)能级:同一能层里电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序依次升高,即:E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:电子云轮廓图给出了电子在核外经常出现
的区域。这种电子云轮廓图称为原子轨道。
原子轨道
轨道形状
轨道个数
s
球形
1
p
哑铃形
3
①第一能层(K),只有s能级;第二能层(L),有s、p两种能级,p能级上有三个原子轨道px、py、pz,它们具有相同的能量;第三能层(M),有s、p、d三种能级。
②能层数=电子层数,每个能层所包含的能级数=能层序数。
2.基态原子的核外电子排布
(1)能量最低原理:即电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态。
如图为构造原理示意图,即基态原子核外电子在原子轨道上的排布顺序图:
(2)泡利原理
每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
如2s轨道上的电子排布为,不能表示为。
(3)洪特规则
当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独
占据一个轨道,且自旋状态相同。如2p3的电子排布为,不能表示为或。
①洪特规则特例:当能量相同的原子轨道在全满(p6、d10、f14)、半满(p3、d5、f7)和全空(p0、d0、f0)状态时,体系的能量最低,如:24Cr的电子排布式为1s22s22p63s23p63d54s1。
②在书写简化的电子排布式时,并不是所有的都是[X]+价电子排布式(注:X代表上一周期稀有气体元素符号)。
基态原子:处于最低能量的原子。当基态原子吸收能量后,电子会跃迁到较高能级,变成激发态原子。电子从激发态跃迁回基态时,释放一定频率的光子,这是产生原子光谱的原因。
[速查速测]
1.(易混点排查)正确的打“√”,错误的打“×”
(1)p能级能量一定比s能级的能量高(×)
(2)基态钠原子的电子排布式为1s22s22p62d1(×)
(3)基态磷原子的电子排布图为(×)
(4)同一原子中,2p、3p、4p能级的轨道数依次增多(×)
(5)Cr的电子排布式为1s22s22p63s23p63d44s2(×)
2.(教材改编题)(RJ选修3·P124改编)下列各原子或离子的电子排布式错误的是( )
A.K+ 1s22s22p63s23p6
B.F 1s22s22p5
C.S2- 1s22s22p63s23p4
D.Ar 1s22s22p63s23p6
答案 C
3.(思维探究题)请用核外电子排布的相关规则解释Fe3+较Fe2+更稳定的原因。
答案 26Fe的价电子排布式为3d64s2,Fe3+的价电子排布式为3d5,Fe2+的价电子排布式为3d6。根据“能量相同的轨道处于全空、全满和半满时能量最低”的原则,3d5处于半满状态,结构更稳定,所以Fe3+较Fe2+更稳定。
[A组 基础知识巩固]
1.(2018·北京东城区检测)下列说法中正确的是( )
A.1s22s12p1表示的是激发态原子的电子排布
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能级的轨道数依次增多
解析 A项,根据能量最低原理,1s22s12p1中2s能级未排满电子,但2p能级排布1个电子,故为激发态原子,其基态原子的电子排布式应为1s22s2,正确;B项,3p2表示3p能级上填充了2个电子,错误;C项,同一原子中,电子层数越多,离核越远,能量也就越高,故1s、2s、3s电子的能量逐渐增大,错误;D项,同一原子中,2p、3p、4p的轨道数是相等的,都含有3个原子轨道,错误。
答案 A
2.下列各组表述中,两个原子不属于同种元素原子的是( )
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数的原子和最外层电子排布式为4s24p5的原子
解析
A项,3p能级有一个空轨道的基态原子,按洪特规则可得其3p轨道上只能有两个电子,所以两个原子是同种元素的原子;B项,2p能级无空轨道,且有一个未成对电子的基态原子,它的2p能级上只能是5个电子,所以两原子是同种元素的原子;C项,M层全充满而N层为4s2的原子,其M层应为18个电子,而后者的M层上只有8个电子,所以两原子不是同种元素的原子;D项,最外层电子数是核外电子总数的的原子中,最外层电子数要小于或等于8个电子,且电子总数为5的倍数,所以可得该原子可能是原子序数为5、10、15、20、25、30、35、40,其中满足最外层电子数是核外电子总数的且符合核外电子排布规则的只能是35号元素,该元素原子的外围电子排布式为4s24p5,所以两原子是同种元素的原子。
答案 C
3.A、B、C、D、E、F代表6种元素。请填空:
(1)A元素基态原子的最外层有2个未成对电子,次外层有2个电子,其元素符号为____________;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为________,C的元素符号为________;
(3)D元素的正三价离子的3d能级为半充满,D的元素符号为________,其基态原子的电子排布式为_________________________________________________;
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为________,其基态原子的电子排布式为_____________________________________________________________________。
(5)F元素的原子最外层电子排布式为nsnnpn+1,则n=________;原子中能量最高的是________电子。
解析 (1)A元素基态原子次外层有2个电子,故次外层为K层,A元素有2个电子层,由题意可写出其电子排布图为:,则该元素核外有6个电子,为碳元素,其元素符号为C,另外氧原子同样也符合要求,其电子排布图为:。
(2)B-、C+的电子层结构都与Ar相同,即核外都有18个电子,则B为17号元素Cl,C为19号元素K。
(3)D元素原子失去2个4s电子和1个3d电子后变成+3价离子,其原子的核外电子排布式为1s22s22p63s23p63d64s2即为26号元素铁。
(4)根据题意要求,首先写出电子排布式:
1s22s22p63s23p63d104s1,该元素为29号元素Cu。
(5)s能级只有1个原子轨道,故最多只能容纳2个电子,即n=2,所以元素F的原子的最外层电子排布式为2s22p3,由此可知F是N元素;根据核外电子排布的能量最低原理,可知氮原子的核外电子中的2p能级能量最高。
答案 (1)C或O (2)Cl K
(3)Fe 1s22s22p63s23p63d64s2或[Ar]3d64s2
(4)Cu 1s22s22p63s23p63d104s1或[Ar]3d104s1
(5)2 2p
【归纳总结】
1.核外电子排布的三大表示方法
核外电子排布式
表示每个能级上排布的电子数
S:1s22s22p63s23p4或[Ne]3s23p4
S2-:1s22s22p63s23p6
电子排布图(轨道表示式)
表示每个原子轨道中电子的运动状态
价电子排布式或排布图
表示价电子的排布
2.“两原理,一规则”的正确理解
(1)原子核外电子排布符合能量最低原理、洪特规则、泡利原理,若违背其一,则电子能量不处于最低状态。
(2)半充满、全充满状态的原子结构稳定。
(3)当出现d轨道时,虽然电子按ns、(n-1)d、np的顺序填充,但在书写时,仍把(n-1)d放在ns前。
[B组 考试能力过关]
4.按要求完成以下试题
(1)(2018·课标全国Ⅰ)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)。
答案 D C
(2)(2018·课标全国Ⅱ)基态Fe原子价层电子的电子排布图(轨道表达式)为________________________________,基态S原子电子占据最高能级的电子云轮廓图为________形。
答案 哑铃(纺锤)
(3)(2018·课标全国Ⅲ)Zn原子核外电子排布式为_____________________________________________________________________。
答案 [Ar]3d104s2
(4)(2017·全国卷Ⅰ)①元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为________nm(填标号)。
A.404.4 B.553.5
C.589.2 D.670.8
E.766.5
②基态K原子中,核外电子占据最高能层的符号是________,占据该能层电子的电子云轮廓图形状是________。
答案 ①A ②N 球形
(5)(2017·全国卷Ⅱ)氮原子价层电子的轨道表达式(电子排布图)为_____________________________________________________________________。
答案
(6)(2017·全国卷Ⅲ)Co基态原子核外电子排布式为________。元素Mn与O中,基态原子核外未成对电子数较多的是________。
答案 [Ar]3d74s2 Mn
(7)(2017·江苏卷)Fe3+基态核外电子排布式为________。
答案 [Ar]3d5或1s22s22p63s23p63d5
(8)(2016·全国卷Ⅱ)镍元素基态原子的电子排布式为________,3d能级上的未成对电子数为________。
答案 1s22s22p63s23p63d84s2(或[Ar]3d84s2) 2
(9)(2016·全国卷Ⅰ)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
答案 3d104s24p2 2
(10)(2016·全国卷Ⅲ)写出基态As原子的核外电子排布式________。
答案 1s22s22p63s23p63d104s24p3(或[Ar]3d104s24p3)
考点二 原子结构与元素性质
(频数:★★☆ 难度:★★☆)
名师课堂导语 本考点在选修中主要侧重于电负性与电离能的考查,注意掌握常见元素电负性与电离能的比较方法及特殊情况。
1.原子结构与周期表的关系
(1)原子结构与周期表的关系(完成下列表格)
周
期
能层数
每周期第一种元素
每周期最后一种元素
原子序数
基态原子的简
化电子排布式
原子
序数
基态原子的
电子排布式
二
2
3
[He]2s1
10
1s22s22p6
三
3
11
[Ne]3s1
18
1s22s22p63s23p6
四
4
19
[Ar]4s1
36
1s22s22p63s23p6
3d104s24p6
五
5
37
[Kr]5s1
54
1s22s22p63s23p63d10
4s24p64d105s25p6
六
6
55
[Xe]6s1
86
1s22s22p63s23p63d104s24p6
4d104f145s25p65d106s26p6
(2)每族元素的价层电子排布特点
①主族
主族
ⅠA
ⅡA
ⅢA
ⅣA
排布特点
ns1
ns2
ns2np1
ns2np2
主族
ⅤA
ⅥA
ⅦA
排布特点
ns2np3
ns2np4
ns2np5
②0族:He:1s2;其他ns2np6。
③过渡元素(副族和第Ⅷ族):(n-1)d1~10ns1~2。
(3)元素周期表的分区
①根据核外电子排布分区
②各区元素化学性质及原子最外层电子排布特点
分区
元素分布
外围电子排布
元素性质特点
s区
ⅠA族、ⅡA族
ns1~2
除氢外都是活泼金属元素;通常是最外层电子参与反应
p区
ⅢA族~ⅦA族、0族
ns2np1~6(He除外)
通常是最外层电子参与反应
d区
ⅢB族~ⅦB族、Ⅷ族(除镧系、锕系外)
(n-1)d1~9ns1~2(除钯外)
d轨道可以不同程度地参与化学键的形成
ds区
ⅠB族、ⅡB族
(n-1)d10ns1~2
金属元素
f区
镧系、锕系
(n-2)f0~14(n-1)d0~2ns2
镧系元素化学性质相近,锕系元素化学性质相近
③根据元素金属性与非金属性可将元素周期表分为金属元素区和非金属元素区(如下图),处于金属与非金属交界线(又称梯形线)附近的非金属元素具有一定的金属性,又称为半金属或准金属,但不能叫两性非金属。
(1)①能层数=电子层数=周期数
②主族序数=价电子数
(2)对于主族元素,价电子层就是最外电子层,而对于过渡元素原子不仅仅是最外电子层,如Fe的价电子层排布为3d64s2。
2.对角线规则
在元素周期表中,某些主族元素与右下方的主族元素的有些性质是相似的,如
3.元素周期律
(1)原子半径
①影响因素
②变化规律
元素周期表中的同周期主族元素从左到右,原子半径逐渐减小;同主族元素从上到下,原子半径逐渐增大。
(2)电离能
①第一电离能:气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,符号I1,单位kJ·mol-1。
②规律
a.同周期元素:第一种元素的第一电离能最小,最后一种元素的第一电离能最大,总体呈现从左至右逐渐增大的变化趋势。
b.同族元素:从上至下第一电离能逐渐减小。
c.同种原子:逐级电离能越来越大(即I1INi的原因是_______________________________________。
答案 铜失去的是全充满的3d10电子,镍失去的是4s1电子
(6)(2016·全国卷Ⅰ)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________。
答案 O>Ge>Zn
(7)(2016·全国卷Ⅲ)根据元素周期律,原子半径Ga________As(填“大于”或“
小于”,下同),第一电离能Ga________As。
答案 大于 小于
(8)(2016·海南卷)元素Y的负一价离子的最外层电子数与次外层的相同。元素Y与其同周期元素中,第一电离能最大的是________(写元素符号)。
答案 Ar
相关文档
- 2020届高考化学一轮复习化学平衡常2021-07-077页
- 2021届高考化学一轮复习化学实验方2021-07-077页
- 2021届高考化学一轮复习化学实验方2021-07-075页
- 2021届高考化学一轮复习化学平衡状2021-07-0726页
- 2020届高考化学一轮复习化学键作业2021-07-0717页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0712页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-073页
- 2021届高考化学一轮复习化学实验常2021-07-079页
- 2021届(鲁科版)高考化学一轮复习化学2021-07-0711页
- 2020届高考化学一轮复习化学反应中2021-07-0617页