- 1.19 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
氯及其化合物
1.了解氯单质及其重要化合物的主要性质及应用。
2.了解氯单质及其重要化合物对环境质量的影响。
3.掌握氯气的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
4.了解卤族元素单质及其重要化合物的主要性质及应用。
热点题型一 氯及其重要化合物
例 1、 下列说法中正确的是( )
A.干燥的液氯能用钢瓶贮存
B.氯水可使某些鲜花褪色,而干燥的氯气则不能
C.过量的盐酸与铁反应时可得到 FeCl3
D.Cl2、Cl-均有毒
【答案】A
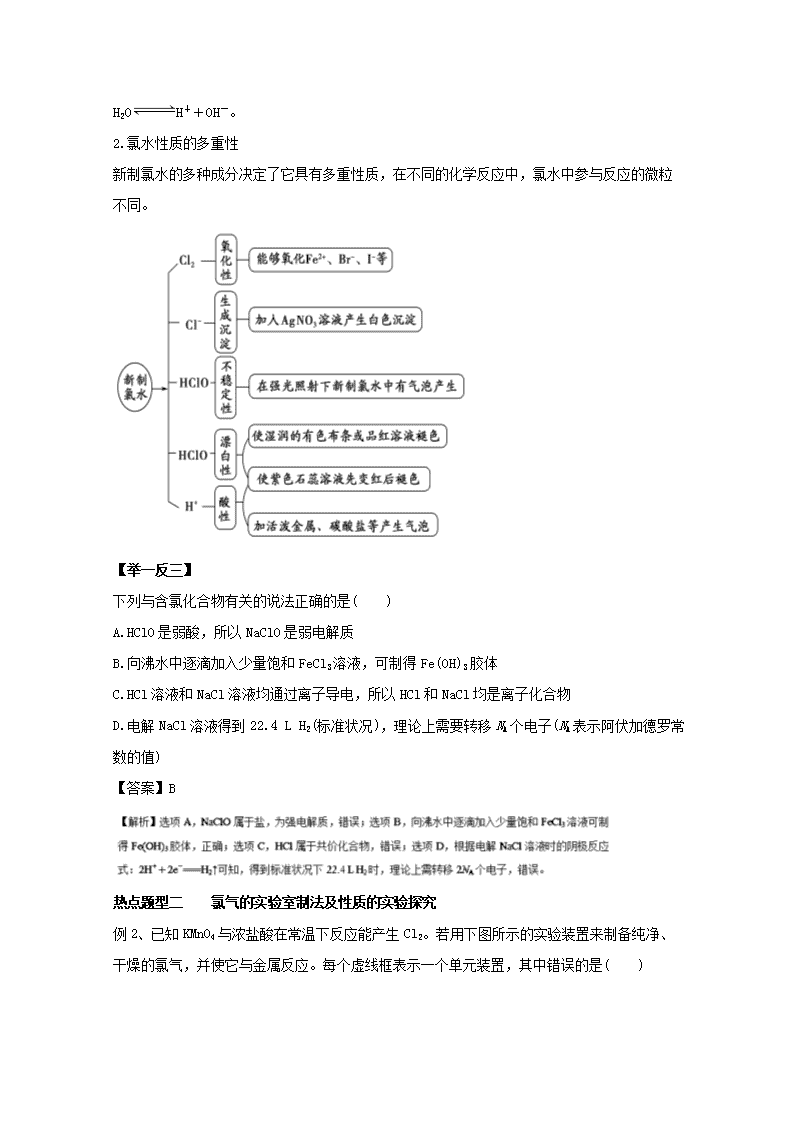
【提分秘籍】氯水的成分及性质的多样性
1.氯水成分的多样性
(1)组成微粒——“三分子”“四离子”。
(2)三个平衡。
Cl2+H2O HClO+HCl、
HClO H++ClO-、
H2O H++OH-。
2.氯水性质的多重性
新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒
不同。
【举一反三】
下列与含氯化合物有关的说法正确的是( )
A.HClO 是弱酸,所以 NaClO 是弱电解质
B.向沸水中逐滴加入少量饱和 FeCl3 溶液,可制得 Fe(OH)3 胶体
C.HCl 溶液和 NaCl 溶液均通过离子导电,所以 HCl 和 NaCl 均是离子化合物
D.电解 NaCl 溶液得到 22.4 L H2(标准状况),理论上需要转移 NA 个电子(NA 表示阿伏加德罗常
数的值)
【答案】B
热点题型二 氯气的实验室制法及性质的实验探究
例 2、已知 KMnO4 与浓盐酸在常温下反应能产生 Cl2。若用下图所示的实验装置来制备纯净、干
燥的氯气,并使它与金属反应。每个虚线框表示一个单元装置,其中错误的是( )
A.①和② B.② C.②和③ D.②③④
【答案】D
【提分秘籍】
1.实验装置
提醒:①必须用浓盐酸,MnO2 与稀盐酸不反应。
②为了减少制得的 Cl2 中 HCl 的含量,所以加热温度不宜过高,减少 HCl 的挥发。
③实验结束后,先使反应停止并排出装置中残留的 Cl2,再拆卸装置,避免污染空气。
④尾气吸收时,不能用澄清石灰水吸收 Cl2,因为溶液中 Ca(OH)2 浓度小,吸收不完全。
⑤酸性 KMnO4 溶液,用的是 H2SO4 酸化而不是盐酸。
【举一反三】
某同学用下列装置制备并检验 Cl2 的性质。下列说法正确的是( )
A.Ⅰ图中:如果 MnO2 过量,浓盐酸就可被全部消耗
B.Ⅱ图中:量筒中发生了加成反应
C.Ⅲ图中:生成蓝色的烟
D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有 Cl2 生成
【答案】D
热点题型三 卤素的来源及性质递变
例 3.从海带中制取单质碘需要经过灼烧、溶解、过滤、氧化、萃取、分液、蒸馏等操作。下
列图示对应的装置合理、操作规范的是( )
【答案】C
【提分秘
籍】
对于卤素单质的化学性质,学生要重点掌握单质氧化性的强弱顺序(Cl2>Br2>I2),在考试中
常结合各种情境进行考查,对于卤素单质的物理性质,除了要注意溴和碘的特性(Br2 易挥发,
I2 易升华)外,还要准确记忆一些常规的性质,如溴和碘在不同溶液中的颜色:溴的四氯化碳
溶液为橙红色,碘的四氯化碳溶液为紫红色。
【举一反三】
下列有关卤素的说法错误的是( )
A.从 HF、HCl、HBr、HI 酸性递增的事实,可推出 F、Cl、Br、I 的非金属性递增的规律
B.HF、HCl、HBr、HI 的热稳定性依次减弱,还原性依次增强
C.淀粉-碘化钾溶液在空气中变蓝,4I-+O2+2H2O===2I2+4OH-
D.碘在碘化钾溶液中的溶解度大于在纯水中的溶解度
【答案】A
【解析】元素的非金属性强弱与其对应的氢化物溶液的酸性强弱无关,可根据其最高价氧化
物对应的水化物的酸性强弱进行比较,A 错误;I2 在 KI 溶液中存在 I2+I- I-
3 ,可使其溶
解度增大,D 正确。
1.【2016 年高考上海卷】一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是
( )
A.过量的氢气与氮气 B.过量的浓盐酸与二氧化锰
C.过量的铜与浓硫酸 D.过量的锌与 18 mol/L 硫酸
【答案】AC
2 .【2016
年高考新课标Ⅲ卷】化学在生活中有着广泛的应用,下列对应关系错误的是( )
化学性质 实际应用
A. Al2(SO4)3 和小苏打反应 泡沫灭火器灭火
B. 铁比铜金属性强 FeCl3 腐蚀 Cu 刻制印刷电路板
C. 次氯酸盐具有氧化性 漂白粉漂白织物
D. HF 与 SiO2 反应 氢氟酸在玻璃器皿上刻蚀标记
【答案】B
【解析】硫酸铝和碳酸氢钠发生反应生成氢氧化铝沉淀、硫酸钠和二氧化碳,能灭火,A 正确;
氯化铁和铜反应生成氯化亚铁和氯化铜,说明铜的还原性强于亚铁离子,不能说明铁的金属
性比铜强,B 错误;次氯酸具有强氧化性,能漂白,C 正确;氟化氢和二氧化硅反应生成四氟
化硅和水,可以刻蚀玻璃,D 正确。
3.【2016 年高考上海卷】类比推理是化学中常用的思维方法。下列推理正确的是( )
A.CO2 是直线型分子,推测 CS2 也是直线型分子
B.SiH4 的沸点高于 CH4,推测 H2Se 的沸点高于 H2S
C.Fe 与 Cl2 反应生成 FeCl3,推测 Fe 与 I2 反应生成 FeI3
D.NaCl 与浓 H2SO4 加热可制 HCl,推测 NaBr 与浓 H2SO4 加热可制 HBr
【答案】AB
【解析】O 和 S 是同族元素,故形成的 CO2 和 CS2 都是直线形分子,A 正确;C 和 Si,Se 和 S
都分别为同族元素,所形成的氢化物都为分子晶体,沸点取决于分子间作用力的大小,分子
间作用力 大小可以用相对分子质量来比较,B 正确;因 I2 的氧化性较弱,故与铁反应生成为
FeI2,C 错误;浓硫酸氧化性很强,会将 HBr 氧化为 Br2,D 错误。
1.【2015 北京理综化学】某消毒液的主要成分为 NaClO,还含有一定量的 NaOH,下列用来解
释事实的方程式中不合理...的是(已知:饱和 NaClO 溶液的 pH 约为 11)( )
A.该消毒液可用 NaOH 溶液吸收 Cl2 制备:Cl2 +2OH-=== Cl-+ ClO-+ H2O
B.该消毒液的 pH 约为 12:ClO-+ H2O HClO+ OH-
C.该消毒液与洁厕灵(主要成分为 HCl)混用,产生 Cl2:2H++ Cl-+ ClO-= Cl2 ↑+ H2O
D.该消毒液加白醋生成 HClO,可增强漂白作用:CH3COOH+ ClO-= HClO+ CH3COO—
【答案】B
2.(2015·福建卷)某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
(1)制取实验结束后,取出 B 中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器
有
________________________________________________________________________
________________________________________________________________________。
(2)若对调 B 和 C 装置的位置。________(填“能”或“不能”)提高 B 中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下 KClO3 可将 KI 氧化为 I2 或 KIO3。该小组设计了系列实验研究反应条件对反应
产物的影响,其中系列 a 实验的记录表如下(实验在室温下进行):
试管编号 1 2 3 4
0.20 mol·L-1 KI/mL 1.0 1.0 1.0 1.0
KClO3(s)/g 0.10 0.10 0.10 0.10
6.0 mol·L-1 H2SO4/mL 0 3.0 6.0 9.0
蒸馏水/mL 9.0 6.0 3.0 0
实验现象
①系列 a 实验的实验目的是
________________________________________________________________________。
②设计 1 号试管实验的作用是
________________________________________________________________________。
③若 2 号试管实验现象为“黄色溶液”,取少量该溶液加入淀粉溶液显蓝色;假设氧化产物
唯一,还原产物为 KCl,则此反应的离子方程式为
________________________________________________________________________。
实验三 测定饱和氯水中氯元素的总量
(4)该小组设计的实验方案为:使用如图所示装置,加热 15.0 mL 饱和氯水试样,测定产生气
体的体积。此方案不可行的主要原因
_____________________________________________________。
(不考虑实验装置及操作失误导致不可行的原因)
(5)根据下列资料,为该小组设计一个可行的实验方案(不必描述操作过程的细节):
________________________________________________________________________
________________________________________________________________________。
资料:i.次氯酸会破坏酸碱指示剂;
ii.次氯酸或氯气可被 SO2、H2O2、FeCl2 等物质还原成 Cl-。
【答案】(1)烧杯、漏斗、玻璃棒、胶头滴管(不填“胶头滴管”也可)
(2)能
(3)①研究反应体系中硫酸浓度对反应产物的影响 ②硫酸浓度为 0 的对照实验 ③6H++
ClO-
3 +6I-===Cl-+3H2O+3I2
(4)因存在 Cl2 的重新溶解、HClO 分解等,此方案无法测算试样含氯总量(或其他合理答案)
(5)量取一定量的试样,加入足量的 H2O2 溶液,加热除去过量的 H2O2,冷却,再加入足量的硝
酸银溶液,称量沉淀质量(或其他合理答案)
【解析】(2)若对调 B 和 C 装置的位置,可利用水吸收氯气中的 HCl,从而减少 HCl 与 KOH 的
反应,提高 B 中 KClO3 的产率。(3)①分析表中的数据知 KI、KClO3 的浓度不变,硫酸浓度变化,
因此实验目的是研究硫酸浓度对反应产物的影响;②试管 1 号设计硫酸浓度为 0,是作为对比
参照实验;③遇淀粉变蓝的物质为 I2,而还原产物是 KCl,所以反应为 ClO-
3 +6I-+6H+===Cl
-+3I2+3H2O。(4)由于此实验涉及 Cl 2 重新溶解,特别是 HClO 可分解等因素,所以此方案无
法测算试样含氯元素总量。(5)根据资料ⅱ可设计实验:将氯水还原使溶液的成分是 HCl,然
后加入 AgNO3 溶液,根据 AgCl 的质量求出氯元素的质量。具体操作是取一定量的试样,加入
足量的 H2O2,将 Cl2 还原为 Cl-,加热除去过量的 H2O2,冷却,加入足量的 AgNO3 溶液,稀取沉
淀的质量。
3.【2015 新课标Ⅱ卷理综化学】海水开发利用的部分过程如图所示。下列说法错误..的是( )
A.向苦卤中通入 Cl2 是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用 NaOH 作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用 SO2 将其还原吸收
【答案】C
4.【2015 重庆理综化学】下列说法正确的是( )
A.I 的原子半径大于 Br,HI 比 HBr 的热稳定性强
B.P 的非金属性强于 Si,H3PO4 比 H2SiO3 的酸性强
C.Al2O3 和 MgO 均可与 NaOH 溶液反应
D.SO2 和 SO3 混合气体通入 Ba(NO3)2 溶液可得到 BaSO3 和 BaSO4
【答案】B
【解析】A.非金属性 Br>I,则 HBr 比 HI 的热稳定性强,A 错误;B.非金属性 P>Si,则 H3PO4 比
H2SiO3 的酸性强,B 正确;C.Al2O3 属于两性氧化物,能与氢氧化钠溶液反应,MgO 属于碱性氧
化物,与 NaOH 溶液不反应,C 错误;D.SO2 在酸性环境中能被 Ba(NO3)2 氧化成硫酸钡,则 SO2
和 SO3 混合气体通入 Ba(NO3)2 溶液只得到 BaSO4 白色沉淀,D 错误;答案选 B。
5.【2015 广东理综化学】下列实验操作、现象和结论均正确的是( )
选项 实验操作 现象 结论
A 分别加热 Na2CO3 和 NaHCO3 固体 试管内壁都有水珠 两种物质均受热分解
B
向稀的苯酚水溶液中滴加饱和溴
水
生成白色沉淀
产物三溴苯酚不溶于
水
C
向含 I-的无色溶液中滴加少量新
制氯水,再滴加淀粉溶液
加入淀粉后溶液变成
蓝色
氧化性:Cl2>I2
D
向 FeSO4 溶液中先滴入 KSCN 溶液
再滴加 H2O2 溶液
加入 H2O2 后溶液变成
血红色
Fe2+ 既有氧化性又有
还原性
【答案】BC
1.(2014·海南卷)化学与日常生活密切相关,下列说法错误的是( )
A.碘酒是指单质碘的乙醇溶液
B.84 消毒液的有效成分是 NaClO
C.浓硫酸可刻蚀石英制艺术品
D.装饰材料释放的甲醛会造成污染
【答案】C
【解析】 石英的主要化学成分是 SiO2,硫酸不与 SiO2 反应,C 项错误;甲醛是一种有毒气体,
D 项正确。
2.(2014·山东卷)下表中对应关系正确的是( )
A CH3CH3+Cl2――→光 CH3CH2Cl+HCl
CH2===CH2+HCl―→CH3CH2Cl
均为取代反应
B
由油脂得到甘油
由淀粉得到葡萄糖
均发生了水解反应
C
Cl2+2Br-===2Cl-+Br2
Zn+Cu2+===Zn2++Cu
均为单质被还原的置换反应
D
2Na2O2+2H2O===4NaOH+O2↑
Cl2+H2O===HCl+HClO
均为水作还原剂的氧化还原反应
【答案】B
【解析】 CH2===CH2 与 HCl 的反应为加成反应,A 项错误;油脂水解生成甘油和高级脂肪酸,
淀粉水解的最终产物为葡萄糖,B 项正确;Zn+Cu2+===Zn2++Cu 的反应中被还原的是 Cu2+,C
项错误;Na2O2 与 H2O 的反应中氧化剂、还原剂均为 Na2O2,Cl2 与 H2O 的反应中氧化剂、还原剂
均为 Cl2,D 项错误。
3.(2014·全国卷)下列叙述错误的是( )
A.SO2 使溴水褪色与乙烯使 KMnO4 溶液褪色的原理相同
B.制备乙酸乙酯时可用热的 NaOH 溶液收集产物以除去其中的乙酸
C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D.用 AgNO3 溶液可以鉴别 KCl 和 KI
【答案】B
4.(2014·四川卷)下列实验方案中,不能达到实验目的的是( )
选项 实验目的 实验方案
A
检验 CH3CH2Br 在 NaOH 溶液中是否发生水
解
将 CH3CH2Br 与 NaOH 溶液共热。冷却后,
取出上层水溶液,用稀 HNO3 酸化,加入
AgNO3 溶液,观察是否产生淡黄色沉淀
B 检验 Fe(NO3)2 晶体是否已氧化变质
将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN
溶液,观察溶液是否变红
C 验证 Br2 的氧化性强于 I2
将少量溴水加入 KI 溶液中,再加入 CCl4,
振荡,静置,可观察到下层液体呈紫色
D 验证 Fe(OH)3 的溶解度小于 Mg(OH)2
将 FeCl3 溶液加入 Mg(OH)2 悬浊液中,振
荡,可观察到沉淀由白色变为红褐色
【答案】B
【解析】溴乙烷在氢氧化钠溶液中加热发生水解生成乙醇、溴化钠。在酸性条件下溴化钠与
硝酸银溶液反
应产生淡黄色溴化银沉淀,能达到实验目的,A 正确;在 Fe(NO3)2 中加入 H2SO4 后,发生反应
的离子方程式为 3Fe2++NO-
3 +4H+===3Fe3++NO↑+2H2O,再向其中加入 KSCN 溶液后 ,溶液呈
血红色,则该方案不能确定被检验出的 Fe3+是来源于 Fe(NO3)2 变质,还是因为 Fe(NO3)2 溶于
H2SO4 后,Fe2+被 HNO3 氧化,B 错误;溴水加入碘化钾,若生成碘单质则四氯化碳层呈紫色,说
明单质溴的氧化性强于单质碘,C 正确;沉淀由白色转变为红褐色,说明氢氧化镁转化为氢氧
化铁,即可验证氢氧化铁的溶解度小于氢氧化镁,D 正确。
5.(2014·江苏卷)实验室从含碘废液(除 H2O 外,含有 CCl4、I2、I-等)中回收碘,其实验过
程如下:
(1)向含碘废液中加入稍过量的 Na2SO3 溶液,将废液中的 I2 还原为 I-,其离子方程式为
__________________;该操作将 I2 还原为 I-的目的是______________________。
(2)操作 X 的名称为________。
(3)氧化时,在三颈烧瓶中将含 I-的水溶液用盐酸调至 pH 约为 2,缓慢通入 Cl2,在 40 ℃左
右反应(实验装置如图所示)。
实验控制在较低温度下进行的原因是______________;锥形瓶里盛放的溶液为________。
(4)已知:5SO2-
3 +2IO-
3 +2H+===I2+5SO2-
4 +H2O
某含碘废水(pH 约为 8)中一定存在 I2,可能存在 I-、IO -
3 中的一种或两种。请补充完整检验
含碘废水中是否含有 I-、IO -
3 的实验方案:取适量含碘废水用 CCl4 多次萃取、分液,直到水
层用淀粉溶液检验不出有碘单质存在;
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3 溶液、Na2SO3 溶液。
【答案】(1)SO2-
3 +I2+H2O===2I-+SO2-
4 +2H+ 使 CCl4 中的碘进入水层
(2)分液
(3)使氯气在溶液中有较大的溶解度(或防止 I2 升华或防止 I2 进一步被氧化) NaOH 溶液
(4)从水层取少量溶液,加入 1~2 mL 淀粉溶液,加盐酸酸化,滴加 FeCl3 溶液,若溶液变蓝,
说明废水中含有 I-;若溶液不变蓝,说明废水中不含有 I-。另从水层取少量溶液,加入 1~2
mL 淀粉溶液,加盐酸酸化,滴加 Na2SO3 溶液,若溶液变蓝,说明废水中含有 IO-
3 ;若溶液不变
蓝,说明废水中不含有 IO-
3
【解析】 (1)SO 2-
3 被 I2 氧化为 SO2-
4 ,I2 被还原为 I-,结合电荷守恒和原子守恒可得 SO2-
3 +I2
+H2O===2I-+SO2-
4 +2H+。因为 I2 不溶于水,而碘化物易溶于水,故将 I2 还原为 I-的目的是使
碘元素进入水层。(2)分离有机溶剂和水溶液的混合物需要分液。(3)温度越高,Cl2 溶解度越
小,而且随温度升高,Cl2 会把 I2 进一步氧化为 IO-
3 ,导致氧化 I-的效率偏低;另外,I2 也容
易升华。
(4)检验 I2 用淀粉,结合所给试剂的性质,FeCl3 具有氧化性,可将 I-氧化为 I2,而 Na2SO3 具
有强还原性,可将 IO -
3 还原为 I2。
6.(2014·四川卷)能正确表示下列反应的离子方程式的是( )
A.Cl2 通入 NaOH 溶液:Cl2+OH-===Cl-+ClO-+H2O
B.NaHCO3 溶液中加入稀盐酸:CO2-
3 +2H+===CO2↑+H2O
C.AlCl3 溶液中加入过量稀氨水:Al3++4NH3·H2O===AlO-
2 +4NH+
4 +2H2O
D.Cu 溶于稀 HNO3 :3Cu+8H++2NO-
3 ===3Cu2++2NO↑+4H2O
【答案】D
7.(2014·四川卷)下列关于物质分类的说法正确的是( )
A.金刚石、白磷都属于单质
B.漂白粉、石英都属于纯净物
C.氯化铵、次氯酸都属于强电解质
D.葡萄糖、蛋白质都属于高分子化合物
【答案】A
【解析】金刚石是碳单质,白磷的化学式为 P4 ,A 项正确;漂白粉是氯化钙和次氯酸钙的混
合物,B 项错误;次氯酸是弱酸,属于弱电解质,C 项错误;葡萄糖是单糖,不属于高分子化
合物,D 项错误。
8.(2014·山东卷)下表中对应关系正确的是( )
A CH3CH3+Cl2――→光 CH3CH2Cl+HCl
CH2===CH2+HCl―→CH3CH2Cl
均为取代反应
B
由油脂得到甘油
由淀粉得到葡萄糖
均发生了水解反应
C
Cl2+2Br-===2Cl-+Br2
Zn+Cu2+===Zn2++Cu
均为单质被还原的置换反应
D
2Na2O2+2H2O===4NaOH+O2↑
Cl2+H2O===HCl+HClO
均为水作还原剂的氧化还原反应
【答案】B
【解析】CH2===CH2 与 HCl 的反应为加成反应,A 项错误;油脂水解生成甘油和高级脂肪酸,淀
粉水解的最终产物为葡萄糖,B 项正确;Zn+Cu2+===Zn2++Cu 的反应中被还原的是 Cu2+,C 项
错误;Na2O2 与 H2O 的反应中氧化剂、还原剂均为 Na2O2,Cl2 与 H2O 的反应中氧化剂、还原剂均
为 Cl2,D 项错误。
9.(2014·江苏卷)在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正
确的是( )
A.氯水的颜色呈浅黄绿色,说明氯水中含有 Cl2
B.向氯水中滴加硝酸酸化的 AgNO3 溶液,产生白色沉淀,说明氯水中含有 Cl-
C.向氯水中加入 NaHCO3 粉末,有气泡产生,说明氯水中含有 H+
D.向 FeCl2 溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有 HClO
【答案】D
10.(2014·全国卷)下列除杂方案错误的是( )
选项 被提纯的物质 杂质 除杂试剂 除杂方法
A. CO(g) CO2(g)
NaOH 溶液、
浓 H2SO4
洗气
B. NH4Cl(aq) Fe3+(aq) NaOH 溶液 过滤
C. Cl2(g) HCl(g)
饱和食盐水、
浓 H2SO4
洗气
D. Na2CO3(s) NaHCO3(s) — 灼烧
【答案】B
【解析】混合气体通过盛有 NaOH 溶液的洗气瓶时,CO2 被吸收,再通过盛有浓硫酸的洗气瓶时
可将带出的水蒸气除去,得干燥、纯净的 CO,A 项正确;NaOH 溶液可与 NH4Cl 溶液发生反应
NaOH+NH4Cl===NaCl+NH3↑+H2O,B 项错误;Cl2 在饱和食盐水中的溶解度很小,而 HCl 在饱
和食盐水中的溶解度很大,混合气体通过盛有饱和食盐水的洗气瓶时 HCl 气体被吸收,再通
过盛有浓硫酸的洗气瓶时可除去带出的水蒸气,C 项正确;灼烧时,杂质 NaHCO3 发生反应
2NaHCO3=====△ Na2CO3+CO2↑+H2O,D 项正确。
11.(2014·新课标全国卷Ⅰ)化学与社会、生活密切相关。对下列现象或事实的解释正确的
是( )
选项 现象或事实 解释
A. 用热的纯碱溶液洗去油污 Na2CO3 可直接与油污反应
B. 源白粉在空气中久置变质
漂白粉中的 CaCl2 与空气中的 CO2 反
应生成 CaCO3
C.
施肥时,草木灰(有效成分为 K2CO3)
不能与 NH4Cl 混合使用
K2CO3 与 HN4Cl 反应生成氨气会降低肥
效
D.
FeCl3 溶液可用于铜质印刷线路板制
作
FeCl3 能从含 Cu2+的溶液中置换出铜
【答案】C
【解析】在加热、碱性环境下,油污能够彻底水解,A 项错误;Ca(ClO)2 与空气中的 CO2 和水
蒸气反应生成 CaCO3 和 HClO,导致漂白粉变质,而 CaCl2 与 CO2 不反应,B 项错误;K2CO3 与 NH4Cl
混合施用,发生双水解反应释放出 NH3,降低肥效,C 项正确;FeCl3 与 Cu 的反应为 2FeCl3+
Cu===2FeCl2+CuCl2,但 FeCl3 溶液不能将 Cu2+还原为 Cu,D 项错误。
11.(2014·天津卷)实验室制备下列气体时,所用方法正确的是( )
A.制氧气时,用 Na2O2 或 H2O2 作反应物可选择相同的气体发生装置
B.制氯气时,用饱和 NaHCO3 溶液和浓硫酸净化气体
C.制乙烯时,用排水法或向上排空气法收集气体
D.制二氧化氮时,用水或 NaOH 溶液吸收尾气
【答案】A
1.实验室用下列两种方法制氯气:①用含 HCl 146 g 的浓盐酸与足量的 MnO2 反应;②用 87 g
MnO2 与足量浓盐酸反应。所得的氯气( )
A.①比②多 B.②比①多
C.一样多 D.无法比较
【答案】B
【解析】反应的化学方程式为 MnO2+4HCl(浓)=====△ MnCl2+Cl2↑+2H2O。①146 g 氯化氢的物
质的量=146 g÷36.5 g/mol=4 mol,理论上含 HCl 146 g 的浓盐酸与足量的 MnO2 反应,根
据 4HCl~Cl2 知可得氯气 1 mol,但随盐酸浓度变稀,溶质 HCl 不可能全部反应,故实际生成
的氯气应小于 1 mol;②用 87 g MnO2 与足量浓盐酸反应,87 g 二氧化锰的物质的量是 87 g÷87
g/mol=1 mol,因为浓盐酸足量,可以使 87 g MnO2 全部反应,故生成的氯气为 1 mol,所以
答案选 B。
2.下列各组实验现象可用同一原理解释的是( )
A.品红溶液中分别通入 SO2 和 Cl2,品红均褪色
B.溴水分别滴入植物油和裂化汽油中,溴水均褪色
C.浓硫酸和浓盐酸长期暴露在空气中浓度都会降低
D.鸡蛋白溶液中分别加入 NaCl 溶液和 CuCl2 溶液,均有固体析出
【答案】B
3.下列有关氯元素单质及其化合物性质的说法正确的是( )
A.液氯是纯净物,氯水是电解质,漂白粉是混合物
B.氯气可用作消毒剂和漂白剂,是因为氯分子具有强氧化性
C.随着化合价的升高,氯的含氧酸酸性和氧化性均逐渐增强
D.不能用 pH 试纸测定氯水的 pH
【答案】D
【解析】氯水是混合物,不是电解质;氯气可用作消毒剂和漂白剂,是因为氯气与水反应生
成的次氯酸具有强氧化性;次氯酸的氧化性强于高氯酸;因为氯水能将 pH 试纸漂白,所以不
能用 pH 试纸测定氯水的 pH。
4.研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能
和浓盐酸反应制得氯气,且含锰化合物的还原产物都是 MnCl2。他们将 6.32 g KMnO4 粉末加热
一段时间,也不知道高锰酸钾是否完全分解,收集到 0.112 L 气体后便停止加热了,冷却后
加入足量的浓盐酸再加热,又收集到的气体体积是(上述气体体积都折合成标准状况)( )
A.0.448 L B.2.240 L
C.2.016 L D.无法确定
【答案】C
【解析】根据得失电子守恒可知,KMnO4 中 Mn 元素得到的电子总数等于 O 元素失去的电子总数
与浓盐酸中 Cl 元素失去的电子总数之和。n(KMnO4)= 6.32 g
158 g/mol
=0.04 mol,n(O2)=
0.112 L
22.4 L/mol
=0.005 mol,则有 0.04 mol×5=0.005 mol×4+n(Cl2)×2,解得 n(Cl2)=0.09
mol,所以生成的氯气在标准状况下的体积 V=0.09 mol×22.4 L/mol=2.016 L。
5.有一混合溶液,其中只含有 Fe2+、Cl-、Br-、I-(忽略水的电离),Cl-、Br-、I-的个数比
为 2∶3∶4,向该溶液中通入氯气使溶液中 Cl-和 Br-的个数比为 3∶1,则通入氯气的物质的
量与溶液中剩余 Fe2+的物质的量之比为( )
A.7∶4 B.7∶3
C.7∶2 D.7∶1
【答案】B
【解析】设 Cl-、Br-、I-的物质的量分别为 2 mol、3 mol、4 mol,由电荷守恒可得:2n(Fe2
+)=n(Cl-)+
n(Br-)+n(I-)=2 mol+3 mol+4 mol=9 mol,n(Fe2+)=4.5 mol,通入氯气后,要满足 n(Cl
-)∶n(Br-)=3∶1,Cl-只要增加 7 mol 就可以,即需通入氯气 3.5 mol。4 mol I-先消耗 2 mol
氯气,3 mol Fe2+消耗 1.5 mol 氯气,剩余 Fe2+1.5 mol,则通入氯气与剩余 Fe2+的物质的量
之比为 3.5∶1.5=7∶3,故选 B。
6.下列关于氯水的说法正确的是( )
A.向氯水中通入少量二氧化硫,氯水的漂白性增强
B.氯水中加入 NaCl 固体,对溶液的 pH 无影响
C.常温下,pH=2 的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01 mol·L-1
D.向氯水中滴加少量 NaHCO3 溶液的离子反应方程式为 Cl2+2HCO-
3 ===2CO2↑+Cl-+ClO-+H2O
【答案】C
7.常温下,将 Cl2 缓慢通入 100 mL 水中至饱和,然后向所得饱和氯水中逐滴加入 0.1 mol/L NaOH
溶液,整个过程中 pH 的变化如图所示。下列有关叙述正确的是( )
A.曲线③④段有离子反应:
HClO+OH-===ClO-+H2O
B.可依据②处数据计算所溶解的 n(Cl2)
C.③处表示氯气与氢氧化钠溶液恰好反应完全
D.①处 c(H+)约为②处 c(H+)的 2 倍
【答案】A
【解析】由题图看出③处 pH=7,此时溶液中溶质为 NaCl、CaClO、HClO,所以③④段有化学
反应:HClO+NaOH===NaClO+H2O,其离子方程式为 HClO+OH-===H2O+ClO-,A 正确;由②处
数据无法计算所溶解的 n(Cl2),B 错;Cl2 与 NaOH 恰好完全反应时产物为 NaCl、NaClO,溶液
显碱性,pH 不等于 7,C 错;②处 pH 小于①处,所以②处 c(H+)大于①处,D 错。
8.标准状况下,将 a L H2 和 Cl2 的混合气体点燃,充分反应后,将混合气体通入含 b mol NaOH
的热溶液中,气体恰好被完全吸收,NaOH 无剩余,测得反应后溶液中含 Cl-、ClO-、ClO-
3 ,
且三者物质的量之比为 8∶1∶1,则原混合气体中 H2 的物质的量为( )
A.a
2
mol B.
a
22.4
-b
mol
C.
a
22.4
-b
2 mol D.b
2
mol
【答案】C
【解析】反应后溶液中 Na+的物质的量等于 Cl-、ClO-、ClO -
3 的物质的量之和,也等于混合气
体中氯原子的物质的量,所以氯气的物质的量为b
2
mol,则氢气的物质的量为
a
22.4
-b
2 mol。
9.下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
(1)装置 A 是氯气的发生装置,其中盛放浓盐酸的仪器名称是________,请写出该反应相应的
化学方程式:
________________________________________________________________________
________________________________________________________________________。
(2)装置 B 中饱和食盐水的作用是________;同时装置 B 也是安全瓶,监测实验进行时 C 中是
否发生堵塞,请写出发生堵塞时 B 中的现象:
________________________________________________________________________。
(3)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组
合应是________(填字母编号)。
编号 Ⅰ Ⅱ Ⅲ
a
干燥的
有色布条
碱石灰
湿润的
有色布条
b
干燥的
有色布条
无水硫酸铜
湿润的
有色布条
c
湿润的
有色布条
浓硫酸
干燥的
有色布条
d
湿润的
有色布条
无水氯化钙
干燥的
有色布条
(4)设计装置 D、E 的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开活塞,将
装置 D 中少量溶液加入装置 E 中,振荡,观察到的现象是
________________________________________________________________________
________,该现象________(填“能”或“不能”)说明溴单质的氧化性强于碘,原因是
________________________________________________________________________。
(5)装置 F 的作用是____________________,其烧杯中的溶液不能选用下列中的________(填
字母编号)。
a.饱和 NaOH 溶液 b.饱和 Ca(OH)2 溶液
c.饱和 Na2SO3 溶液 d.饱和 Na2CO3 溶液
【答案】(1)分液漏斗 Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O (2)除去 Cl2 中的 HCl B
中长颈漏斗中液面上升,形成水柱 (3)d (4)E 中溶液分为两层,上层为紫红色 不能 D
溶液中可能含有过量的氯气,无法排除氯气与 KI 反应 (5)吸收多余氯气,防止污染环境 b
相关文档
- 2021届高考化学一轮复习富集在海水2021-07-0814页
- 2021版高考化学一轮复习热点突破微2021-07-088页
- 高考化学第一轮复习课件第2讲 离2021-07-087页
- 2021新高考化学鲁科版一轮复习突破2021-07-089页
- 2020届高考化学一轮复习元素的综合2021-07-0810页
- 高考化学二轮习题化学实验设计与评2021-07-0825页
- 2019届高考化学二轮复习化学工艺作2021-07-0828页
- 高考化学第一轮复习课件第4讲 难2021-07-085页
- 2020鲁科版高考化学复习规范练 (222021-07-086页
- 2021届高考化学一轮复习元素周期表2021-07-087页