- 452.60 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2020届新课标Ⅱ卷冲刺高考考前预热卷(六)
化学试题卷
考生注意:
1.本卷共100分,考试时间50分钟。
2. 答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。
3. 不得在本卷上答题,请将答案填写在答题卡指定区域。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 P 31 S 32 Cl 35.5 Cu 64 Zn 65
一、选择题:本大题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与生活、环境密切相关,下列说法错误的是( )
A.生活中钢铁制品生锈主要是由于发生吸氧腐蚀所致
B.石油的裂化、裂解和煤的干馏都属于化学变化
C.天然纤维、人造纤维、合成纤维的组成元素相同
D,工业废水中的Cu2+、Hg2+等重金属阳离子可以通过加入FeS除去
8.为探究一溴环己烷()与NaOH醇溶液共热发生的是水解反应还是消去反应,下列设计的四种实验方案中正确的是( )。
A.向反应混合液中滴入稀硝酸中和NaOH,然后再滴入AgNO3溶液,若有浅黄色沉淀生成,则可证明发生了消去反应
B.向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应
C.向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应
D.先向混合液中加入足量的稀硫酸中和过量的碱,再滴入溴水,如果溴水颜色很快褪去,说明有烯烃生成,即可证明发生了消去反应
9.NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.在标准状况下,11.2 L CH2Cl2分子中含氯原子数目为NA
B.14 g Li投入100 mL 1 mol·L-1盐酸中转移电子数目为0.1NA
C.1 L 0.1 mol·L-1 H2S溶液中H+数目为0.2NA
D.2.0 g含D2O和HO的混合物中含中子数目为NA
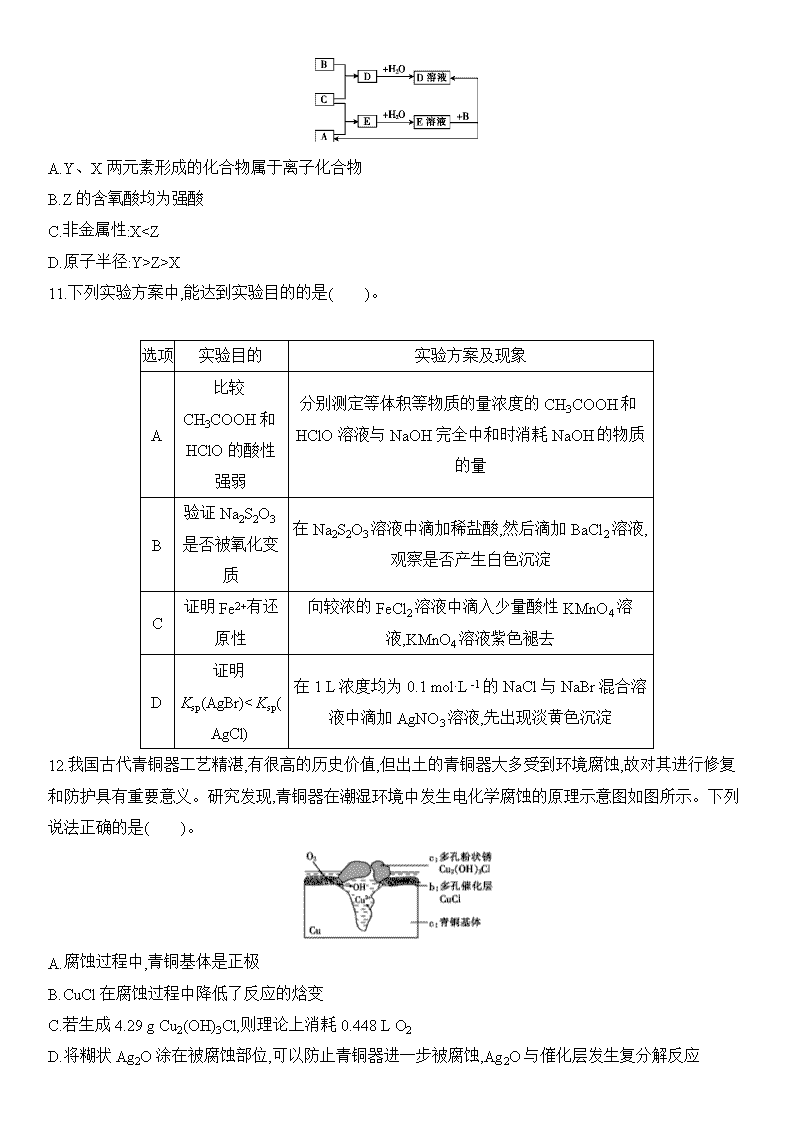
10.短周期元素X、Y、Z的原子序数依次增大,其中Y元素的原子半径最大。已知A、B、C分别是X、Y、Z三种元素的单质,A和C常温下为气体。在一定条件下,A、B、C可以发生如图所示的反应。下列说法不正确的是( )。
A.Y、X两元素形成的化合物属于离子化合物
B.Z的含氧酸均为强酸
C.非金属性:XZ>X
11.下列实验方案中,能达到实验目的的是( )。
选项
实验目的
实验方案及现象
A
比较CH3COOH和HClO的酸性强弱
分别测定等体积等物质的量浓度的CH3COOH和HClO溶液与NaOH完全中和时消耗NaOH的物质的量
B
验证Na2S2O3是否被氧化变质
在Na2S2O3溶液中滴加稀盐酸,然后滴加BaCl2溶液,观察是否产生白色沉淀
C
证明Fe2+有还原性
向较浓的FeCl2溶液中滴入少量酸性KMnO4溶液,KMnO4溶液紫色褪去
D
证明Ksp(AgBr)”“<”或“=”)NiO,原因是
________________________________________________________________________
________________________________________________________________________。
(2)航母螺旋桨主要用铜合金制造。含铜废液可以利用铜萃取剂M,通过如下反应实现铜离子的富集,进行回收。
①M所含元素的电负性由大到小的顺序为________(用元素符号表示)。
②上述反应中断裂和生成的化学键有________(填序号)。
A.共价键 B.配位键
C.金属键 D.范德华力
(3)航母舰艇底部涂有含Cu2O的防腐蚀涂料。已知Cu2O的晶胞结构如图所示。
①该晶胞结构中铜原子的配位数是________。
②已知该晶体的密度为d g·cm-3,阿伏加德罗常数的值为NA,则该立方晶胞的参数是________ pm。
36.[化学——选修5:有机化学基础](15分)
5.T·M是一种应用广泛的高分子聚酯,工业上用有机原料A制备T·M和聚乙酸乙烯酯,其流程如下:
已知:
①分子A苯环上的一元取代物只有两种结构。
②调节pH,—CHO与不稳定的烯醇结构(即烃基与双键碳原子相连的结构)易发生可逆互变:RCH2CHORCH===CHOH。
③—COOH能被LiAlH4还原—CHO。
④—ONa连在烃基上不会被氧化。
请回答下列问题:
(1)G的结构简式是________。
(2)①的反应类型是________。
(3)从I→J需要加入的试剂名称是________。
(4)J的化学名称是________。
(5)写出J→T·M的化学方程式:
________________________________________________________________________。
(6)与A有相同官能团且有两个侧链的芳香化合物的同分异构体有________种。其中核磁共振氢谱为五组峰的结构简式为________________。
(7)设计一条由乙二醇为起始原料制备聚乙二酸乙二酯的合成路线。合成路线流程图示例如下:
CH2CH2CH3CH2BrCH3CH2OH。
参考答案
7
8
9
10
11
12
13
C
D
D
B
D
D
C
26.(1)Al2O3+2OH-===2AlO+H2O
(2)减小
(3)石墨电极被阳极上产生的O2氧化
(4)4CO+2H2O-4e-===4HCO+O2↑ H2
(5)NH4Cl分解产生的HCl能够破坏Al表面的Al2O3薄膜
27.(1)蒸馏烧瓶 防止暴沸
(2)丙烯、正丙醚 (3)减少1溴丙烷的挥发
(4)减少HBr挥发
(5)将分液漏斗下口向上倾斜、打开活塞排出气体
28.(1)
(2)2As2S3+5O2+6H2O===4H3AsO4+6S 加压可以增加反应物O2的浓度,提高As2S3的转化率
(3)2ΔH1-3ΔH2-ΔH3
(4)①ac ②大于 ③小于 tm时生成物浓度较低,反应速率较慢
④(mol·L-1)-1(可不带单位)
35.(1)①
②Fe3+的价电子排布式为3d5,处于半充满状态,结构稳定 ③< FeO和NiO的阴离子相同,阳离子所带电荷相同,但r(Fe2+)>r(Ni2+),所以FeO的晶格能较小,熔点较低
(2)①O>N>C>H ②AB (3)①2 ② ×1010
36.(1)CH3COOCH===CH2
(2)取代反应
(3)稀硫酸(或稀盐酸)
(4)对羟基苯甲酸(或4羟基苯甲酸)
(5)
(6)11 、
(7)
相关文档
- 2020届新课标Ⅱ卷冲刺高考考前预热2021-07-089页
- 2020届新课标Ⅲ卷冲刺高考考前预热2021-07-0810页
- 2020届新课标Ⅱ卷冲刺高考考前预热2021-07-0810页
- 2020届新课标Ⅲ卷冲刺高考考前预热2021-07-079页
- 2020届新课标Ⅰ卷冲刺高考考前预热2021-07-068页
- 2020届新课标Ⅰ卷冲刺高考考前预热2021-07-068页
- 2020届新课标Ⅱ卷冲刺高考考前预热2021-07-0610页
- 2020届新课标Ⅲ卷冲刺高考考前预热2021-07-069页
- 2020届新课标Ⅲ卷冲刺高考考前预热2021-07-069页
- 2020届新课标Ⅱ卷冲刺高考考前预热2021-07-069页