- 335.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
宿迁市2018~2019学年度第一学期市直高三期末测试
化 学
本试卷满分:120分;考试时间:100分钟
可能用到的相对原子质量: H 1 C 12 O 16 Na 23 Ca 40 Cu 64 I 127 Ba 137 Pb 207
选择题(40分)
单项选择题:本题包括10小题,每小题2 分,共计20 分。每小题只有一个选项符合题意。
1.下列说法与“绿水青山就是金山银山”的绿色发展理念不一致的是
A.将工业废液排入海洋以减少河道污染
B.推广煤的液化、气化技术以提高煤的使用效率
C.开发光电转换材料,充分利用太阳能
D.采用催化转化技术将汽车尾气中的NOx和CO转化为无毒气体
2.下列化学用语表示正确的是
A.H2S的电子式:
B.间硝基甲苯的结构简式:
C.质子数为35、中子数为45的溴原子:Br
D.NaHS溶液显碱性的原因: HS− + H2O S2−+ H3O+
3.下列有关物质性质与用途具有对应关系的是
A.Al2O3是两性氧化物,可用作耐高温材料
B.氯化铁溶液呈酸性,可用于蚀刻铜电路板
C.晶体硅熔点高、硬度大,可用于制作半导体材料
D.Fe粉具有还原性,可用作食品袋中的抗氧化剂
4.室温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明溶液中:NH4+、Fe3+、NO− 3、SO2− 4
c(H+)
KW
B.通入大量CO2的溶液中:Na+、SiO2− 3、CH3COO−、SO2− 4
C. = 1×10−13 mol﹒L−1 的溶液中:Fe2+、K+、NO− 3 、Cl−
D.能使酚酞变红的溶液中: K+、SO2− 3 、CO2− 3、Cl−
(化学试卷 第11页 共11页)
5.四种短周期主族元素X、Y、Z、M原子序数依次增大,其中Y最外层电子数比次外层电子数多4个,且与其它元素均不在同一周期,Z的原子半径在所有短周期主族元素中最大。M与Y同主族。下列说法正确的是
A.简单离子半径: Z > M > Y
B.X2Y2与Z2Y2所含化学键类型完全相同
C.元素的简单气态氢化物稳定性:Y > M
D.Y、Z、M三种元素形成的化合物水溶液一定显碱性
6.下列指定反应的离子方程式正确的是
A.过量CO2通入氨水:CO2 + NH3·H2O =NH+ 4 + HCO− 3
B.SO2使溴水褪色:SO2 + 2H2O + Br2=2H+ +SO2− 4 + 2HBr
C.用H2O2从酸化的海带灰浸出液中提取碘:2I− + H2O2=I2+2OH−
D.向NH4Al(SO4)2溶液中加入过量的NaOH溶液:Al3+ +4OH−=AlO− 2+ 2H2O
7.实验室制取、收集氨气并利用氨气制备Al2O3,下列装置和原理能达到实验目的的是
NH4Cl和
Ca(OH)2
甲
丁
丙乙
乙
A.用装置甲制取NH3 B.用装置乙收集NH3
C.用装置丙吸收尾气制取Al(OH)3 D.用装置丁灼烧Al(OH)3制取Al2O3
8.下列叙述正确的是
A.金属钠着火时,可用泡沫灭火器灭火
B.常温下,Al、Fe遇浓硫酸或浓硝酸发生钝化
C.蔗糖与银氨溶液在水浴加热条件下可发生银镜反应
D.电解精炼铜过程中,若阳极质量减少32g,则电路中转移电子数目为NA
煅烧
CO2
9.在给定条件下,下列选项所示物质间转化均能实现的是
HCl(aq)(aq)
电解
A.CaCl2(aq) CaCO3(s) CaO(s)
CO
高温
O2
高温
B.MgO(s) MgCl2(aq) Mg(s)
一定条件
NaOH/H2O
C.FeS2(s) Fe2O3(s) Fe(s)
D.CH3CH2Br CH2=CH2
(化学试卷 第11页 共11页)
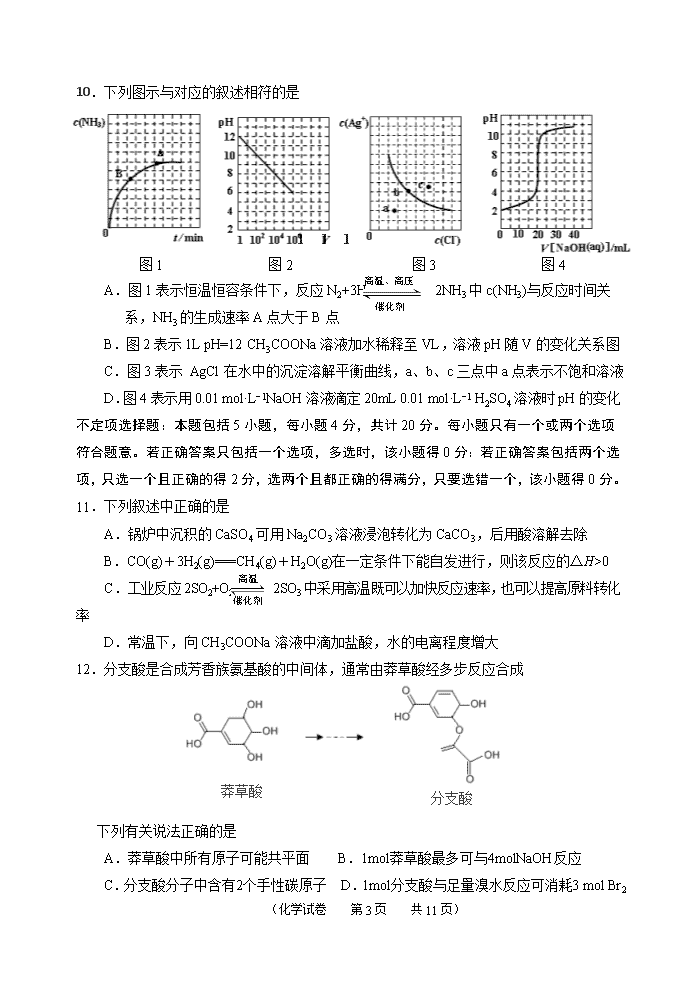
10.下列图示与对应的叙述相符的是
106
104
102
2
V
催化剂
高温、高压
图1 图2 图3 图4
A.图1表示恒温恒容条件下,反应N2+3H2 2NH3中c(NH3)与反应时间关系,NH3的生成速率A点大于B点
B.图2表示1L pH=12 CH3COONa溶液加水稀释至VL,溶液pH随V的变化关系图
C.图3表示 AgCl在水中的沉淀溶解平衡曲线,a、b、c三点中a点表示不饱和溶液
D.图4表示用0.01 mol·L−1NaOH溶液滴定20mL 0.01 mol·L−1 H2SO4溶液时pH的变化
不定项选择题:本题包括5小题,每小题4分,共计20分。每小题只有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题得0分:若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,只要选错一个,该小题得0分。
11.下列叙述中正确的是
A.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡转化为CaCO3,后用酸溶解去除
B.催化剂
高温
CO(g)+3H2(g)===CH4(g)+H2O(g)在一定条件下能自发进行,则该反应的ΔH>0
C.工业反应2SO2+O2 2SO3中采用高温既可以加快反应速率,也可以提高原料转化率
D.常温下,向CH3COONa溶液中滴加盐酸,水的电离程度增大
莽草酸
分支酸
12.分支酸是合成芳香族氨基酸的中间体,通常由莽草酸经多步反应合成
下列有关说法正确的是
A.莽草酸中所有原子可能共平面 B.1mol莽草酸最多可与4molNaOH反应
C.分支酸分子中含有2个手性碳原子 D.1mol分支酸与足量溴水反应可消耗3 mol Br2
(化学试卷 第11页 共11页)
13.下列根据实验操作和现象所得出的结论正确的是
选项
实验操作与现象
结论
A
将SO2气体通入酸性高锰酸钾溶液,高锰酸钾溶液褪色
SO2具有漂白性
B
常温下,测定等浓度的Na2CO3和Na2SO3的溶液的pH,前者pH比后者大
证明非金属性:
S>C
C
向盛有5mLAgNO3溶液的试管中滴入几滴等浓度的NaCl溶液,产生白色沉淀,继续滴加几滴NaI溶液有黄色沉淀产生
Ksp(AgCl) >Ksp(AgI)
D
向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解
部分Na2SO3被氧化
14.常温下,下列溶液中有关微粒的物质的量浓度关系正确的是
A.等物质的量浓度的MgSO4和(NH4)2SO4的混合溶液中:c(SO2− 4)> c(NH+ 4)> c(Mg2+) > c(H+)
B.向一定浓度Na2CO3溶液中通入少量CO2:c(Na+) =2[c(H2CO3) + c(HCO− 3) + c(CO2− 3)]
C.pH=11的氨水与pH=3的盐酸等体积混合,所得溶液中:c(Cl−)>c(NH+ 4)>c(H+)> c(OH−)
D.一元酸Ka(HA)=1.75×10-5,20mL 0.1 mol·L−1的HA与10mL 0.1 mol·L−1 NaOH混合溶液中:c(A−)+c(OH−) > c( HA) + c( H+)
15.一定温度下,在三个容积均为2L的恒容密闭容器中按不同方式投入反应物,发生反应:2CO(g) + 4H2(g) CH3OCH3(g) + H2O(g) △H﹤0,测得反应的相关数据如下表,
容器1
容器2
容器3
反应温度T/K
600
600
500
反应物投入量
0.2mol CO
0.4mol H2
0.4mol CO
0.8mol H2
0.2mol CH3OCH3
0.2mol H2O
平衡v(CO)/(mol·L-1·s-1)
v1
v2
v3
平衡n(H2)/(mol)
0.2
n2
n3
平衡体系总压强p/Pa
p1
p2
p3
物质的平衡转化率a
a1(CO)
a2(CO)
a3(CH3OCH3)
平衡常数K
K1
K2
K3
下列说法正确的是
A.v1﹤v2,n 2﹥0.4 B.K2=2.5×103,p2﹥p3
C.2p1﹤p3,a1(CO)﹥a2(CO) D.n3﹤0.4,a2(CO) + a3(CH3OCH3)﹤1
(化学试卷 第11页 共11页)
非选择题(80分)
16.(12分)高纯度碳酸锰是制备高性能磁性材料的主要原料。以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3、Al2O3等少量杂质)为主要原料制备MnCO3的工艺流程如下:
NaHCO3溶液
滤渣Ⅱ
软锰
矿浆
浸锰
稀H2SO4
过量SO2
过滤Ⅰ
滤渣Ⅰ
氧化
MnO2
1)调pH
2)过滤Ⅱ
沉锰
MnCO3
已知:SO2 + MnO2 = MnSO4
(1)“浸锰”时为提高浸取速率可采取的措施是 ▲ 。
(2)“滤渣I”的主要成分是 ▲ 。
(3)“氧化”时除了发生MnO2和SO2的反应外,还发生另一氧化还原反应,写出该
反应的离子方程式 ▲ ,HNO3也能将SO2氧化,用HNO3代替MnO2的缺点是 ▲ 。
(4)已知:Ksp[Al(OH)3]=1×10−33,Ksp[Fe(OH)3]=3×10−39,pH=7.1时Mn(OH)2开始沉
淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节
溶液pH范围为 ▲ 。
(5)“过滤II”后的滤液可经电解制取高纯度 MnO2,
原理如下图所示,阳极的电极反应式为 ▲ 。
(化学试卷 第11页 共11页)
17.(15分)以甲苯为原料合成有机物H的路线如下:
已知:
(1)C中含氧官能团名称为 ▲ 和 ▲ 。
(2)C→D 的反应类型为 ▲ 。
(3)有机物F的结构简式为 ▲ 。
(4)写出满足下列条件的E的任意一种同分异构体的结构简式 ▲ 。
Ⅰ 分子中含两个苯环,有5种不同化学环境的氢,苯环上的一元取代物只有两种;
Ⅱ 能与FeCl3溶液发生显色反应;
Ⅲ 能发生银镜反应。
(5)请写出以 为原料制备化合物 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。
18.(12分) PbO2是一种强氧化剂,在铅蓄电池中用作电极材料。由PbO为原料制备PbO2流程如下:
90℃
PbO
CH3COOH溶液
氧化
过滤
酸洗、水洗
PbO2
酸 浸
Ca(ClO)2溶液
NaOH溶液
煮沸
干燥
“氧化”反应原理:2Pb(CH3COO)2+ 4NaOH + Ca(ClO)2 = 2 PbO2↓+ 4CH3COONa +CaCl2 + 2H2O
(1)PbO2常温下即可与盐酸反应生成Pb2+、Cl2,若反应消耗2.39g PbO2,则被氧化的HCl物质的量为 ▲ 。
(化学试卷 第11页 共11页)
(2)“氧化”制得的PbO2可能含有的含铅杂质化学式是 ▲ 。
(3)PbO2的检验:向Mn(NO3)2的HNO3溶液中加入少量产品,搅拌并水浴微热,溶
液变紫红色,说明含有PbO2。该反应的离子方程式为 ▲ 。(PbO2被还原为Pb2+)
(4) 为测定产品(假定只含PbO2和PbO)中PbO2、PbO的物质的量之比,进行以下实验:
①取一定量待测产品,加入 200.00mL 0.2100 mol·L−1 的草酸溶液(过量),充分搅拌反应。然后用氨水调节溶液pH值至PbC2O4沉淀完全,过滤得PbC2O4质量为2.9500 g。
②上述滤液酸化后加水稀释至500.00mL,某同学取出100.00mL用0.1000mol·L−1KMnO4标准溶液滴定至终点,消耗标准溶液19.20mL.
计算产品中PbO2与PbO的物质的量之比(写出计算过程)
(已知:PbO2 + H2C2O4—PbC2O4↓+ CO2↑+ H2O,未配平
H+ +MnO− 4 + H2C2O4—CO2↑+ Mn2+ + 2H2O,未配平 )
19.(15分)利用废旧白铁皮(含Fe、Zn、Fe2O3、ZnO)制备磁性Fe3O4胶体流程如下:
白铁皮
NaOH溶液
过滤
部分氧化
溶液B
(含Fe2+、Fe3+)
Fe3O4胶体
碱 溶
溶液A(含ZnO2- 2)
稀H2SO4
适量NaClO3
NaHCO3
N2
已知:锌及其化合物的性质与铝及其化合物的性质具有一定的相似性。0
(1)碱溶时除了发生反应ZnO + 2NaOH = Na2ZnO2 + H2O以外,还发生的另一反应化学方程式为: ▲ 。
(2)向溶液A中滴加稀硫酸可制得Zn(OH)2固体,为防止Zn(OH)2溶解,可将稀H2SO4改为 ▲ 。
(3)过滤后的滤渣溶于稀硫酸后,要测定Fe2+、Fe3+的浓度并控制NaClO3加入量,其目的是 ▲ 。
(4)检验溶液B中是否含有Fe3+试剂为 ▲ 。
(5) 若实验制得的Fe3O4胶体中混有较多的Fe(OH)3,原因可能是 ▲ (填编号) a.稀硫酸加入过多 b. NaClO3加入过多 c. N2通入量偏少
(6)由溶液B也可制得绿矾(FeSO4·7H2O)。请结合右图
的绿矾溶解度曲线,补充完整由溶液B制备绿矾晶体的实验步骤:向溶液B中滴加NaOH溶液至沉淀不再增加, ▲ ,得到FeSO4溶液, ▲ ,得到FeSO4·7H2O晶体。
(可选用的试剂:铁粉、锌粉、稀盐酸、稀硫酸和NaOH溶液)
(化学试卷 第11页 共11页)
20.(14分)化石燃料燃烧时会产生SO2进入大气形成酸雨,有多种方法可用于SO2的脱除。
(1)已知SO2可参与如下热力学循环:
SO2 (g) + I2(s) + 2H2O(l)= 2HI(aq) + H2SO4(aq) △H1= -151kJ•mol-1
2HI(aq)=I2(s) + H2(g) △H2= +110kJ•mol-1
H2S(g) + H2SO4(aq)=S(s) + SO2 (g) + 2H2O(l) △H3= +61kJ•mol-1
反应H2S(g)= H2(g) + S(s)的△H= ▲ kJ•mol-1
(2)NaClO碱性溶液吸收法。工业上常用碱性NaClO废液吸收SO2,反应原理为:
ClO− + SO2 + 2OH− = Cl− + SO42− + H2O,为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和氧原子具有极强的氧化能力,可加快对SO2的吸收。该催化过程如下图所示:
a.过程1的离子方程式是Ni2O3 + ClO-=2NiO2 + Cl-,过程2的离子方程式为 ▲ 。
b.Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO 更好,原因是 ▲ 。
(3)Na2CO3溶液、氨水等碱性溶液吸收法。已知25℃时,含硫物种(即水溶液中H2SO3、HSO32−、SO32−)随pH变化如图−1所示,脱硫效率随pH变化如图−2所示。
① 当用Na2CO3溶液吸收SO2至溶液的pH为4时,发生反应的离子方程式是 ▲ 。
② 当用氨水吸收SO2至溶液的pH=7时,NH4+与溶液中存在的含硫物种之间的关系是
c(NH+ 4)= ▲ 。
③ 由实验测得氨水脱除SO2时,脱硫效率随pH的变化如图-2所示。在pH<5.5,pH较小时脱硫效率低的可能原因是 ▲ ;实际工艺中,吸收液的pH应控制在一定范围内,pH不宜过大的原因是 ▲ 。
21.(12分)乳酸亚铁(C3H5O3)2Fe是一种很好的补铁剂。可用以下方法制得
FeCO3+2C3H6O3===(C3H5O3)2Fe +CO2↑+H2O
乳酸的结构表示为:
(化学试卷 第11页 共11页)
(1)Fe2+基态核外电子排布式为: ▲ 。
(2)1mol乳酸中σ键数目为 ▲ 。
(3)乳酸分子中C原子的杂化类型为 ▲ 。
(4)与CO2− 3互为等电子体的一种分子化学式为 ▲ 。
(5) 某种铁氮化合物晶胞结构如右图所示,该铁氮化合物化学式为 ▲ 。
(6)乳酸比它的同分异构体碳酸二甲酯(CH3OCOOCH3)沸点高,除了因为乳酸是极性分子外,还因为 ▲ 。
化学试卷参考答案
选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
A
C
D
D
C
A
A
B
C
C
题号
11
12
13
14
15
答案
A
CD
D
AD
BD
16. (1)加热、搅拌等 (2)SiO2
(3) MnO2+2Fe2++4H+===Mn2+ +2Fe3++2H2O(2分)
产物中会有氮氧化合物污染环境(2分)
(4)5.0
相关文档
- 【化学】河北省张家口市宣化第一中2021-07-0819页
- 2018-2019学年河南省辉县市一中高2021-07-087页
- 安徽省滁州市明光市明光中学2019-22021-07-0810页
- 最新最全高考化学第一轮专题复习全2021-07-08220页
- 2020-2021年新高三化学开学摸底考2021-07-0820页
- 【化学】江苏省徐州市铜山区大许中2021-07-087页
- 2019-2020学年吉林省长春市实验中2021-07-086页
- 2019-2020学年辽宁省盘锦市第二高2021-07-085页
- 黑龙江省哈尔滨市第三中学校2019-22021-07-0810页
- 贵州省贵阳市第三十八中学2019-2022021-07-0818页