- 597.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
山东师大附中 2018 级化学学科 2020 年 11 月学业质量检测题
考生注意:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。考试时间90分钟。
2.请将各题答案填写在答题纸上。
可能用到的相对原子质量 Li:7 C:12 O :16 Na:23 S:32 Cl :35.5 Ni:59
第Ⅰ卷(选择题 共 40 分)
一、单项选择题(本题包括 10 个小题,每小题 2 分,共 20 分。)
1.化学与人们的生活、生产密切相关。下列说法正确的是( )
A.酒精和 84 消毒液混合使用能提高对新型冠状病毒的预防效果
B.纳米铁粉可以去除被污染水体中的 2+Cu 、 2+Hg 等重金属离子,其本质是纳米铁粉对重金属离
子较强的物理吸附
C.燃煤中加入 CaO 可以减少酸雨的形成,同时也可以减少温室气体的排放
D. 5G 时代某三维存储器能储存海量数据,其半导体衬底材料是单晶硅
2. 理论研究表明,在 101kPa 和 298K 下,HCN HNC 异构化反应过程的能量变化如图所示。
下列说法错误的是( )
A.HCN 比 HNC 稳定
B.该异构化反应的ΔH=-59.3 kJ·mol-1
C.使用催化剂,不能改变反应的反应热
D.升高温度,该反应正反应速率增大的程度大于逆反应速率增大的程度
3.下列有关实验操作或叙述错误的是( )
A.配制 5%氯化钠溶液时,将称量的氯化钠放入烧杯中,然后加计量的水搅拌溶解
2
B. 测定硫酸铜晶体的结晶水含量时,需用小火缓慢加热,防止晶体飞溅
C. 用硝酸银溶液滴定氯离子时,可用溴离子做指示剂
D. 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
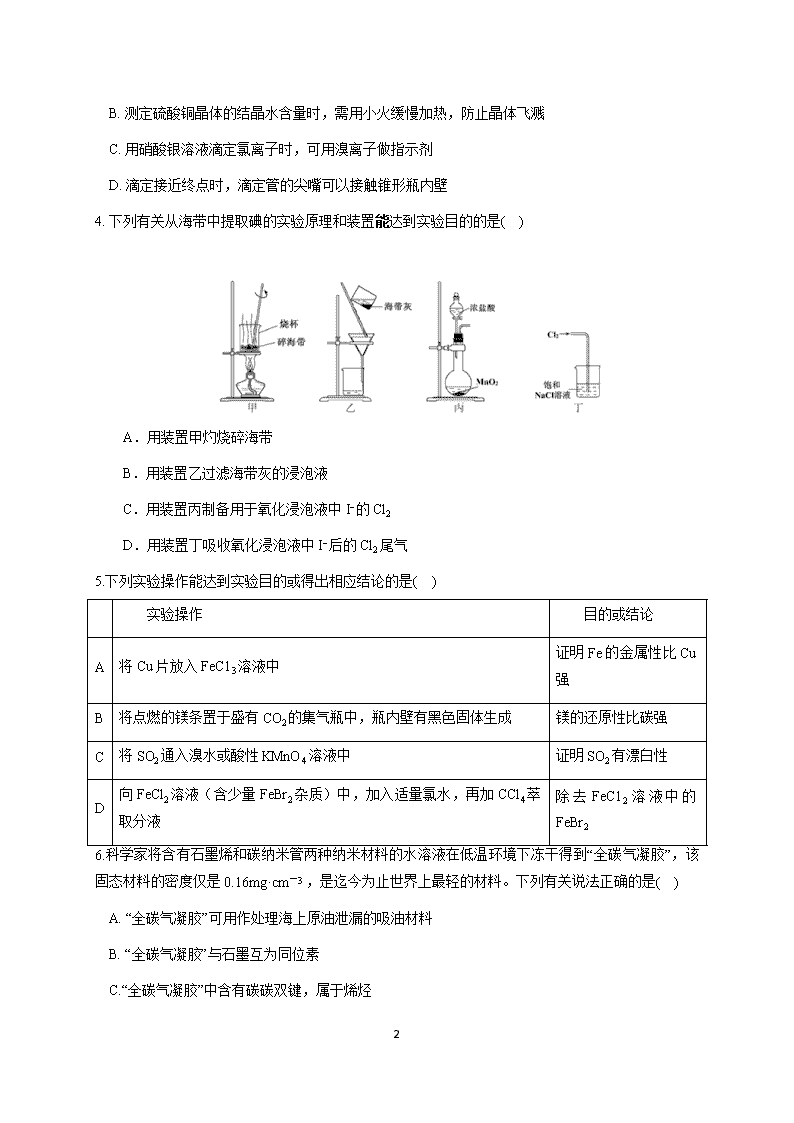
4. 下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( )
A.用装置甲灼烧碎海带
B.用装置乙过滤海带灰的浸泡液
C.用装置丙制备用于氧化浸泡液中 I−的 Cl2
D.用装置丁吸收氧化浸泡液中 I−后的 Cl2 尾气
5.下列实验操作能达到实验目的或得出相应结论的是( )
实验操作 目的或结论
A 将 Cu 片放入 FeC13 溶液中
证明 Fe 的金属性比 Cu
强
B 将点燃的镁条置于盛有 CO2 的集气瓶中,瓶内壁有黑色固体生成 镁的还原性比碳强
C 将 SO2 通入溴水或酸性 KMnO4 溶液中 证明 SO2 有漂白性
D
向 FeCl2 溶液(含少量 FeBr2 杂质)中,加入适量氯水,再加 CCl4 萃
取分液
除 去 FeC12 溶 液 中 的
FeBr2
6.科学家将含有石墨烯和碳纳米管两种纳米材料的水溶液在低温环境下冻干得到“全碳气凝胶”,该
固态材料的密度仅是 0.16mg·cm-3 ,是迄今为止世界上最轻的材料。下列有关说法正确的是( )
A. “全碳气凝胶”可用作处理海上原油泄漏的吸油材料
B. “全碳气凝胶”与石墨互为同位素
C.“全碳气凝胶”中含有碳碳双键,属于烯烃
3
D.“全碳气凝胶”的性质稳定,能在热的浓硫酸中稳定存在
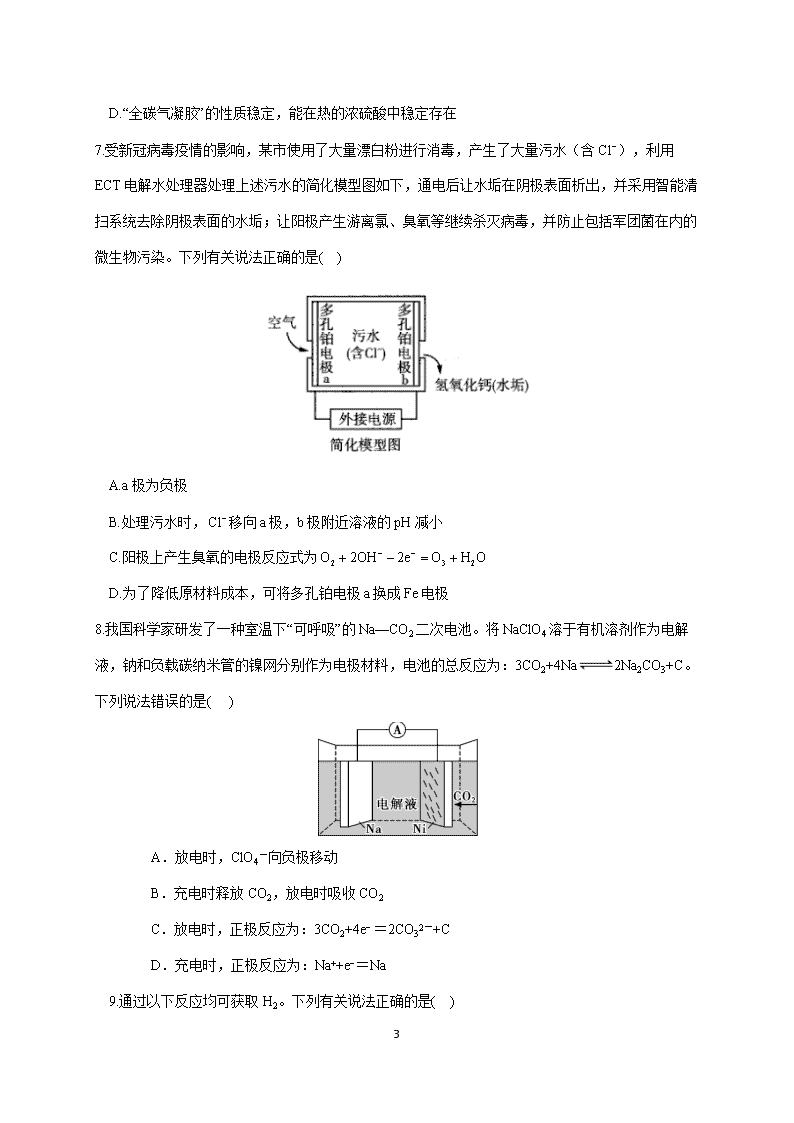
7.受新冠病毒疫情的影响,某市使用了大量漂白粉进行消毒,产生了大量污水(含 Cl ),利用
ECT 电解水处理器处理上述污水的简化模型图如下,通电后让水垢在阴极表面析出,并采用智能清
扫系统去除阴极表面的水垢;让阳极产生游离氯、臭氧等继续杀灭病毒,并防止包括军团菌在内的
微生物污染。下列有关说法正确的是( )
A.a 极为负极
B.处理污水时, Cl 移向 a 极,b 极附近溶液的 pH 减小
C.阳极上产生臭氧的电极反应式为 2 3 2O 2OH 2e O H O
D.为了降低原材料成本,可将多孔铂电极 a 换成 Fe 电极
8.我国科学家研发了一种室温下“可呼吸”的 Na—CO2 二次电池。将 NaClO4 溶于有机溶剂作为电解
液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na 2Na2CO3+C。
下列说法错误的是( )
A.放电时,ClO4
-向负极移动
B.充电时释放 CO2,放电时吸收 CO2
C.放电时,正极反应为:3CO2+4e− =2CO32-+C
D.充电时,正极反应为:Na++e−=Na
9.通过以下反应均可获取 H2。下列有关说法正确的是( )
4
①太阳光催化分解水制氢:2H2O(l)===2H2(g)+O2(g) ΔH1=571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+H2O(g)===CO(g)+H2(g) ΔH2=131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH3=206.1 kJ·mol-1
A.反应①中电能转化为化学能
B.反应 CH4(g)===C(s)+2H2(g)的ΔH=74.8 kJ·mol-1
C.反应③使用催化剂,ΔH3 减小
D.H2 的燃烧热为 571.6 kJ·mol-1
10.据文献报道:Fe(CO)5 催化某反应的一种反应机理如下图所示。下列叙述错误的是( )
A. OH-在反应中做催化剂 B. 该反应可产生清洁燃料 H2
C. 该反应属于氧化还原反应 D. 该催化循环中 Fe 的成键数目未发生变化
二、不定项选择题(本题包括 5 个小题,每小题 4 分,共 20 分。每小题有一个或两个正确选项。若
正确答案只包含一个选项,多选 0 分;若正确答案包含两个选项,只选一个且正确得 2 分,选两个
且都正确得 4 分,但只要选错一个就不得分)
11.若用 AG 表示溶液的酸度,AG 的定义为 AG=lg [H+]
[OH-]
室温下实验室中用 0.01 mol·L-1 的氢氧化
钠溶液滴定 20.00 mL 0.01 mol·L-1 醋酸,滴定过程如图所示,下列叙述正确的是( )
A.室温下,A 点的溶液显酸性
B.A 点时加入氢氧化钠溶液的体积小于 20.00 mL
C.室温下,AG=7 溶液的 pH=3.5
D.从 0 到 B,水的电离程度逐渐减小
12.垃圾分类意义重大,工业上回收光盘金属层中的 Ag 的流程如图所示,下列说法正确的是( )
5
A.氧化过程中参加反应的 Ag 和 NaClO 的物质的量比之为 1 : 1
B.为了提高氧化过程的反应速率和产率,氧化过程应该在酸性、加强热条件下进行
C.氧化过程中,可以用 3HNO 代替 NaClO 氧化 Ag
D.还原过程,若水合肼转化为无害气体 2N ,则还原过程的离子方程式为
2 4 2 2 24Ag N H H O 4OH 4Ag N 5H O
13.某课题组以铬铁矿粉[主要成分为 Fe(CrO2)2,还含有 Al2O3、SiO2 等杂质]为主要原料制备
Cr2O3,有关实验流程如图所示。
下列说法错误的是( )
A.“焙烧”时 Fe(CrO2)2 发生反应:4Fe(CrO2)2+8Na2CO3+7O2===2Fe2O3+8Na2CrO4+8CO2
B.过滤时需要的玻璃仪器有漏斗、烧杯、玻璃棒
C.图中“滤渣”成分是 Al(OH)3 和 H2SiO3
D.“反应Ⅲ”每消耗 32 g 硫黄,能产生 2 mol Cr(OH)3
14. 新能源汽车是国家战略产业的重要组成部分,LiFePO4 电池是新能源汽车关键部件之一,其工作
原理如图所示,电池工作时的总反应为 Li1-xFePO4+LixC6 LiFePO4+6C。
下列说法正确的是( )
A.充电时,电极 a 与电源正极连接,电极 b 与电源负极连接
B.电池充电时,正极的电极反应为 LiFePO4-xe-===Li1-xFePO4+xLi+
6
C.电池工作时,负极材料质量减少 0.7 g,转移 0.2 mol 电子
D.电池充电时锂离子穿过隔膜向 a 极移动
15.已知反应:CH2==CHCH3(g)+Cl2(g) CH2==CHCH2Cl(g)+HCl(g)。在一定压强下,按 w=
错误!向密闭容器中充入氯气与丙烯。图甲表示平衡时,丙烯的体积分数(φ)与温度(T)、w 的关系,
图乙表示正、逆反应的平衡常数与温度的关系,则下列说法错误的是( )
A.图甲中,w2>1
B.图乙中,A 线表示正反应的平衡常数
C.温度为 T1、w=2 时,Cl2 的平衡转化率为 50%
D.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将增大
第Ⅱ卷 (非选择题 共 60 分)
三、非选择题(5 个小题,共 60 分)
16.(14 分)亚氯酸钠(NaClO2)是一种重要的消毒剂和漂白剂,可以 ClO2 为原料制取。某化学兴趣
小组同学欲利用下列实验制取漂白剂亚氯酸钠(NaClO2),并进行纯度的测定。
已知:
①饱和 2NaClO 溶液析出晶体与温度的关系如下表所示。
温度 /℃ 38 38 60~ 60
晶体成分 2 2NaClO 3H O 2NaClO 2NaClO 分解生成 NaClO3 和 NaCl
②纯 ClO2 易分解爆炸,一般用稀有气体或空气稀释到 10%以下。
7
实验一、制备 2NaClO 晶体
(1)装置 C 的作用是 。
(2)装置 B 中反应生成 NaClO2 的化学方程式为 。
(3)装置 B 反应后的溶液中阴离子除了 ClO2-、ClO3-、Cl-、ClO-、OH-外还可能含有的一种阴离子
是 。
(4)从装置 B 反应后的溶液获得 NaClO2 晶体的操作步骤为:①减压,55℃蒸发结晶;② ;
③ ;④低于 60℃干燥,得到成品。(选择合适的操作编号填空)
A.冷却到室温后,过滤 B.趁热过滤 C.常温洗涤
D.冰水洗涤 E.38~60℃的温水洗涤
实验二、测定产品纯度
(5) 准确称取所得亚氯酸钠样品 m g 于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适
量的稀硫酸,充分反应,将所得混合液配成 250 mL 待测溶液。移取 25.00 mL 待测溶液于锥形瓶中,
加几滴淀粉溶液,用 c mol·L-1 Na2S2O3 标准溶液滴定至终点,重复 2 次,测得消耗 Na2S2O3 标准溶
液的平均值为 V mL。(已知:ClO2
-+4I-+4H+===2H2O+2I2+Cl-、I2+2S2O32-=2I-+S4O62-)
①达到滴定终点时的现象为 。
② 该样品中 NaClO2 的质量分数为 (用含 m、c、V 的代数式表示,结果化成最简)。
③若滴定前滴定管尖嘴有气泡,滴定终点时尖嘴气泡消失,则测得结果 (填“偏高”“偏低”或“无
影响”)。
17.(10 分)利用电化学原理,将 NO2、O2 和熔融 KNO3 制成燃料电池,模拟工业电解法来处理含
2
2 7Cr O 废水,如图所示。电解过程中溶液发生反应 2
2 7Cr O +6Fe2++14H+===2Cr3++6Fe3++7H2O。
8
(1)甲池工作时,NO2 转变成绿色硝化剂 Y,Y 是 N2O5,可循环使用。则石墨Ⅱ是电池的___极;石
墨Ⅰ附近发生的电极反应式为___________________________________。
(2)工作时,甲池内的 3NO 离子向________________极移动(填“石墨Ⅰ”或“石墨Ⅱ”);在相同条件下,
消耗的 O2 和 NO2 的体积比为__________________。
(3)乙池中 Fe(Ⅰ)棒上发生的电极反应为__________________。
(4)若溶液中减少了 0.01 mol 2
2 7Cr O ,则电路中至少转移了________________mol 电子。
18.(12 分)雷尼镍是有机合成中常用的一种加氢催化剂,使用一定周期后会失活。现欲利用如下
工艺流程回收某废雷尼镍催化剂(主要为铝镍合金,还含有 NiO、 2 3Al O 、FeO、 2SiO 及有机物等)
中的金属资源:
已知金属离子沉淀的 pH:
2+Ni 2+Fe 3+Fe 3+Al
开始沉淀的 pH 6.9 6.3 1.5 3.4
沉淀完全的 pH 8.9 8.3 2.8 4.7
回答下列问题:
(1)“破碎”的目的为 ;“滤渣 1”的成分为_______。
(2)“氧化”时发生反应的离子方程式为 。
(3)调节 2pH 的范围为 ;试剂 M 可选用 (填序号)。
a.FeO b. 2 3Fe O c. 2 3Al O d. NiO
(4)“沉降”后所得 3NiCO 沉淀在空气中热分解时,固体残留率(固体残留率= 100%剩余固体的质量
原始固体的质量 )
与温度 T 的关系如图所示(已知当 3NiCO 加热至 300 ℃ 时已完全失去碳元素)。
9
3NiCO 加热至 A 点过程中反应的化学方程式为 。
(5)该回收工艺中可回收的金属化合物有 3NiCO 、________________。
19.(12 分)1981 年 Staley、 Kappes 等科学家首次发现了过渡金属离子催化消除 2N O 与 CO 的第一
个催化循环反应,由此引起众多科学家开始关注利用金属离子消除大气污染物的催化反应。回答下
列问题:
(1)研究表明在无催化剂作用下 2N O 与 CO 难以反应,原因是 。
(2)过渡态理论认为 2N O 和 CO 之间的反应分为两个过程,首先 2N O 与 CO 通过碰撞生成高能量
的活化配合物,然后该活化配合物进一步转化为产物,其历程为:
第一步:N—N—O+C—O→N—N…O…C—O(慢反应)
活化配合物
第二步:N—N…O…C—O→N—N+O—C—O(快反应)
活化配合物
第一步反应为_____________________( 填“吸热”或“放热”)反应,
2 2 2CO(g) N O(g) CO (g) N (g) 的决速反应为_____(填“第一步”或“第二步”)反应。
(3)在 400 ℃ 和 650 ℃ 条件下,分别向两个相同体积的刚性容器中充入 2 mol 2N O 和 2 mol CO,
发生反应 2 2 2CO(g) N O(g) CO (g) N (g) H <0,实验得出两容器中 CO 与 2N 的物质的量随时间
的变化关系如图所示。已知气体的分压等于气体的总压乘以气体的体积分数,曲线 ad 对应的容器
中平衡后总压为 kPaxp ,曲线 bc 对应的容器中平衡后总压为 kPayp 。
①曲线 ad 表示_____(填“400 ℃”或“650 ℃”)条件下相关物质的物质的量的变化曲线。
②a、c、d 三点逆反应速率的大小顺序为____________。
③ad 段的平均反应速率 2N Ov __________________kPa·min-1。
10
④400 ℃ 条件下平衡常数 pK ________________。(保留分数)
20. (12 分)汽车尾气(用 N2O 表示)是空气污染源之一。回答下列问题:
(1)用 CO 还原 N2O 的能量变化如图甲所示,则该反应的
热化学方程式为 。
在相同温度和压强下,1 mol N2O 和 1 mol CO 经过相同反应时间测得如下实验数据:
实验 温度/℃ 催化剂 N2O 转化率/%
实验 1
400 催化剂 1 9.5
400 催化剂 2 10.6
实验 2
500 催化剂 1 12.3
500 催化剂 2 13.5
试分析在相同温度时,催化剂 2 催化下 N2O 的转化率更高的原因是_______________。
(2)在容积均为 1 L 的密闭容器 A(起始 500 ℃,恒温)、B(起始 500 ℃,绝热)两个容器中分别加
入 0.1 mol N2O、0.4 mol CO 和相同催化剂。实验测得 A、B 容器中 N2O 的转化率随时间的变化关
系如图乙所示。
乙
①B 容器中 N2O 的转化率随时间的变化关系是图乙中的________曲线。
11
②要缩短 b 曲线对应容器达到平衡的时间,但不改变 N2O 的平衡转化率,在催化剂一定的情况
下可采取的措施是________(答出 1 点即可)。
③500 ℃该反应的化学平衡常数 K=________(用分数表示)。
④实验测定该反应的反应速率 v 正=k 正·c(N2O)·c(CO),v 逆=k 逆·c(N2)·c(CO2),k 正、k 逆分别是正、
逆反应速率常数,c 为物质的量浓度。计算 M 处的v 正
v 逆
=_______(保留两位小数)。
12
山东师大附中 2018 级化学学科 2020 年 11 月学业质量检测题
答案及评分标准:1-10 每题 2 分;11-15 每题 4 分。
没加注明
的 每 空 2
分
16. ( 14
分)
(1)吸收尾气..2 分,防止污染环境。或吸收多余的 ClO2
(2)2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2
(3)SO42- (4)B (1 分) E (1 分)
(5)①滴入最后一滴 Na2S2O3 标准溶液时,溶液蓝色或浅蓝色退去..1 分 且半分钟颜色不恢复..1 分
② 22.625cV
m % 没化最简扣 1 分 ③偏高
解析:…(5)②由反应中的 I 元素守恒可知:ClO2-~2I2~4S2O32-,25.00mL 待测溶液中 n(NaClO2)
= 1
4
×cV×10-3mol,m(NaClO2)= 1
4
×90.5cV×10-3g;样品 m g 配成的 250mL 待测溶液中的 NaClO2 质
量扩大 10 倍,故样品中 NaClO2 的质量分数为 21 90.5 104 cV g
mg
×100%= 22.625cV
m
%。
17. (10 分)
(1)正 (1 分) NO2 + 3NO -e-=== N2O5(2 分)
(2) 石墨Ⅰ(1 分) 1∶4(2 分) (3) Fe � 2e - = Fe2+ (2 分) (4)0.12 (2 分)
18. (12 分)
(1)增大接触面积…1 分,提高反应速率,使废料煅烧充分或充分反应..1 分; 2SiO (1 分)
(2) 2 3
22Fe ClO 2H 2Fe Cl H O
(3)4.7≤pH<6.9 或 [4.7,6. 9)写 4.7~6.9 得 1 分; c(1 分)
(4) 3 2 2 3 24NiCO O 2Ni O 4CO @ 不写条件本次不扣分
(5) 3Fe(OH) 和 3Al(OH) 各 1 分,写名称也可
解析:…(3)“调节 2pH ”是为了沉淀 3Al(OH) ,且不能引起 2+Ni 的沉淀,所以需要调节的范围为
4.7≤pH<6.9;加入试剂 M 是为了沉淀 3+Fe ,而不引起 3+Al 的沉淀,可选用 2 3Al O ;除 3+Fe 不能选用
2 3Fe O ,加入 NiO 调节 pH 会造成 3+Al 沉淀,故也不能选用 NiO。
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
D B C B B A C D B D BC A D BD BC
13
(4)①由题可知,当 3NiCO 加热至 300 ℃ 时已完全失去碳元素,所以反应生成镍的氧化物,根据
元素守恒:
3NiCO ~ NiOx
119 59 16x
由题图 A 点数据可知119 69.7% 59 16x , 1.5x ,故所得产物为 2 3Ni O ,发生反应的化学方程
式为 3 2 2 3 24NiCO O 2Ni O 4CO @ 。
19. (12 分)
(1)CO 中存在碳氧三键,键能较大,反应物的活化能较高,反应难以进行(2 分)
反应物的活化能较高可得 2 分只答键能较大 得 1 分
(2)吸热(1 分);第一步(1 分)
(3)①400 ℃…漏“℃”不得分(2 分)②c>d>a(2 分)③ 0.015 xp …漏 x 不得分(2 分);④ 9
4
(2 分)或写 2.25
解析:…③ad 段时间变化量为 10 min,根据三段式法,可以得出:
2 2 2CO(g) N O(g) CO (g) N (g)
初始量(mol) 2 2 0 0
5 min 时(mol) 1.4 1.4 0.6 0.6
15 min 时(mol)0.8 0.8 1.2 1.2
ad 段的平均反应速率 2N Ov 0.015 xp kPa·min-1。
④根据题意,400 ℃ 条件对应曲线 ad,15 min 时曲线 ad 达到平衡状态,则根据③中三段式可以得
出 p
1.2 1.2 9
0.8 0.8 4K
。
20.(12 分)(1)N2O(g)+CO(g) N2(g)+CO2(g) ΔH=-362.8 kJ·mol-1
数据表明反应未达到平衡,在催化剂 2 催化下,反应的活化能更低,反应速率快 1 分,经过相
同反应时间,N2O 的转化率更高 或产量更高 1 分
(2) ①a ②缩小容器容积 或加压 或同比充入反应物或使用更高效的催化剂
③ 1
45
④1.69…其他数值均不得分。