- 1.07 MB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
1
课题 2 海水的综合利用
第 2 课时
教学目标
1.海水提溴吹出法原理,流程
2.海水提镁的流程,
3.海水中提取重水的意义和方法
教学重点
1.海水提溴吹出法原理,流程
2.海水提镁的流程,
教学方法
展示图片法
教学用具
海水提镁、提溴的图片
教学过程
引入新课:浩瀚的海洋是个巨大的宝库,不仅可以提供给我们丰富的食物、食盐、也是化工生产中重
要的资源来源。我们已经知道它是氯碱工业的来源,那么,还有那些行业需要从海洋中获得资源呢?
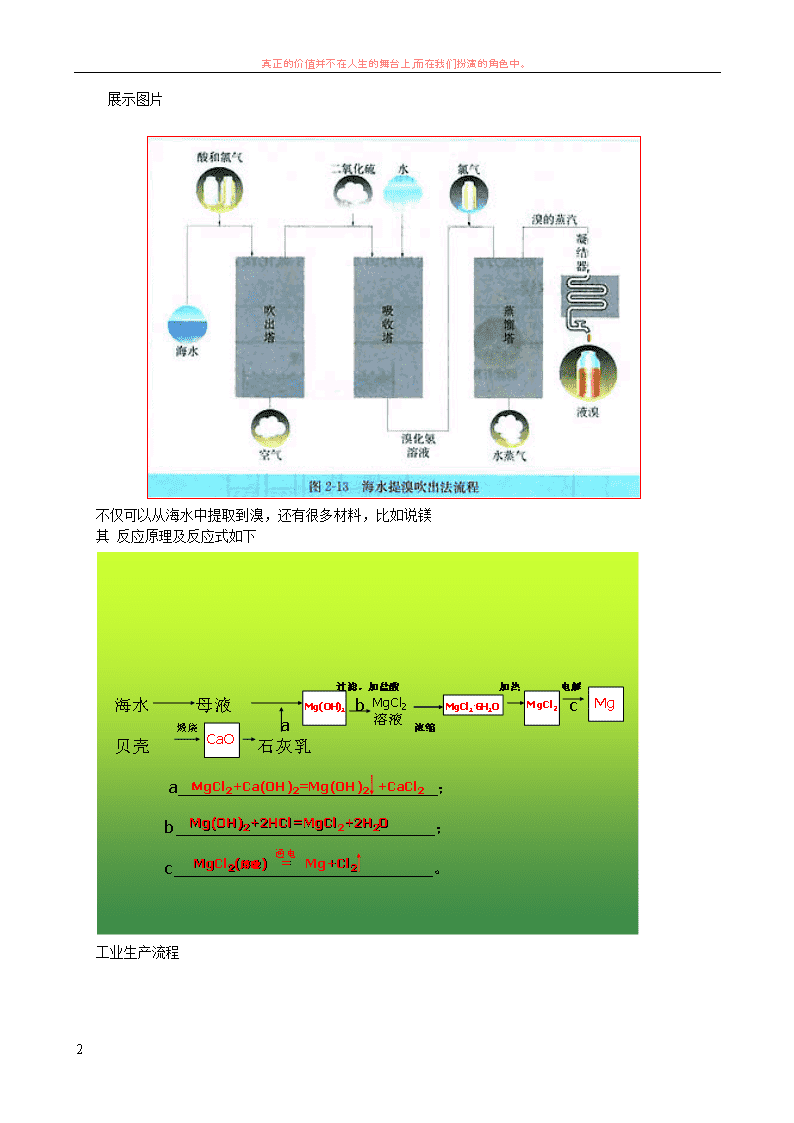
新课教学:板书:海水提溴
目前,从海洋种提取的溴约占世界溴产量的三分之一。常用的海水提溴的方法叫做吹出法。下面我们
看一下它的反应原理
1、氧化
工业上从海水中提取溴时,首先通氯气于 pH 为 3.5 左右晒盐后留下苦卤(富含 Br-离子)中置换出
Br2。
Cl2 +2Br - =Br2+ 2Cl -
2、吹出
然后用空气把 Br2 吹出,再用 Na2C03 溶液吸收,即得较浓的 NaBr 和 NaBrO3 溶液:
3CO3
2- + 3Br2 = 5Br- + BrO3
3- + 3CO2↑
最后,用硫酸将溶液酸化,Br2 即从溶液中游离出来:
5Br- + BrO3
3- + 6H+ = 3Br2 + 3H2O
3、吸收
用还原剂二氧化硫使溴单质变为 HBr,再用氯气将其氧化成溴产品。
Br2 + SO2 +2H2O =2HBr+H2SO4
Cl2 +2Br - =Br2+ 2Cl -
工业生产种它的工艺流程有时怎样的呢?
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
2
展示图片
不仅可以从海水中提取到溴,还有很多材料,比如说镁
其 反应原理及反应式如下
工业生产流程
真正的价值并不在人生的舞台上,而在我们扮演的角色中。
3
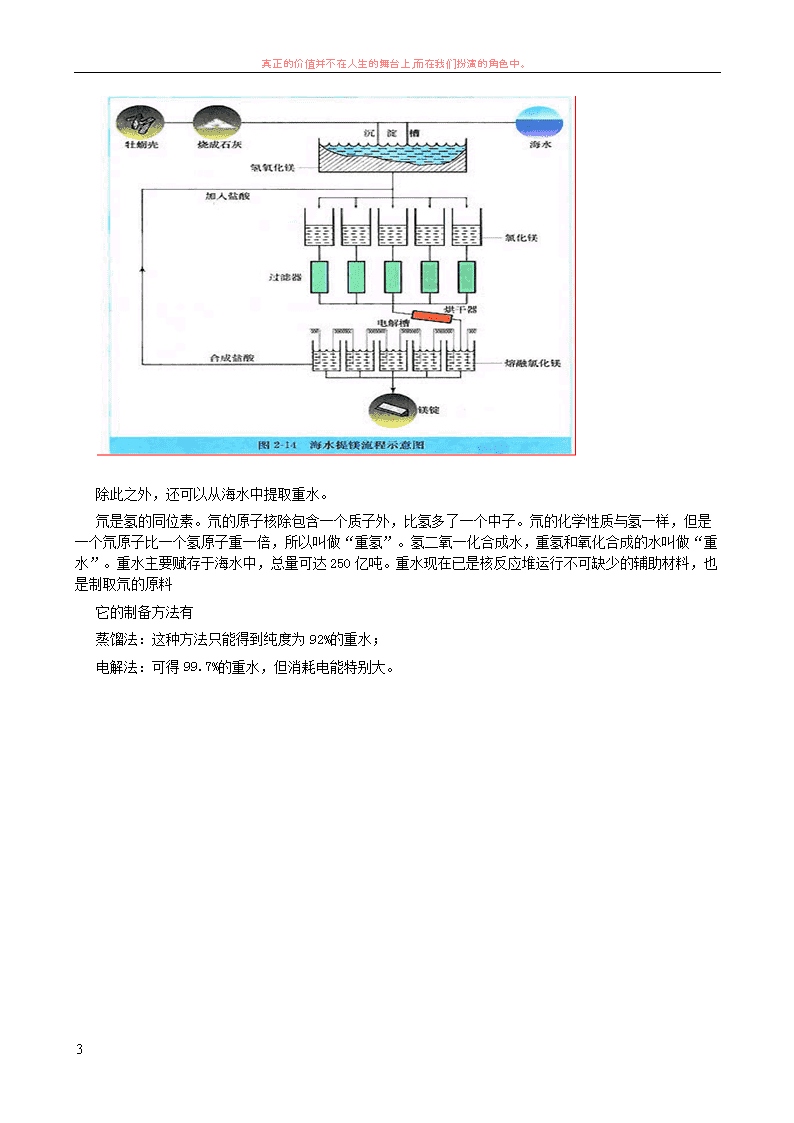
除此之外,还可以从海水中提取重水。
氘是氢的同位素。氘的原子核除包含一个质子外,比氢多了一个中子。氘的化学性质与氢一样,但是
一个氘原子比一个氢原子重一倍,所以叫做“重氢”。氢二氧一化合成水,重氢和氧化合成的水叫做“重
水”。重水主要赋存于海水中,总量可达 250 亿吨。重水现在已是核反应堆运行不可缺少的辅助材料,也
是制取氘的原料
它的制备方法有
蒸馏法:这种方法只能得到纯度为 92%的重水;
电解法:可得 99.7%的重水,但消耗电能特别大。
相关文档
- 2019-2020学年新教材高中化学课后2021-07-088页
- 2020高中化学第二章烃和卤代烃第三2021-07-089页
- 2020_2021学年新教材高中化学第2章2021-07-088页
- 高中化学第五章化工生产中的重要非2021-07-085页
- 高中化学:1-4-1《研究有机化合物的2021-07-0812页
- 2020版高中化学课时作业1元素周期2021-07-086页
- 2019-2020学年高中化学课时作业3核2021-07-087页
- 2020版高中化学课时作业5元素周期2021-07-085页
- 2020_2021学年新教材高中化学第一2021-07-087页
- 高中化学第一章原子结构元素周期律2021-07-0810页