- 331.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
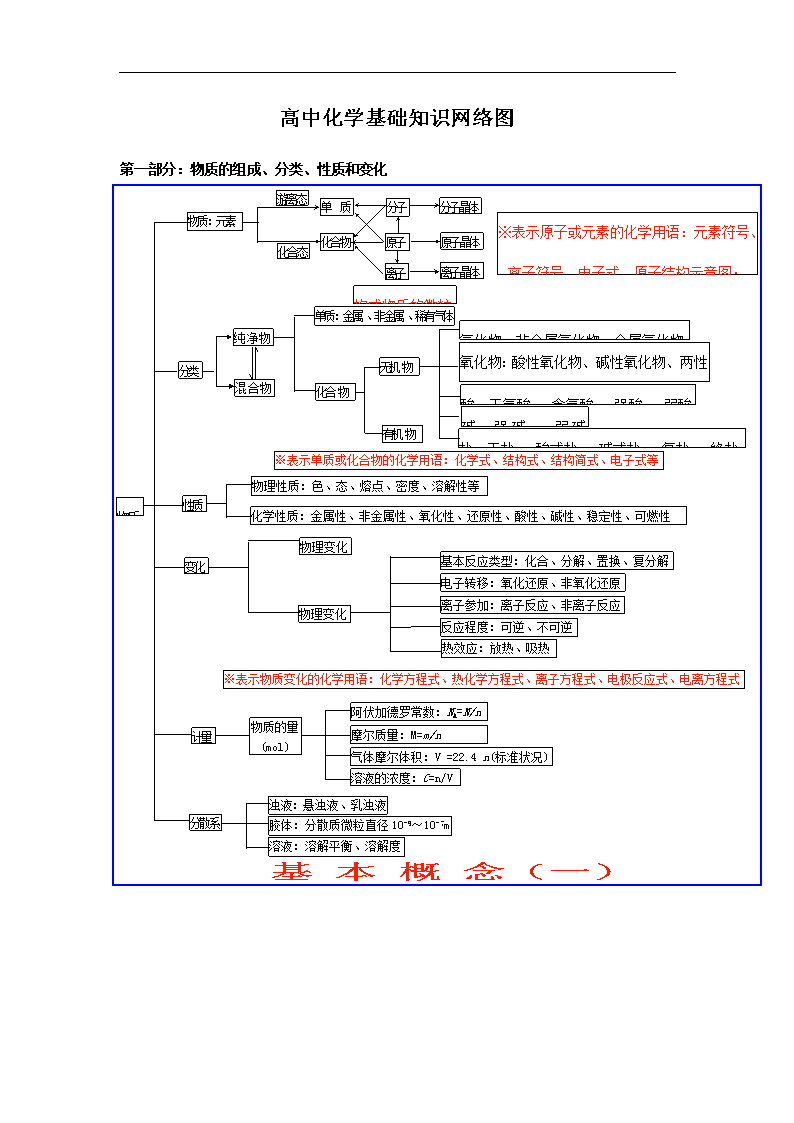
高中化学基础知识网络图
第一部分:物质的组成、分类、性质和变化
物质
性质
物质:元素
游离态
化合态
单 质
化合物
分子晶体
原子晶体
离子晶体
离子
分子
原子
构成物质的微粒
※表示原子或元素的化学用语:元素符号、
离子符号、电子式、原子结构示意图;
相对原子质量、相对分子质量
分类
单质:金属 、非金属 、稀有气体
混 合 物
纯 净 物
无机 物
化合 物
有机 物
氢化物:非金属氢化物、金属氢化物
氧化物:酸性氧化物、碱性氧化物、两性
氧化物、不成盐氧化物、过氧化物
酸:无氧酸 、含氧酸 、强酸 、弱酸
碱:强碱 、弱碱
盐:正盐 、酸式盐 、碱式盐 、复盐 、络盐
※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等
物理性质:色、态、熔点、密度、溶解性等
化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性
物理变化
变化
物理变化
基本反应类型:化合、分解、置换、复分解
离子参加:离子反应、非离子反应
电子转移:氧化还原、非氧化还原
反应程度:可逆、不可逆
热效应:放热、吸热
※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式
计量
物质的量
(mol)
气体摩尔体积:V =22.4 n(标准状况)
摩尔质量:M=m/n
溶液的浓度:C=n/V
阿伏加德罗常数:NA=N/n
分散系
浊液:悬浊液、乳浊液
胶体:分散质微粒直径10-9~10-7m
溶液:溶解平衡、溶解度
基 本 概 念(一)
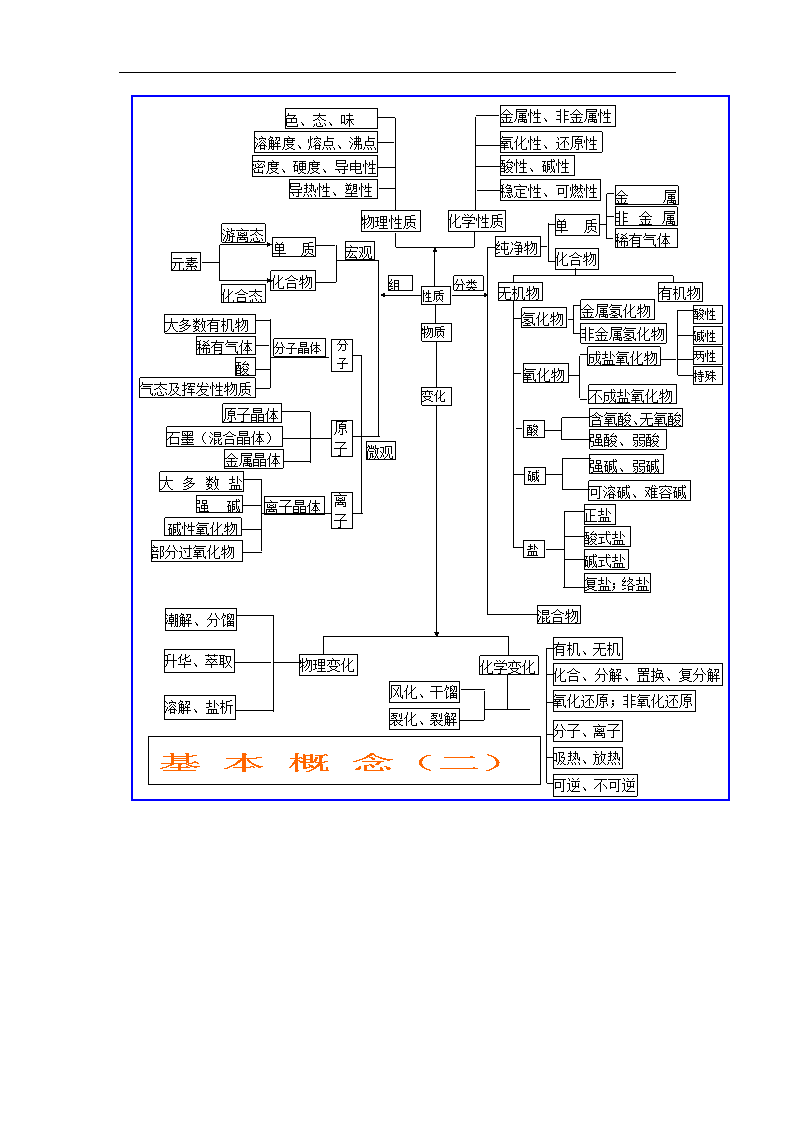
组成
物质
氧化物
基 本 概 念(二)
性质
变化
分类
色、态、味
溶解度、熔点、沸点
密度、硬度、导电性
导热性、塑性
强碱
化学性质
金属
酸
非金属
纯净物
稳定性、可燃性
化合物
元素
大多数有机物
无机物
物理性质
酸性、碱性
氧化性、还原性
金属性、非金属性
单质
化合物
宏观
物理变化
游离态
化合态
酸性
大多数盐
气态及挥发性物质
微观
稀有气体
分子晶体
分 子
原 子
原子晶体
金属晶体
石墨(混合晶体)
碱性氧化物
部分过氧化物
离子晶体
离 子
稀有气体
单质
有机物
氢化物
金属氢化物
强碱、弱碱
含氧酸、无氧酸
强酸、弱酸
非金属氢化物
成盐氧化物
不成盐氧化物
碱性
两性
特殊
酸
正盐
碱
可溶碱、难容碱
盐
酸式盐
碱式盐
复盐;络盐
混合物
化学变化
潮解、分馏
升华、萃取
溶解、盐析
裂化、裂解
有机、无机
吸热、放热
化合、分解、置换、复分解
氧化还原;非氧化还原
分子、离子
可逆、不可逆
风化、干馏
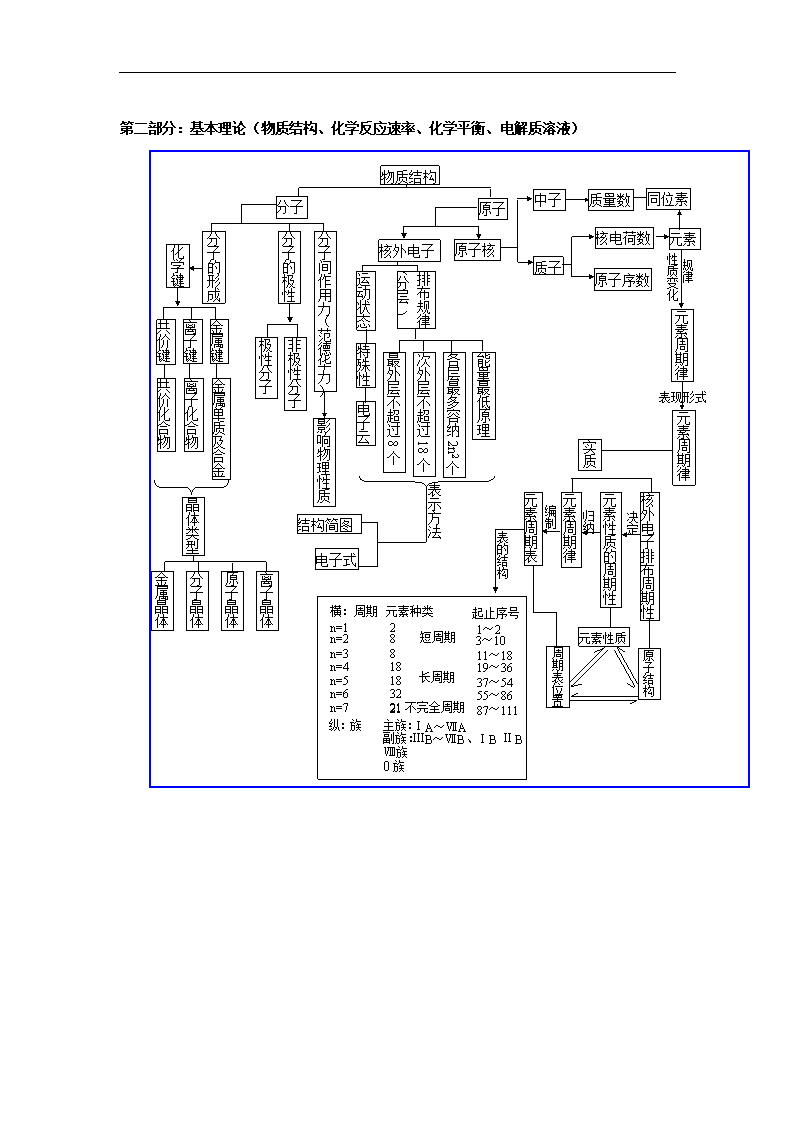
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)
元素
质子
同位素
中子
分子
物质结构
原子
原子核
核外电子
分子的极性
质量数
分子的形成
原子序数
核电荷数
分子间作用力(范德华力)
离子化合物
离子键
共价键
金属键
极性分子
非极性分子
化学键
影响物理性质
共价化合物
金属单质及合金
运动状态
排布规律(分层 )
特殊性
电子云
元素性质的周期性
最外层不超过8个
次外层不超过18个
各层最多容纳2n2个
能量最低原理
性质变化
规律
元素周期律
元素周期律
表现形式
元素周期律
核外电子排布周期性
晶体类型
金属晶体
分子晶体
原子晶体
离子晶体
表示方法
结构简图
电子式
元素周期表
实质
决定
横:周期
周期表位置
原子结构
元素性质
归纳
编制
表的结构
起止序号
n=1
n=2
n=3
n=6
n=4
n=5
n=7
2
主族:
副族:
元素种类
纵:族
1~2
18
8
3~10
8
11~18
19~36
37~54
18
ⅢB~ⅦB、ⅠB ⅡB
32
55~86
21
87~111
短周期
长周期
不完全周期
21
ⅠA~ⅦA
Ⅷ族
0族
类型
比较
离子晶体
原子晶体
分子晶体
构成晶体微粒
阴、阳离子
原子
分子
形成晶体作用力
离子键
共价键
范德华力
物理性质
熔沸点
较高
很高
低
硬度
.导电
.
熔融
水溶液
硬而脆
大
小
导电性
不良
绝缘体(半导体)
不良
传热性
不良
不良
不良
延展性
不良
不良
不良
溶解性
易溶于极性溶剂
不溶于任何溶剂
相似相溶
典型实例
NaCl,KBr
单质:金刚石、SiC、Si、SiO2
单质:H2、O2
化合物:冰、干冰
化学平衡、化学
反应速率
化学反应速率和化学平衡
化学反应
合成氨适于条件的选择
化学反应速率
化学平衡
特点
表示方法 :vA=△cA/△t单位:mol/L·s(min或h )
计算
影响因素
是平均速率,均取正值
同一反应选用不同的物质表示速率,数值可能不同
各物质表示的速率比 等于该反应方程式的系数比
内因(主)
外因(辅)
反应物的结构、性质
浓度
压强
温度
催化剂
其他条件 光、超声
波、激光、放射线…
应用
可逆反应
化学平衡建立的条
件:v正=v逆≠0
化学平衡的特征
(平衡标志的判断)
影响化学平衡因素
各成分百分含量保持不变
动态平衡
条件改变,平衡状态改变
定
等
动
变
浓度
压强
平衡移动原理
(勒沙特列原理)
温度
v正=v逆≠0
化合物
非电解质
电解质溶液
电解质
强电解质(完全电离 )AB A-+B-
弱电解质
(部分电离)
电离平衡AB A-+B-
水的电离平衡H2O H++OH-
电离度的定义
电离度平衡的移动
已电离的弱电解质分子数
(电离度α=
×100%)
弱电解质的分子总数
水的离子积KW=1×10-14(25℃)
溶液的酸碱性:PH=-log[H+]
盐类的水解
实质
类型
规律(酸碱性性判断)
影响因素
离子反应
发生条件
表示方式-离子方程式
常见类型
非氧化还原
氧化还原
复分解反应
水解反应
络合反应
置换反应
溶液中氧化还原反应
电镀
原理
能的转换:化学能与电
化学能
电能
原电池
电解池
应用
电源
蓄电池
干电池
高能电池
原理
应用
氯碱工业(电解饱和食盐水)
电冶炼金属(冶炼铝)
电解精练(精练铜)
装置
装置
比较
原电池
电解池
能量转换
(实质)
化学能→电能
(两极分别发生氧化还原反应产生电流)
电能→化学能
(在电流作用下两极分别发生氧化还原反应)
装置特点
外电路无电源;两极为活泼性不同
(或其中之一为能导电的非金属)的金属
外电路必须有直流电源;两极材料均
能导电即可
电极名称
负极(-)——较活泼
e
正极(+)较不活泼
阴极——连接电源负极
e
e
阳极——连接电源正极
电子流向
氧化
负极(-)→正极(+)
还原
还原
电源负极→阴极 电源正极→阳极
电极反应
负极:M-ne→Mn+活泼金属失去电子
还原
被氧化、被溶解、被腐蚀。
还原
正极:2H++2e→H2↑(酸性电解质溶液)
或M n++ne→M(不活泼金属的盐溶液)
H2O+O2+4e→4OH-(中性、弱酸性
条件下的吸氧腐蚀)
氧化
阴极:2H++2e→H2↑或M n++ne→M
惰性电极(石墨或铂)Rn--ne→R
(例2Cl-—2e Cl2↑)
或4OH-—4e H2O+O2↑
氧化
金属电极做阳极,电极本身被氧化
M-ne→Mn+
Mg3N2
MgO
Mg(OH)2
MgX2
Cl2
CO2
H2O
X2
Mg
MgO
Mg(OH)2
MgCO3
△
MgCl2
H2O
H2O
N2
HCl
NaOH
HCl
电解
Mg(HCO3)2
煅烧
O2
HCl
H2O
CO2
△
或
OH-
HCl
Na2S
Na2O
NaOH
NaCl
Na2CO3
Na2O2
Na
C2H5ONa
NaCl
CH3COONa
NaHCO3
Na2CO3
CO2+H2O
Ca
CaO
Ca(OH)2
CaHPO4
△
CaCl2
CaCO3
CaC2
C(电炉)
CaHCO3
O2
H2O
H3PO4
HCl
HCl
HCl
CO2
H2O
Ca(ClO)2
H2O
HCl
Cl2或
CO2
Al2O3
Al
Al(OH)3
NaAl O2
AlCl3(Al3+)
H2O(沸腾)
电解
O2
HCl
NaOH
NaOH
CO2
或HCl
NaOH
NaOH
HCl
HCl
HCl
NaOH
稀
Fe
FeO
FeCl3
Fe(OH)2
FeS
Fe2O3
Fe3O4
FeCl2
Fe(OH)3
FeSO4
Fe2(SO4)3
Fe(SCN)3
Fe(SCN)3
S
HCl
H2SO4
O2
CO
等
HCl
Cl2
Fe
KSCN
KSCN
Na2S
H2SO4
Cl2、HNO3
浓
O2和H2O
NaOH
HCl
NaOH
H2SO4
H2SO4
CO
O2
O2
Na2S
HCl
Cu
CuO
Cu(OH)2
Cu2+(NO3-、SO42-)
Cu2S
NH3H2O
[Cu(NH3)4]2+
CuS
Cu2O
Na2S
S
H+
HNO3或H2SO4(浓)
NaOH
O2
CO、Al、H2
△
H+
金属部分:
按照单质 氧化物 氢氧化物 盐为线索进行搜罗寻找关系
第三部分:元素化合物转化关系
P
P2O5
PCl3
PCl5
HPO3
H3PO4
Na3PO4
Ca3(PO4)2
Ca (H2PO4)2
CaHPO4
Si
C
SiO2
H2SiO3
CaSiO3
H4SiO4
Na2SiO3
SiH4
SiF4
SiCl4
CO2
CO
H2CO3
Ca(HCO3) 2
CaCO3
CaC2
CaO
Ca(OH)2
FeS2
S
H2S
Na2S
SO2
Na2SO3
FeS
SO3
Na2SO4
BaSO4
PbS
CuS
BaSO3
H2SO3
H2SO4
Mg3N2
N2
NO
NO2
N2O4
NH4Cl
NH3
NaNO3
HNO3
Cu(NO3)2
[Ag (NH3)2]+
NH3·H2O
NO2
(C6H7O2)
NO2
NO2
NO2
n
或
H2
H2O
O2
CH3COOH
CH3CH2OH
KMnO4
HgO
KClO3
Na2O2
H2SO4
CH4
Zn
NH4Cl
NH3
Cu
Ca(OH)2
Fe3O4
SO2
CO2+H2O
Cl2
HCl
CH3Cl
Ca(ClO)2
FeCl3
CuCl2
PCl3、PCl5
NaClO
HClO
Cl
CH2ClCH2Cl
O2
FeCl2
CO2l
NaCll
CuCl2
H2
CH2=CHCl
HBr
NaBr
AgBr
HI
NaI
AgI
Br2
I2
非金属:按照化合价寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐
第四部分:有机化学
有机抓住
官能团的性质
烃
烃的衍生物
糖
蛋白质:多肽、氨基酸(官能团:—NH2和—COOH)
高分子化合物
链烃
(脂肪烃)
环烃
饱和链烃
烷烃:CnH2n+2(n≥1)R—CH3
不饱和链烃
烯烃:CnH2n (n≥2) R—CH=CH2
二烯烃:CnH2n-2(n≥4)R—CH=CH—CH=CH2
炔烃:CnH2n-2(n≥2) R—C≡CH
环烷烃CnH2n (n≥3)
芳香烃(苯和苯的同系物)CnH2n-6(n≥6)
天然高分子:橡胶(聚异戊二烯)、多糖、蛋白质
R
卤代烃(官能团:—X):饱和一卤代烃CnH2n+1X(n≥1)R—X
醇 (官能团:—OH):饱和一元醇CnH2n+1OH(n≥1)R —OH
醚 CnH2n+2O (n≥2)R —O—R
酚(苯酚)(官能团:—OH)CnH2n-6O (n≥2)
OH
羧酸 (官能团:—COOH):饱和一元羧酸 CnH2n+1O2 (n≥1)R —COOH
醛 (官能团:—CHO)CnH2nO (n≥1)R—CHO
酮 (官能团:—CO—)CnH2nO (n≥3)R—CO—R’
酯 (官能团:—COO—R):饱和一元羧酸和饱和一元醇形成的酯 CnH2nO2 (n≥2)R —COOR’
硝基化合物(官能团—NO2)R—NO2
胺(官能团—NH2)R—NH2
单糖:葡萄糖、果糖C6H12O6(互为同分异构)
二糖:蔗糖、麦芽糖C12H22O11(互为同分异构)
多糖:淀粉、纤维素(C6H12O6)n (n值不同)
合成高分子
合成塑料
合成橡胶
合成纤维
有机化合物