- 570.00 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
湖北省部分重点中学2021届高三上学期10月联考
化学试卷
可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Si:28 K:39 Fe:56
第I卷
一、选择题(本题共10小题,每小题2分,共20分。每小题只有一个正确答案。)
1.明代宋应星所著的《天工开物》被誉为“17世纪中国工艺百科全书”。下列说法错误的是( )
A.“凡铁分生熟,出炉未炒则生,既炒则熟”中的“炒”为氧化除碳过程
B.“凡石灰经火焚,火力到后,烧酥石性,置于风中久自吹化成粉”中的“粉”为CaCO3
C.“纷纷灿烂如星陨,㸌㸌喧豗似火攻”描述了钠、铁等金属的焰色反应
D.汉代烧制的“明如镜、声如磬”的瓷器,其主要原料为黏土
2.化学与生活密切相关,下列说法正确的是( )
A.利用酒精的强氧化性可以灭活新型冠状病毒
B.CO、甲醛、放射性元素氡(Rn)都是室内空气污染物
C.酿酒过程中葡萄糖在酒化酶的作用下发生水解反应生成乙醇
D.N95口罩的原材料聚丙烯是一种天然有机高分子化合物
3.有关下列实验操作中说法正确的是( )
A.萃取操作中倒转分液漏斗用力振荡时,应关闭玻璃塞和活塞
B.蒸馏时若选择球形冷凝管,冷凝效果更好
C.渗析使用的半透膜是一种离子交换膜
D.可用pH试纸测定NaClO溶液的pH
4.设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.2 L 0.1 mol·L-1 Na2SiO3溶液中含SiO32-的数目为0. 2 NA
B.反应3Si(NH)2 Si3N4+N2↑+3H2↑,每生成1 mol N2,转移的电子数为6 NA
C.8.8 g乙酸乙酯在稀硫酸的作用下充分水解,生成的乙醇的分子数为0.1 NA
D.用C将6.0 g SiO2完全还原为单质Si,生成的CO2的分子数为0. 1 NA
5.科学家合成的一种纳米小人结构如下图所示。下列关于该化合物的说法正确的是( )
A.易溶于水
B.一氯代物有14种(不考虑空间异构)
C.所有原子处于同一平面
D.1 mol该物质最多可与16 mol H2发生加成反应
6.我国拥有自主知识产权的铷(Rb)原子钟,每3000万年误差仅1秒。Rb是第五周期第ⅠA族元素,下列关于37Rb的说法不正确的是
A.中子数为50的Rb的核素:Rb B.元素金属性:Rb>K
C.与同周期元素53I的原子半径比:I < Rb D.最高价氧化物对应的水化物的碱性:KOH < RbOH
7.已知由一种阳离子与两种酸根阴离子组成的盐称为混盐。向混盐CaOCl2中加入足量浓硫酸,发生反应:CaOCl2+H2SO4(浓)== CaSO4+Cl2↑+H2O。下列说法不正确的是( )
A.CaOCl2中的两种酸根阴离子分别为Cl-和ClO-
B.CaOCl2中不含非极性共价键
C.在上述反应中,浓硫酸不体现氧化性
D.每产生2.24 L Cl2,转移电子的数目约为6.02×1022
8.全氮类物质具有高密度、超高能量及爆炸产物无污染等优点,被称为没有核污染的“N2爆弹”。中国科学家胡炳成教授团队近日成功合成全氮阴离子N5-,N5-是制备全氮类物质N10(其中含有和N5-两种离子)的重要中间体。下列说法中正确的是( )
A.全氮类物质不属于绿色能源 B.每个N5+中含有5个原子核
C.每N5-中含有35个电子 D.N10结构中只含非极性共价键
9.短周期主族元素W、X、Y、Z的原子序数依次增大,湿润的红色石蕊试纸遇W的气态氢化物变蓝色。含X、Y和Z三种元素的化合物R有如下转化关系(已知酸性强弱:HClO3 > HNO3)。下列说法正确的是( )
A.简单离子半径:Y > Z > W > X
B.加热单质甲与品红溶液反应所得的“无色溶液”,可变成红色溶液
C.简单气态氢化物的热稳定性:X > W
D.常温下,向蒸馏水中加入少量R,水的电离程度可能减小
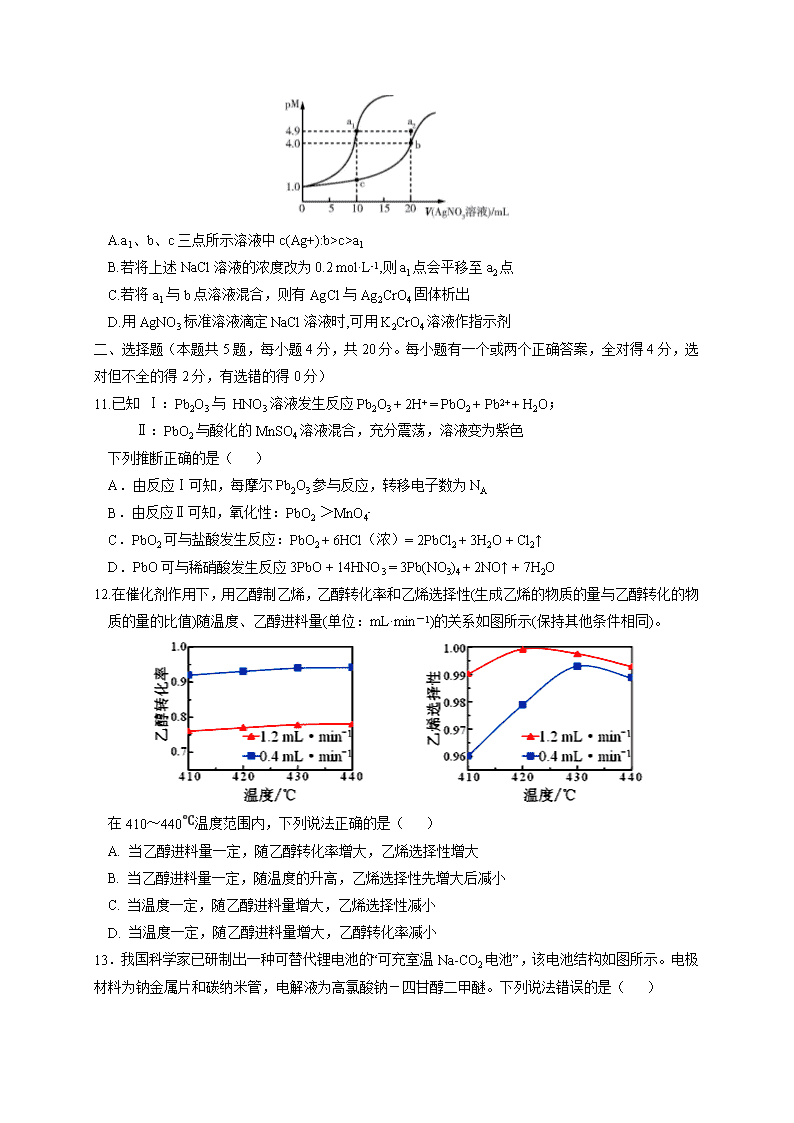
10、某温度下,向10 mL 0.1 mol·L-1 NaCl溶液和10 mL 0.1 mol·L-1 K2CrO4溶液中分别滴加0.1 mol·L-1 AgNO3溶液。滴加过程中pM[pM=-lg M,M为c(Cl-)或c(Cr)]与所加AgNO3溶液体积之间的关系如图所示。已知Ag2CrO4为深红色沉淀,100.1≈1.259,≈1.265。下列说法错误的是( )
A.a1、b、c三点所示溶液中c(Ag+):b>c>a1
B.若将上述NaCl溶液的浓度改为0.2 mol·L-1,则a1点会平移至a2点
C.若将a1与b点溶液混合,则有AgCl与Ag2CrO4固体析出
D.用AgNO3标准溶液滴定NaCl溶液时,可用K2CrO4溶液作指示剂
二、选择题(本题共5题,每小题4分,共20分。每小题有一个或两个正确答案,全对得4分,选对但不全的得2分,有选错的得0分)
11.已知 Ⅰ:Pb2O3与 HNO3溶液发生反应Pb2O3 + 2H+ = PbO2 + Pb2+ + H2O;
Ⅱ:PbO2与酸化的MnSO4溶液混合,充分震荡,溶液变为紫色
下列推断正确的是( )
A.由反应Ⅰ可知,每摩尔Pb2O3参与反应,转移电子数为NA
B.由反应Ⅱ可知,氧化性:PbO2 >MnO4-
C.PbO2可与盐酸发生反应:PbO2 + 6HCl(浓)= 2PbCl2 + 3H2O + Cl2↑
D.PbO可与稀硝酸发生反应3PbO + 14HNO3 = 3Pb(NO3)4 + 2NO↑ + 7H2O
12.在催化剂作用下,用乙醇制乙烯,乙醇转化率和乙烯选择性(生成乙烯的物质的量与乙醇转化的物质的量的比值)随温度、乙醇进料量(单位:mL·min-1)的关系如图所示(保持其他条件相同)。
在410~440℃温度范围内,下列说法正确的是( )
A. 当乙醇进料量一定,随乙醇转化率增大,乙烯选择性增大
B. 当乙醇进料量一定,随温度的升高,乙烯选择性先增大后减小
C. 当温度一定,随乙醇进料量增大,乙烯选择性减小
D. 当温度一定,随乙醇进料量增大,乙醇转化率减小
13.我国科学家已研制出一种可替代锂电池的“可充室温Na-CO2电池”,该电池结构如图所示。电极材料为钠金属片和碳纳米管,电解液为高氯酸钠-四甘醇二甲醚。下列说法错误的是( )
A.放电时钠金属片发生氧化反应
B.电池工作时,负极材料减重0.23 g,则流经电解液的电子为0.01 mol
C.碳纳米管的作用主要是导电及吸附CO2
D.充电时阳极反应为:C+ 2Na2CO3 - 4e− = 3CO2↑ + 4Na+
14.常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、HCO3-和CO32-的物种分布分数(X)=与pH的关系如图所示:
下列说法不正确的是( )
A.反应H2CO3H++ HCO的lgK = -6.4
B.pH=8的溶液中:c(Na+) > c(HCO)
C.NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+) = 2c(CO) + c(HCO)
D.向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:HCO + OH−=CO + H2O
15.常温下,某溶液A中含有K+、Na+、Fe3+、Al3+、CO32-、NO3-、Cl−、SO42-中的若干种,且各离子的物质的量浓度均相同,现取该溶液进行有关实验,实验结果如图所示:下列有关说法不正确的是( )
A.Fe3+、Al3+不能同时存在
B.沉淀乙中一定含有BaCO3和BaSO4
C.溶液A可能由AlCl3,NaNO3,Al2(S04)3按物质的量之比为1:3:1混合而成的溶液
D.要确定A溶液中是否存在Na+或K+中的一种,只能通过焰色反应
第Ⅱ卷(60分)
三、非选择题(共5题)
16.(10分)高铁酸盐在污水处理,水体消杀等方面用途广泛。高铁酸钾()是一种重要的高铁酸盐。某学校化学学习小组通过下列装置制备。回答下列问题:
已知的部分性质如下:
溶解性
溶于水,微溶于浓KOH溶液,难溶于有机物
稳定性
温度为0~5℃或强碱性溶液中能稳定存在;酸性或中性溶液中放出O2
(1)仪器a的名称是________________。
(2)装置乙可选用下列________(填标号)。
(3)连接好装置乙后,需对装置气密性进行检查,写出整套装置的气密性检查方法及气密性良好的现象:_________________________________。
(4)装置甲中的试剂X为锰的一种化合物,写出装置甲中发生的离子反应式____________。
(5)制备过程中,装置丙需采用冰水浴,目的是__________________________,该装置中
以1molFeCl3为原料,完全转化为K2FeO4需要消耗KOH________ g。
(6)装置丁的作用是_________________________________。
17.(10分)是硫酸生产中的催化剂,某种含钒工业下脚料主要成分是,其中含铝、硅、铜、锰等氧化物及油脂等杂质,一种以该下脚料为原料提取的工艺流程如下:
已知:ⅰ.V2O5 + 2H+ = 2VO2+ + H2O;VO2+ + H2O VO3- + 2H+。
ⅱ.常温时,有关氢氧化物的溶度积常数如下表:
氢氧化物
Mn(OH)2
Cu(OH)2
Al(OH)3
Ksp
4.00×10-14
2.20×10-20
1.90×10-33
回答下列问题:
(1)“焙烧”可以除去油脂,还有一个作用是________________。
(2)“滤渣1”的主要成分是____________(写化学式),“调pH = 7”,析出沉淀后,滤液中c(Cu2+):c(Al3+) =________。
(3)“沉锰”操作反应的离子方程式是____________________。
(4)“浓缩结晶”时,需要加入过量(NH4)2SO4,其原因是_______________________。母液中溶质主要成分是_____________________
(5)利用制得的V2O5可通过电解的方法制备金属钒,以石墨为电极,熔融氧化钙为电解质,其阴极反应式是_________________。也可以通过铝热反应制取,其化学反应方程式是______________________。
18.(14分)甲烷水蒸气重整制取的合成气可用于熔融碳酸盐燃料电池。
(1)甲烷水蒸气重整制取合成气反应为CH4(g)+H2O(g) CO(g)+3H2(g) ∆H =+206 kJ/mol。
向体积为2 L密闭容器中,按n(H2O) ∶n(CH4) =1投料:
a.保持温度为T1时,测得CH4(g)的浓度随时间变化曲线如图1所示。
b.其他条件相同时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,反应相同时间后,CH4的转化率随反应温度的变化如图2所示。
图1 图2
结合图1,写出反应达平衡的过程中的能量变化:____________kJ。
根据图2判断:
ⅰ. a点所处的状态不是化学平衡状态,理由是_______________________________。
ⅱ. CH4的转化率:c>b,原因是___________________________________________。
(2) 一定温度下,在容积均为2 L的两个密闭容器中,按如下方式加入反应物,发生反应:CO2(g) + 3H2(g)
CH3OH(g) + H2O(g),10 min后达到平衡。
容器
甲
乙
反应物投入量
1 mol CO2、3 mol H2
a mol CO2、b mol H2、
c mol CH3OH(g)、c mol H2O(g)(a、b、c均不为零)
若甲容器平衡后气体的压强为开始时的0.8倍,则反应10 min内甲容器中以CH3OH(g)表示的化学反应速率为 ;要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则乙容器中c的取值范围为 。
(3) 氢气可将CO2还原为甲烷,反应为CO2(g) + 4H2(g) CH4(g) + 2H2O(g)。ShyamKattel等结合实验 与计算机模拟结果,研究了在Pt/SiO2催化剂表面上CO2与H2的反应历程,前三步历程如图所示其中吸附在Pt/SiO2催化剂表面用“·”标注,Ts表示过渡态。从物质吸附在催化剂表面到形成过渡态的过程会____
_________(填“放出热量”或“吸收热量”);反应历程中最小能垒(活化能)步骤的化学方程式为 。
19.(14分)工业上合成氨,CO易与铁触媒作用导致铁触媒失去催化活性:Fe + 5 CO ═ Fe(CO)5。为了防止催化剂铁触媒中毒,要除去CO,发生的反应为Cu(NH3)2OOCCH3 + CO + NH3 ═ Cu(NH3)3(CO)OOCCH3。回答下列问题:
(1)写出CO的一种常见等电子体分子的结构式: ;C、N、O的第一电离能由大到小的顺序为 (用元素符号表示)。
(2)与O同族的元素还有S、Se、Te,它们氢化物的沸点大小为H2O>H2Te>H2Se>H2S,其原因是 。
(3)1mol配合物[Cu(NH3)2]OOCCH3中,铜显+1价,则含有化学键的类型有________________;其中含有的σ键数目为 ,NH3分子的价电子对互斥理论模型是 。
(4)一种类石墨的聚合物半导体g-C3N4,其单层平面结构如图1,晶胞结构如图2。
① g-C3N4中氮原子的杂化类型是 。
② 根据图2,在图1中用平行四边形画出一个最小重复单元。
③ 已知该晶胞的体积为V cm3,中间层原子均在晶胞内部。设阿伏加德罗常数的值为NA,则g-C3N4的密度为 g•cm-3。
20.(12分)化合物G是一种药物合成中间体,其合成路线如下:
已知A分子中只含有一种官能团且能与NaHCO3反应生成CO2。回答下列问题:
(1)C中的官能团名称是___________。
(2)F的结构简式是___________。
(3)A与乙二醇在催化剂作用下反应生成可生物降解型聚酯PES,该反应的化学方程式为____________。
(4)X是G的同分异构体,满足下列条件的X共有___________种(不考虑立体异构),① 含苯环且苯
环上只有两个取代基;② 含醛基且与苯环直接相连;③ 除苯环外不含其他环状结构。
其中核磁共振氢谱有5组峰且面积比为6∶2∶2∶1∶1的是___________(写结构简式)。
(5)参照上述合成路线设计由苯和甲苯制备的合成路线:_________________________________________________________________________________________
_______________________________________________________________________(无机试剂任选)。
答案
题号
1
2
3
4
5
6
7
8
9
10
答案
C
B
A
B
D
A
D
B
C
C
题号
11
12
13
14
15
答案
B
BD
B
CD
D
16.(10分)
(1)三颈(烧)瓶(1分)
(2)d(1分)
(3)关闭分液漏斗活塞,打开止水夹1,2,3,向丁中烧杯加水至没过球形干燥管,用酒精灯微热甲中圆底烧瓶,若观察到丁中产生气泡,移去酒精灯后,丁中球形干燥管中形成一段稳定水柱,则说明装置气密性良好(2分,操作和现象各1分)
(4)2MnO4- + 16H+ + 10Cl- =2Mn2+ + 5Cl2↑ +8H2O(2分)
(5)防止产物K2FeO4分解(或答“提高目标产物产率” )(1分);448(2分)
(6)吸收尾气,防止污染(1分)
17.(10分)
(1)将氧化为(1分)
(2)SiO2(1分)2.2×106:1.9(或1.16×106)(2分)
(3)(2分)
(4)利用同离子效应,促进NH4VO3尽可能析出完全(1分);(NH4)2SO4、Na2SO4(1分)
(5)V2O5 + 10e- = 2V +5O2-(1分);3V2O5 + 10Al 6V + 5Al2O3(1分)
18.(14分)(1)吸收412(x-y)(2分)
ⅰ.催化剂不能改变物质的平衡转化率;750℃时,反应相同时间,a点对应的CH4的转化率低于使用Ⅰ时CH4的转化率(2分)
ⅱ. 反应吸热,温度升高,反应速率增大。(2分)
(2)0.02 mol·L-1·min-1(2分) 0.4 < c ≤ 1(2分)
(3)吸收热量(2分) ·OH+·H == H2O(g)(2分)
19(14分)(1)N≡N(1分) N>O>C(1分)
(2)H2Te、H2Se、H2S均是分子晶体,相对分子质量逐渐减小,范德华力减小,所以沸点减小,而水分子中存在氢键,所以沸点最高(2分)
(3)离子键、共价键(或极性键)、配位键(2分);14NA(2分);四面体形(1分)
(4)① sp2杂化(1分) ② (2分) ③ (2分)
20.(12分)(1)羰基和羧基(1分)
(2) (1分)
(3)(2分)
(4)24(2分) (2分)
(5)(4分)
相关文档
- 2018-2019学年湖北省部分重点中学2021-07-079页
- 化学卷·2018届湖北省部分重点中学2021-07-0210页
- 湖北省部分重点中学2016-2017学年2021-07-027页
- 四川省2020届高三上学期10月联考化2021-07-0210页
- 河北省2021届高三上学期10月联考数2021-07-0211页
- 数学(文)卷·2018届山东省德州一中等2021-07-0124页
- 湖北省部分重点中学2020届高三上学2021-07-0122页
- 数学文·湖北省部分重点中学联考202021-07-0123页
- 湖北省部分重点中学2020届高三上学2021-07-0124页
- 2018-2019学年湖北省部分重点中学2021-07-0113页