- 782.50 KB
- 2021-07-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
www.ks5u.com
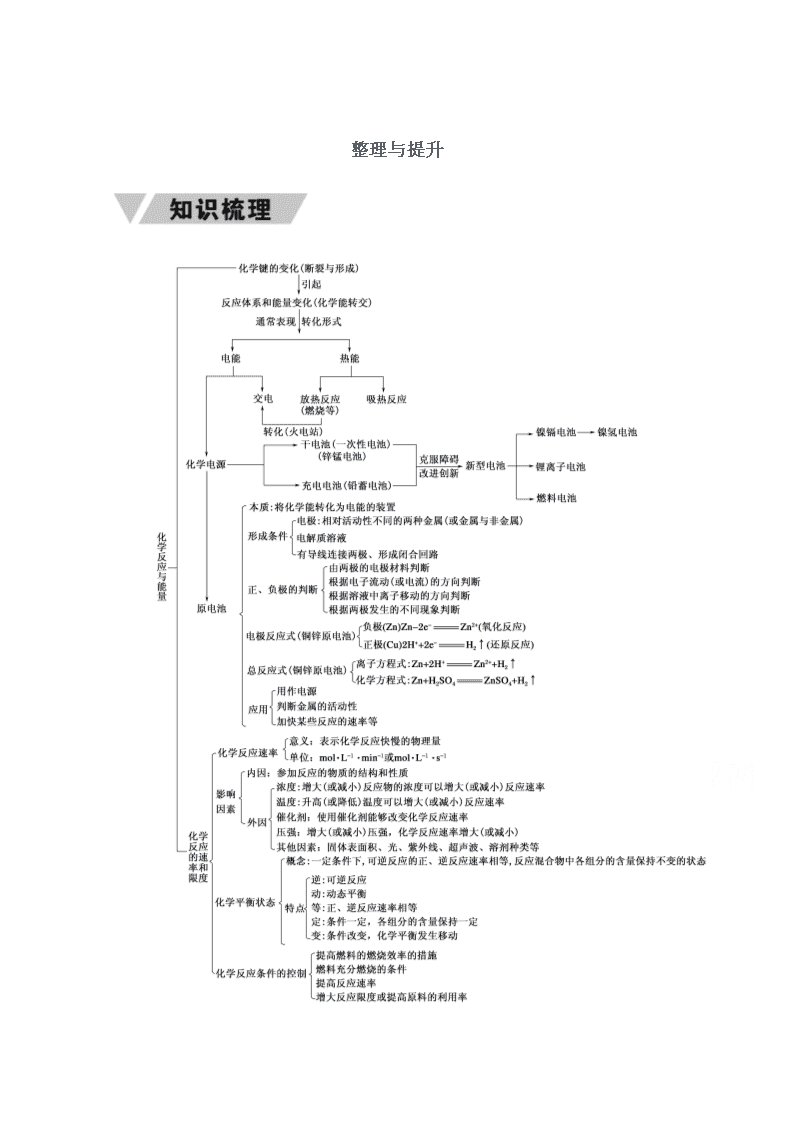
整理与提升
一、化学键与能量变化关系
1.关系:在任何的化学反应中总伴有能量的变化。
原因:当物质发生化学反应时,从微观来看,断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。化学键的断裂和形成是化学反应中能量变化的主要原因。一个确定的化学反应在发生过程中是吸收能量还是放出能量,决定于反应物的总能量与生成物的总能量的相对大小。
2.常见的放热反应和吸热反应
(1)常见的放热反应:①金属与酸、水反应制氢气;②大多数化合反应(特殊:C+CO2===2CO是吸热反应);③铝热反应;④所有的燃烧反应;⑤酸碱中和。
(2)常见的吸热反应:
①C、H2、CO为还原剂的氧化还原反应如:C(s)+H2O(g)CO(g)+H2(g);②Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O;③多数分解反应,如KClO3、KMnO4、CaCO3的分解等(但过氧化氢的分解是放热反应)。
注:反应条件与吸放热无关。
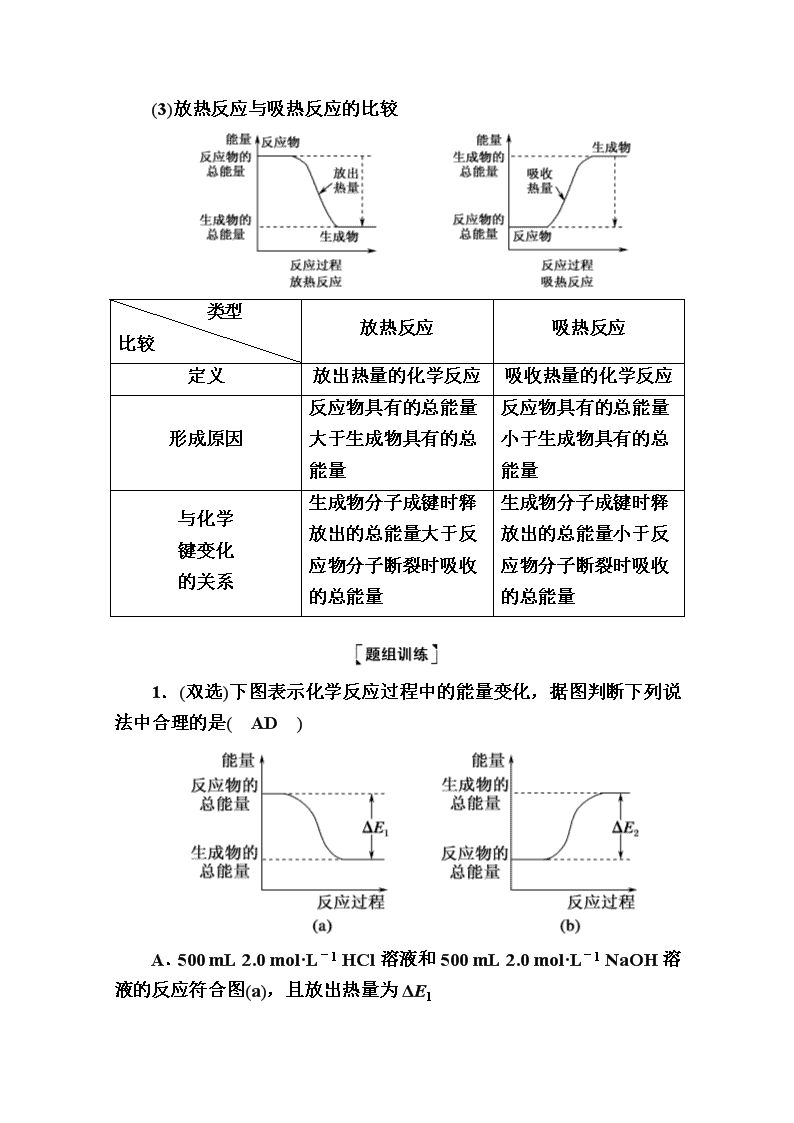
(3)放热反应与吸热反应的比较
类型
比较
放热反应
吸热反应
定义
放出热量的化学反应
吸收热量的化学反应
形成原因
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
与化学
键变化
的关系
生成物分子成键时释放出的总能量大于反应物分子断裂时吸收的总能量
生成物分子成键时释放出的总能量小于反应物分子断裂时吸收的总能量
1.(双选)下图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( AD )
A.500 mL 2.0 mol·L-1 HCl溶液和500 mL 2.0 mol·L-1 NaOH溶液的反应符合图(a),且放出热量为ΔE1
B.500 mL 2.0 mol·L-1 H2SO4溶液和500 mL 2.0 mol·L-1 Ba(OH)2溶液的反应符合图(b),且吸收热量为ΔE2
C.发生图(a)能量变化的任何反应,一定不需要加热即可发生
D.Ba(OH)2和NH4Cl反应的能量变化符合图(b)
解析:图(a)表示放热反应,选项A是放热反应,A项正确;图(b)表示吸热反应,选项B是放热反应,B项错误;一些放热反应需加热才能发生,C项错误;Ba(OH)2与NH4Cl的反应属于吸热反应,符合(b)图,D正确。
2.请根据化学反应与热能的有关知识,填写下列空白:
(1)在一个小烧杯里,加入20 g Ba(OH)2·8H2O粉末,将小烧杯放在事先已滴有4~5滴水的玻璃片上。然后加入10 g NH4Cl晶体,并用玻璃棒迅速搅拌。
①实验中玻璃棒的作用是搅拌使混合物充分接触并反应。
②写出有关反应的化学方程式:Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O。
③实验中观察到的现象:反应混合物呈糊状,玻璃片与烧杯之间结冰粘在一起,有少许刺激性气味气体逸出。
(2)下列过程中不一定释放能量的是③(填编号)。
①形成化学键 ②燃料燃烧 ③化合反应 ④葡萄糖在体内的氧化反应 ⑤酸碱中和 ⑥炸药爆炸
(3)等质量的下列物质分别完全燃烧,放出热量较多的是②(填编号)。
①固体硫 ②硫蒸气
(4)已知H2和O2反应放热,且断开1 mol H—H键、1 mol O===O键、1 mol O—H键需吸收的能量分别为Q1 kJ、Q2 kJ、Q3 kJ,由此可以推知下列关系正确的是③(填编号)。
①Q1+Q2>Q3 ②Q1+Q2>2Q3
③2Q1+Q2<4Q3 ④2Q1+Q2<2Q3
解析:
(1)用玻璃棒迅速搅拌,作用是使混合物充分接触并反应;氯化铵属于铵盐,能和强碱氢氧化钡反应生成氨、水以及氯化钡,化学方程式为Ba(OH)2·8H2O+2NH4Cl===BaCl2+2NH3↑+10H2O;氯化铵和Ba(OH)2·8H2O的反应是吸热反应,温度降低能让水结冰,导致烧杯和玻璃片粘在一起,同时生成的氨具有刺激性气味。
(2)一般的化合反应放热,但有的化合反应吸热,如二氧化碳和碳反应生成一氧化碳。
(3)固态变为气态需要吸收能量,所以硫蒸气的能量大于固体硫,等质量的固体硫、硫蒸气分别完全燃烧,放出热量较多的是硫蒸气。
(4)已知2 mol H2和1 mol O2反应生成2 mol H2O,反应断开2 mol H—H键吸收能量2Q1 kJ,断开1 mol O===O键吸收能量Q2 kJ,形成4 mol O—H键放出能量4Q3 kJ,总反应放热,则2Q1+Q2<4Q3。
二、原电池电极反应式的书写
1.正负极判断
(1)根据电极材料判断。
一般来讲,活动性较强的金属为负极,活动性较弱的金属或能导电的非金属为正极。
(2)根据电流方向或电子流动方向来判断。
在外电路(导线)上,电流由正极流向负极,电子流动方向是由负极流向正极。
(3)根据反应类型判断。
原电池的负极总是失电子发生氧化反应,正极总是得电子发生还原反应。
(4)根据现象判断。
溶解的一极为负极,增重或有气泡放出的一极为正极。
2.书写方法
按照负极发生氧化反应,正极发生还原反应的规律,根据原电池总反应判断出两极反应的产物,然后结合电解质溶液所能提供的离子,依据质量守恒、电荷守恒配平电极反应式。
(1)具体步骤为:①列物质,标得失;②选离子,配电荷;③
配个数,巧用水;④两式加,验总式。
(2)写电极反应式时应注意:
①两极得失电子数相等;
②电极反应常用“===”,不用“―→”;
③电极反应中若有气体生成,需加“↑”;若有固体生成,一般不标“↓”。
3.一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧气作用生成水和二氧化碳。该电池负极发生的反应是( C )
A.CH3OH+O2-2e-===H2O+CO2+2H+
B.O2+4H++4e-===2H2O
C.CH3OH+H2O-6e-===CO2+6H+
D.O2+2H2O+4e-===4OH-
解析:原电池电极反应式的书写技巧。
(1)将氧化还原反应分解为氧化反应和还原反应两个半反应,氧化反应为负极反应,还原反应为正极反应。
(2)两极反应的电荷守恒、元素守恒,两极反应的电子得失守恒。结合电解质溶液的酸碱性,配平两极反应以及确定氧化产物和还原产物的存在形式。
(3)首先写出较易写的电极反应式,然后用总反应式减去该电极反应式即得到另一电极的反应式。
(4)一般有机物失去电子数比较难定,所以采用该物质的燃烧方程式,由氧气所得到的电子数来确定有机物所失去的电子数。
负极发生氧化反应是CH3OH失电子;正极发生还原反应,是O2得到电子,故答案选择C项。
4.(双选)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3
(s)。下列说法错误的是( CD )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.1 mol电子,锌的质量理论上减小6.5 g
三、化学反应速率和平衡图像
有关图像的化学题,是化学基础知识,基本规律以平面直角坐标系中的图像为载体进行表达的题目。图像化学题一般综合性强,难度较大。解题时,重点是理解图像的意义和特点。归纳起来,图像题的解答方法与思路是:
1.理解图像中的面、线、点
(1)理解面。
理解各坐标轴所代表的量的意义及曲线所表示的是哪些量的关系。
(2)理解线。
理解曲线“平”与“陡”的意义,即斜率大小的意义;理解曲线的变化趋势并归纳出规律。如图中有拐点,先拐先平,较早出现拐点的曲线表示先达平衡,对应温度高、压强大。
(3)理解点。
理解曲线上点的意义,特别是某些特殊点,如坐标轴的交点,几条曲线的交叉点、极值点、转折点等。
2.联系规律
联想外界条件对化学反应速率的影响规律,作出正确判断。
5.(双选)合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:N2(g)+3H2(g)2NH3(g),673 K、30 MPa时,n(NH3)和n(H2
)随时间变化的关系如下图所示。下列叙述正确的是( BD )
A.点a的正反应速率比点b的小
B.点d处反应达到平衡
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.其他条件不变,773 K下反应至t1时刻,v(H2)比图中d点时的v(H2)的值大
解析:a点的H2浓度比b点大,正反应速率较大,故A项错;d点H2的物质的量保持不变,反应达到平衡,故B正确;d、e两点都是反应达平衡时的点,反应物和生成物浓度都不变,故C项错误;温度升高,化学反应速率增大,v(H2)增大,故D项正确。
6.298 K时,将20 mL 3x mol·L-1 Na3AsO3、20 mL 3x mol·L-1 I2和20 mL NaOH溶液混合,发生反应:AsO(aq)+I2(aq)+2OH-(aq)AsO(aq)+2I-(aq)+H2O(l)。溶液中c(AsO)与反应时间(t)的关系如图所示。
(1)下列可判断反应达到平衡的是ac(填字母)。
a.溶液的pH不再变化
b.v(I-)=2v(AsO)
c.c(AsO)/c(AsO)不再变化
d.c(I-)=y mol·L-1
(2)tm时,v正大于v逆(填“大于”“小于”或“等于”)。
(3)tm时v逆小于tn时v逆(填“大于”“小于”或“等于”),理由是tm时生成物浓度较低。
解析:(1)a项,随反应进行,溶液的pH不断降低,当pH不再变化时,说明反应达到平衡;b项,速率之比等于化学计量数之比,该结论在任何时刻都成立,故无法判断反应是否达到平衡;c项,随反应进行,c(AsO)不断增大,c(AsO)不断减小,当二者比值不变时,说明二者浓度不再改变,则反应达到平衡;d项,由图像并结合方程式可知,平衡时c(I-)=2y mol·L-1,故当c(I-)=y mol·L-1时,反应未达到平衡。
(2)由图像可知tm时刻后c(AsO)仍在不断增加,说明反应还在正向进行,故此时v正大于v逆。
(3)tm到tn时刻,反应一直正向进行,生成物的浓度逐渐增大,所以逆反应速率不断增大,故tm时v逆小于tn时v逆。
7.如图表示某可逆反应达到平衡过程中某一反应物的vt图像,我们知道v=;反之,Δc=v×Δt。请问下列vt图像中的阴影面积表示的意义是( C )
A.从反应开始到平衡时,该反应物的浓度
B.从反应开始到平衡时,该生成物的浓度
C.从反应开始到平衡时,该反应物实际减小的浓度
D.从反应开始到平衡时,该反应物实际增大的浓度
相关文档
- 人教版高中化学必修1课件:第2章 第32021-07-0812页
- 高中化学必修1知识点总结2021-07-0819页
- 高中物理 第12章 第2节波的图象课2021-07-0839页
- 2020_2021学年新教材高中化学第3章2021-07-0859页
- 初高中化学衔接6核外电子排布的初2021-07-084页
- 2020_2021学年新教材高中化学第3章2021-07-0810页
- (完整版)高中化学必修1知识点归纳2021-07-0813页
- 高中化学方程式大全(绝对全)2021-07-0818页
- 高中化学 元素周期律学案2021-07-083页
- 高中化学 讲课 离子浓度比较2021-07-0820页