- 611.50 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第 1 页 / 共 8 页
加餐练 13 氮及其化合物
基础题
1.下列关于自然界中氮循环(如下图)的说法不正确的是( )
A.氮元素均被氧化
B.工业合成氨属于人工固氮
C.含氮无机物和含氮有机物可相互转化
D.碳、氢、氧三种元素也参与了氮循环
2.氮元素在海洋中的循环是整个海洋生态系统的基础和关键。海洋中无机氮的循环过
程可如图表示。下列关于海洋氮循环的说法正确的是( )
A.海洋中的氮循环起始于氮的氧化
B.海洋中的氮循环中属于固氮作用的是③
C.海洋中的反硝化作用一定有氧气的参与
D.向海洋排放含 NO -
3 的废水会影响海洋中 NH +
4 的含量
3.在一定条件下,将充满 NO2 和 O2 的试管倒立于水槽中,充分反应后,剩余气体体
积为原混合气体的1
8
,原混合气体中 NO2 和 O2 的体积比是( )
①8:1 ②7:3 ③7:1 ④4:1
A.①② B.②③ C.③④ D.①④
4.设 NA 为阿伏加德罗常数的值,下列有关叙述正确的是( )
A.标准状况下,22.4 L NO 与 CO2 的混合气体中含有 O 原子数为 3NA
B.0.1 mol NH3 溶于足量水中(不考虑氨气挥发),溶液中 N 原子的数目为 0.1NA
C.0.1 mol N2 与足量的 H2 反应,转移的电子数是 0.6NA
第 2 页 / 共 8 页
D.58.5 g 的 NaCl 固体中含有 NA 个氯化钠分子
5.下列关于氮及其化合物的说法错误的是( )
A.所有的铵盐都能与烧碱共热生成氨气
B.浓硝酸不论与铜反应还是与碳反应,均体现其酸性和强氧化性
C.一氧化氮结合血红蛋白的能力比一氧化碳还强,更容易造成人体缺氧
D.把带火星的木条伸入充满 NO2 和 O2 混合气体(NO2 和 O2 的物质的量之比为 4:1)的集
气瓶中,木条复燃,说明 NO2 支持燃烧
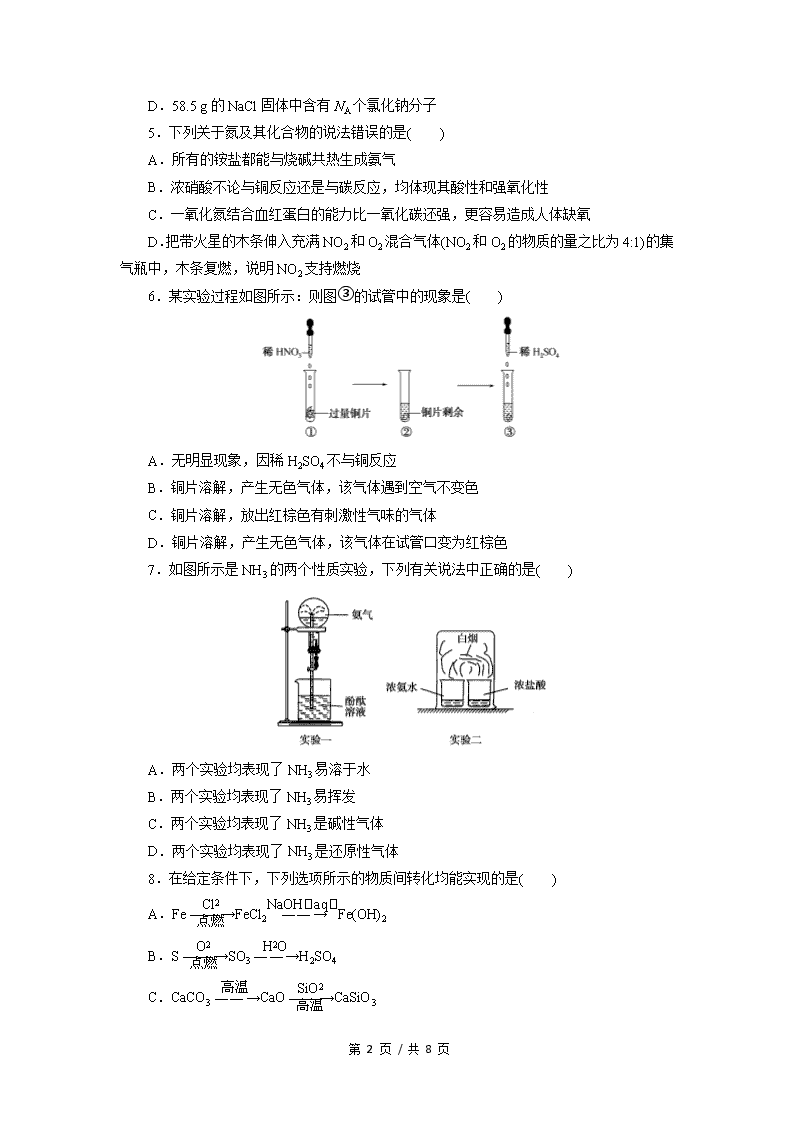
6.某实验过程如图所示:则图③的试管中的现象是( )
A.无明显现象,因稀 H2SO4 不与铜反应
B.铜片溶解,产生无色气体,该气体遇到空气不变色
C.铜片溶解,放出红棕色有刺激性气味的气体
D.铜片溶解,产生无色气体,该气体在试管口变为红棕色
7.如图所示是 NH3 的两个性质实验,下列有关说法中正确的是( )
A.两个实验均表现了 NH3 易溶于水
B.两个实验均表现了 NH3 易挥发
C.两个实验均表现了 NH3 是碱性气体
D.两个实验均表现了 NH3 是还原性气体
8.在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.Fe――→Cl2
点燃 FeCl2 ――→NaOH aq Fe(OH)2
B.S――→O2
点燃 SO3――→H2O H2SO4
C.CaCO3――→
高温
CaO――→SiO2
高温 CaSiO3
第 3 页 / 共 8 页
D.NH3 ――→O2
催化剂,△NO――→H2O HNO3
9.下列说法正确的是( )
A.在稀硫酸中加入铜粉,铜粉不溶解,再加入 Cu(NO3)2 固体,铜粉仍不溶解
B.铜与浓硝酸反应的离子方程式为 Cu+4H++2NO-
3 ===Cu2++2NO2↑+2H2O
C.1.0 mol·L-1 的 KNO3 溶液中可大量存在 H+、Fe2+、Cl-、SO2-
4
D.硫化铜溶于硝酸的离子方程式为 CuS+2H+===H2S↑+Cu2+
能力题
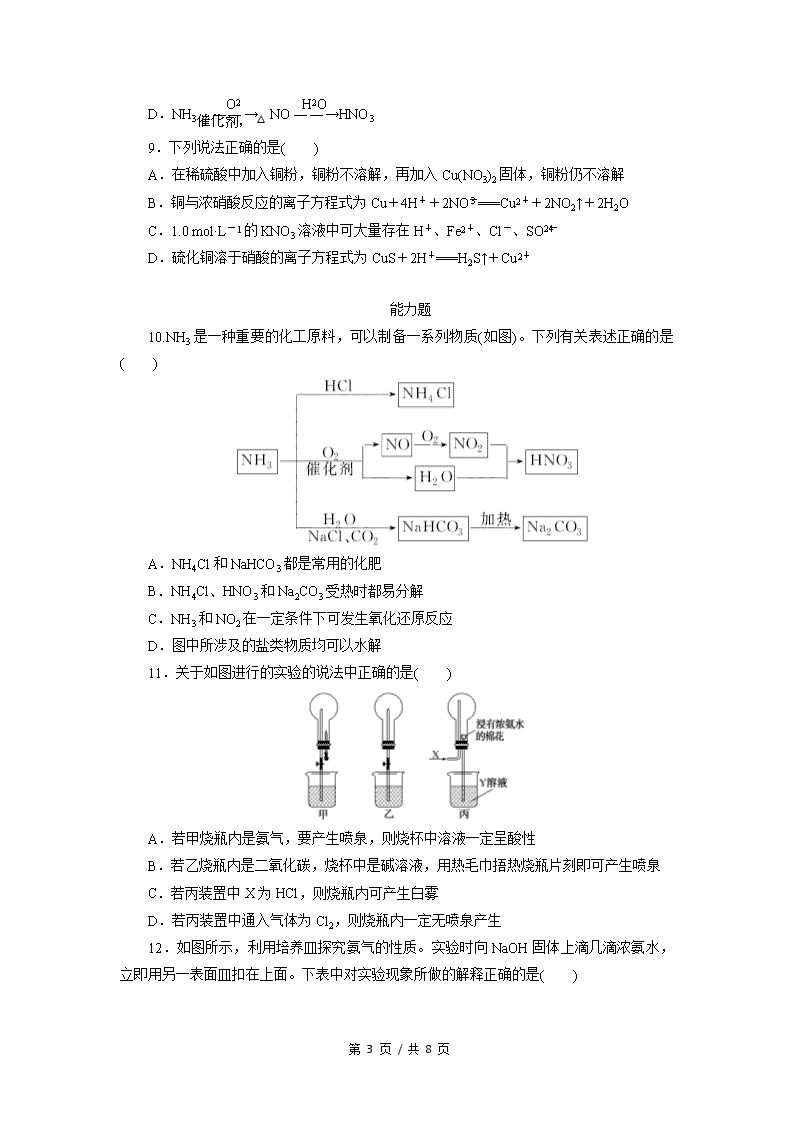
10.NH3 是一种重要的化工原料,可以制备一系列物质(如图)。下列有关表述正确的是
( )
A.NH4Cl 和 NaHCO3 都是常用的化肥
B.NH4Cl、HNO3 和 Na2CO3 受热时都易分解
C.NH3 和 NO2 在一定条件下可发生氧化还原反应
D.图中所涉及的盐类物质均可以水解
11.关于如图进行的实验的说法中正确的是( )
A.若甲烧瓶内是氨气,要产生喷泉,则烧杯中溶液一定呈酸性
B.若乙烧瓶内是二氧化碳,烧杯中是碱溶液,用热毛巾捂热烧瓶片刻即可产生喷泉
C.若丙装置中 X 为 HCl,则烧瓶内可产生白雾
D.若丙装置中通入气体为 Cl2,则烧瓶内一定无喷泉产生
12.如图所示,利用培养皿探究氨气的性质。实验时向 NaOH 固体上滴几滴浓氨水,
立即用另一表面皿扣在上面。下表中对实验现象所做的解释正确的是( )
第 4 页 / 共 8 页
选项 实验现象 解释
A 浓盐酸附近产生白烟 NH3 与浓盐酸反应产生了 NH4Cl 固体
B 浓硫酸附近无明显现象 NH3 与浓硫酸不发生反应
C 氯化物溶液变浑浊 该溶液一定是 AlCl3 溶液
D
干燥红色石蕊试纸不变色,湿润红色石蕊
试纸变蓝
NH3 是一种可溶性碱
13.NO 很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生 NO,用于
在细胞和细胞间传递信息;NO 还参与心血管系统、免疫系统以及中枢和外围神经系统的调
控。
(1)实验室用金属铜和稀硝酸制取 NO 的离子方程式为
________________________________________________________________________
________________________________________________________________________。
(2)NO 是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开
随用、随关随停的 NO 气体发生装置,如图甲所示。
打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的原因是
________________________________________________________________________
________________________________________________________________________
(写化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是 NO,某学生另设计了一套如图乙所示的装置
制取 NO。反应开始时,可以在 U 形管右端观察到无色的 NO 气体。长玻璃管的作用是
________________________________________________________________________。
(4)假设实验中 12.8 g Cu 全部溶解,需要通入标准状况下________L O2 才能使 NO 全部
溶于水。
(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列 4 种方法中最
好的是________(填“甲”“乙”“丙”或“丁”),理由是
第 5 页 / 共 8 页
________________________________________________________________________
________________________________________________________________________。
甲:铜――→
浓硝酸硝酸铜
乙:铜――→
稀硝酸硝酸铜
丙:铜――→
氯气 氯化铜――→
硝酸 硝酸铜
丁:铜――→
空气 氧化铜――→
硝酸 硝酸铜
14.资源的高效利用对保护环境、促进经济持续健康发展具有重要作用。磷尾矿主要含
Ca5(PO4)3F 和 CaCO3·MgCO3。某研究小组提出了磷尾矿综合利用的研究方案,制备具有重
要工业用途的 CaCO3、Mg(OH)2、P4 和 H2,其简化流程如下:
已知:①Ca5(PO4)3F 在 950 ℃不分解
②4Ca5(PO4)3F+18SiO2+30C 高温,2CaF2+30CO+18CaSiO3+3P4
请回答下列问题:
(1)950 ℃煅烧磷尾矿生成气体的主要成分是________。
(2)实验室过滤所需的玻璃仪器是________。
(3)NH4NO3 溶液能从磷矿Ⅰ中浸取出 Ca2+的原因是
________________________________________________________________________
________________________________________________________________________。
(4)在浸取液Ⅱ中通入 NH3,发生反应的化学方程式是
________________________________________________________________________。
第 6 页 / 共 8 页
加餐练 13 氮及其化合物
1.解析:A 项,合成氨反应中,氮元素的化合价降低被还原,错误;B 项,工业合成
氨属于人工固氮,正确;C 项,硝酸盐转化为蛋白质及经动物消化使蛋白质转化为氨气和铵
盐,实现了含氮无机物和含氮有机物的相互转化,并且碳、氢、氧三种元素也参加了氮的循
环,C 正确,D 正确。
答案:A
2.解析:海洋中的氮循环起始于 N2→NH+
4 ,即起始于氮的还原,A 错误;海洋中的氮
循环中属于固氮作用的是②,B 错误;反硝化作用中 N 元素化合价降低,被还原,而 O2 是
常见氧化剂,不需要有 O2 参与,C 错误;转化关系图中若硝酸根离子增多,反硝化作用增
强,向海洋排放含 NO -
3 的废水会影响海洋中 NH +
4 的含量,D 正确。
答案:D
3.解析:设原 NO2 和 O2 混合气体为 8 体积,后来剩余气体为 1 体积。若剩余 1 体积
O2,则原 NO2 为 7×4
5
=28
5
体积,原 O2 为 8-28
5
=12
5
体积,NO2 和 O2 的体积比为28
5 :12
5
=7:3。
若剩余 1 体积气体为 NO,产生 1 体积 NO 需要 3 体积 NO2,则 NO2、O2 和水恰好反应时为
5 体积,所以原 O2 为 5×1
5
=1 体积,原 NO2 为 7 体积,NO2 和 O2 的体积比为 7:1。
答案:B
4.解析:NO 分子中有 1 个氧原子,CO2 中有 2 个氧原子,则标准状况下 22.4 L 混合
气体中含氧原子的个数为 NA~2NA,A 项错误;0.1 mol 氨气含有 0.1 mol 氮原子,B 项正确;
氮气和氢气的反应是可逆的,不能完全反应,转移电子数小于 0.6NA,C 项错误;氯化钠为
离子晶体,氯化钠固体中没有氯化钠分子,D 项错误。
答案:B
5.解析:铵盐与烧碱共热时均能生成氨气,A 项正确;浓硝酸与碳的反应中,浓硝酸
只体现强氧化性,B 项错误;NO 结合血红蛋白的能力比 CO 强,更容易造成人体缺氧,C
项正确;带火星的木条在空气中不能复燃,但伸入 NO2 和 O2 的混合气体中复燃,说明 NO2
支持燃烧,D 项正确。
答案:B
6.解析:生成的 Cu(NO3)2 在 H2SO4 的酸性条件下相当于又有了 HNO3,铜片会继续溶
解生成 NO。
答案:D
7.解析:实验一是氨气的喷泉实验,喷泉实验证明氨气极易溶于水,溶于水形成一水
第 7 页 / 共 8 页
合氨弱碱溶液,滴加酚酞溶液变红色,证明氨气是碱性气体。实验二中浓氨水挥发出的氨气
分子和浓盐酸挥发出的氯化氢分子结合生成白烟氯化铵固体小颗粒,证明浓氨水易挥发,氨
气遇到氯化氢发生反应生成氯化铵,证明氨气是碱性气体。
答案:C
8.解析:A 项,Fe 和 Cl2 反应只生成 FeCl3 得不到 FeCl2,错误;B 项,S 在 O2 中燃烧
只生成 SO2 得不到 SO3,错误;D 项,NO 不和水反应,错误。
答案:C
9.解析:酸性条件下 NO -
3 能溶解铜,A 项错;Fe2+在稀 HNO3 中不能大量存在,C 项
错;硝酸与 CuS 不能发生复分解反应,而是发生氧化还原反应,D 项错。
答案:B
10.解析:A 项,NaHCO3 不是化肥;B 项,Na2CO3 受热不易分解;D 项,NaCl 不水
解。
答案:C
11.解析:因氨气极易溶于水,故烧杯中可以是水,水呈中性,A 错误;通过赶出烧瓶
中二氧化碳而使 NaOH 与 CO2 反应,导致压强减小,引发喷泉,B 正确;NH3+HCl===NH4Cl,
产生的是白烟而非白雾,C 错误;发生反应:8NH3+3Cl2===6NH4Cl+N2,生成固体 NH4Cl,
气体体积减小,烧瓶内可能产生喷泉,D 错误。
答案:B
12.解析:A 项,NaOH 固体溶于水放出热量,促使 NH3·H2O 分解放出 NH3,而浓盐
酸具有较强挥发性,挥发出的 HCl 与 NH3 反应生成 NH4Cl 固体,产生白烟,正确;B 项,
浓硫酸是难挥发性酸,与 NH3 反应生成(NH4)2SO4,观察不到明显现象,错误;C 项,NH3
溶于氯化物溶液产生浑浊,说明有沉淀生成,但不一定是 Al(OH)3,可以是 Mg(OH)2 等,错
误;D 项,NH3 使湿润的红色石蕊试纸变蓝的原因是 NH3 与 H2O 反应生成 NH3·H2O,NH3·H2O
电离产生 NH +
4 和 OH-,溶液呈碱性,但氨气为非电解质,不属于碱,错误。
答案:A
13.解析:
(1)实验室用金属铜和稀硝酸制取 NO 的离子方程式为 3Cu+8H++2NO-
3 ===3Cu2++
4H2O+2NO↑。
(2)分液漏斗中有空气,产生的 NO 跟空气反应产生了 NO2,故实际上看见的是红棕色
的气体,化学方程式为 2NO+O2===2NO2。
(3)长玻璃管的作用是接收被气体压出 U 形管的液体,防止稀硝酸溢出。
(4)由题可知,整个过程可看作 HNO3 未参加氧化还原反应,而是 12.8 g Cu 被氧气氧化,
由 2Cu~O2 知通入的氧气为 0.1 mol,在标准状况下的体积为 2.24 L。
(5)从节约原料和防止环境污染的角度考虑,4 种方法中最好的是丁,理由是制取相同质
第 8 页 / 共 8 页
量的 Cu(NO3)2,丁所消耗的 HNO3 的量最少(原料的利用率最高)且不产生污染环境的气体。
答案:
(1)3Cu+8H++2NO-
3 ===3Cu2++4H2O+2NO↑
(2)2NO+O2===2NO2
(3)接收被气体压出 U 形管的液体,防止稀硝酸溢出
(4)2.24
(5)丁 制取相同质量的 Cu(NO3)2,丁所消耗的 HNO3 的量最少(原料的利用率最高)且不
产生污染环境的气体
14.解析:(1)磷尾矿中除 Ca5(PO4)3F 外还有 CaCO3·MgCO3,950 ℃时 Ca5(PO4)3F 不分
解,CaCO3·MgCO3 分解生成 CaO、MgO 和 CO2。
(2)过滤需要的玻璃仪器有烧杯、漏斗和玻璃棒。
(3)NH4NO3 溶液因 NH +
4 水解使溶液呈酸性,溶解 CaO、Ca(OH)2,使之转化为 Ca2+。
(4)由图可知浸取液中通 NH3 将 Mg2+转化为 Mg(OH)2 沉淀。
答案:(1)CO2
(2)烧杯、漏斗、玻璃棒
(3)NH +
4 水解使溶液呈酸性,与 CaO、Ca(OH)2 反应生成 Ca2+
(4)MgSO4+2NH3+2H2O===Mg(OH)2↓+(NH4)2SO4
相关文档
- 2020年高考化学大题专项复习:物质结2021-07-0937页
- 江苏省高考化学 冲刺训练 5.2 探究2021-07-0914页
- 2020版高考化学一轮复习生命中的基2021-07-0921页
- 2020届高考化学一轮复习反应热的有2021-07-0931页
- 2019届高考化学一轮复习有机化学知2021-07-0919页
- 高考化学大一轮复习专题9有机化合2021-07-0924页
- 备战2021年高考化学模拟专练卷02(学2021-07-097页
- 2020届高考化学一轮复习电解池 金2021-07-099页
- 2020届高考化学一轮复习电解池金属2021-07-0914页
- 2020版高考化学一轮复习认识有机化2021-07-0915页