- 574.35 KB
- 2021-07-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
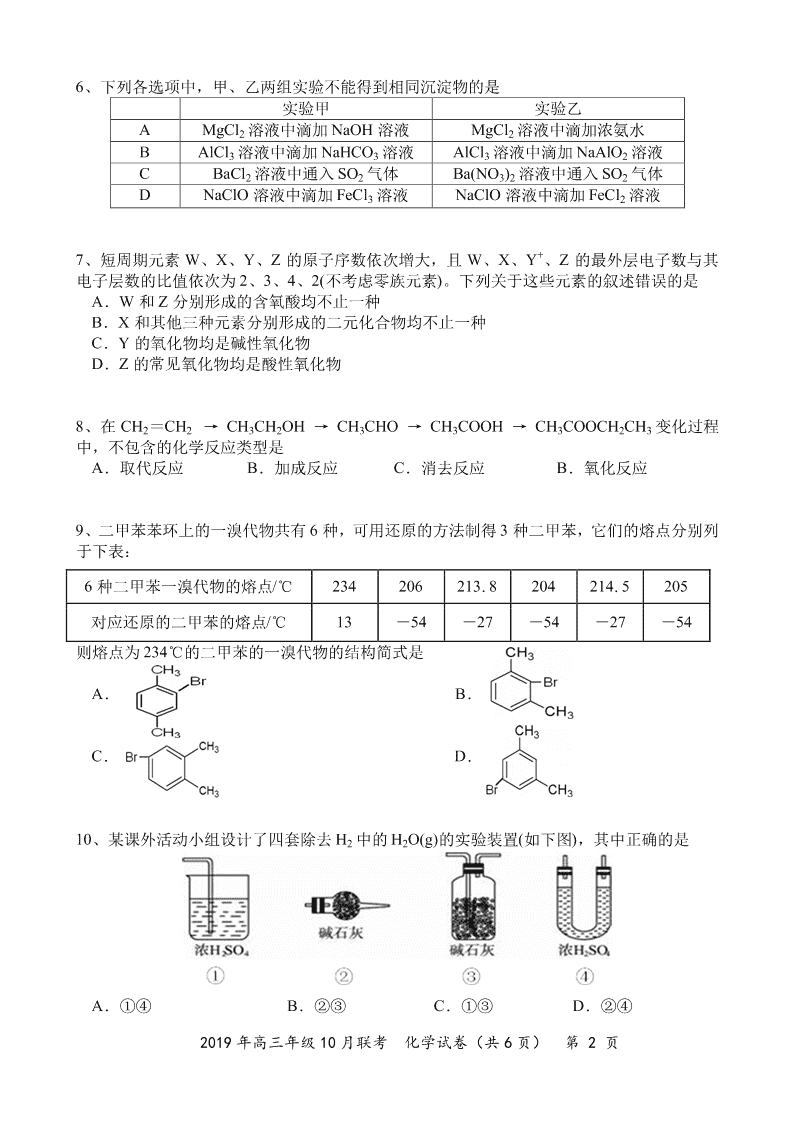
2019 年高三年级 10 月联考
化学试题
考试时间:2019 年 10 月 18 日 8∶00 ~ 9∶30 试卷满分:100 分
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 K-39 Fe-56
Cr-52 Cu-64 Ba-137
一、选择题(本题含 16 小题,每小题只有一个最佳答案,每小题 3 分,共 48 分)
1、下列说法中,不正确的是
A.为加速固体物质的溶解,常采用搅拌、加热等措施
B.为加速气体物质的溶解,常采用加热、振荡等措施
C.为加快反应速率,常采用加热、光照、超声波等措施
D.为加快过滤的速度,常采用减压过滤等措施
2、25℃时,下列溶液中水的电离程度最大的是
A.pH = 4 的 NH4Cl 溶液 B.pH = 4 的 NaHSO4 溶液
C.pH = 11 的氨水 D.pH = 11 的 Ba(OH)2 溶液
3、为了更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg{c(H+)/c(OH—) }。
下列各组离子在指定环境下能大量共存的是
A.AG=14 的溶液中 Na+、K+、Cl-、AlO2
-
B.AG=12 的溶液中 Na+、Ca2+、Cl-、ClO-
C.AG=0 的溶液中 Mg2+、Fe3+、NO3
-、SO4
2-
D.AG=-6 的溶液中 K+、Na+、SO4
2-、SiO3
2–
4、已知 25℃时,部分难溶物质的 Ksp 如下表:
难溶物质 Ksp
AgNO2 5.8×10-4
Ag2Cr2O7 2.0×10-7
AgOH 1.6×10-8
Ag2CO3 6.0×10-12
25℃时,分别向 100 mL 浓度均为 0.01 mol/L 的下列物质的溶液中,逐滴加入 0.01 mol/L 的
AgNO3 溶液,最先出现沉淀的是
A.NaNO2 B.K2Cr2O7 C.NaOH D.Na2CO3
5、用铂作电极电解一定浓度的下列物质的水溶液。电解结束后,向剩余电解液中加适量水,
能使溶液浓度恢复到与电解前完全相同的是
A.H2SO4 B.CuCl2 C.KBr D.AgNO3
2019 年高三年级 10 月联考 化学试卷(共 6 页) 第 1 页
6、下列各选项中,甲、乙两组实验不能得到相同沉淀物的是
实验甲 实验乙
A MgCl2 溶液中滴加浓氨水
B AlCl3 溶液中滴加 NaAlO2 溶液
C BaCl2 溶液中通入 SO2 气体 Ba(NO3)2 溶液中通入 SO2 气体
D NaClO 溶液中滴加 FeCl3 溶液 NaClO 溶液中滴加 FeCl2 溶液
7、短周期元素 W、X、Y、Z 的原子序数依次增大,且 W、X、Y+、Z 的最外层电子数与其
电子层数的比值依次为 2、3、4、2(不考虑零族元素)。下列关于这些元素的叙述错误的是
8、在 CH2=CH2 → CH3CH2OH → CH3CHO → CH3COOH → CH3COOCH2CH3 变化过程
中,不包含的化学反应类型是
A.取代反应 B.加成反应 C.消去反应 B.氧化反应
9、二甲苯苯环上的一溴代物共有 6 种,可用还原的方法制得 3 种二甲苯,它们的熔点分别列
于下表:
则熔点为 234℃的二甲苯的一溴代物的结构简式是
A. B.
C. D.
10、某课外活动小组设计了四套除去 H2 中的 H2O(g)的实验装置(如下图),其中正确的是
A.①④ B.②③ C.①③ D.②④
6 种二甲苯一溴代物的熔点/℃ 234 206 213.8 204 214.5 205
对应还原的二甲苯的熔点/℃ 13 -54 -27 -54 -27 -54
2019 年高三年级 10 月联考 化学试卷(共 6 页) 第 2 页
AlCl3 溶液中滴加 NaHCO3 溶液
MgCl2 溶液中滴加 NaOH 溶液
A.W 和 Z 分别形成的含氧酸均不止一种
B.X 和其他三种元素分别形成的二元化合物均不止一种
C.Y 的氧化物均是碱性氧化物
D.Z 的常见氧化物均是酸性氧化物
11、下列“实验操作和现象”与“结论”对应关系正确的是
实验操作和现象 结论
A 将含铁的氧化物的砖块用盐酸浸取,浸取液能使 KMnO4
溶液褪色 浸取液中含 Fe2+离子
B 常温下,测得饱和 Na2CO3 溶液的 pH 大于饱和 NaHCO3
溶液的 pH
常温下水解程度
CO3
2->HCO3
-
C 25℃时,向 AgNO3 溶液中滴加足量 NaCl 溶液至不再产
生沉淀,然后再滴加 KI 溶液,有黄色沉淀产生 25℃时,Ksp(AgCl)> Ksp(AgI)
D 将 NH4NO3 固体溶于水,溶液温度明显降低 NH4
+的水解是吸热反应
12、已知反应 4HCl(g)+O2(g) = 2Cl2(g)+2H2O(g) △H=-116.5 kJ/mol,O=O 键能:498
kJ/mol,Cl-Cl 键能:243 kJ/mol,则 H—O 键与 H—Cl键键能相差约为
A.26 kJ/mol B.32 kJ/mol C.35 kJ/mol D.93 kJ/mol
13、已知 2Fe3++2I-=2Fe2++I2 2Fe2++Br2=2Fe3++2Br-。下列反应的离子方程式(充分反应,
不考虑 Cl2 与 H2O 的反应),正确的是
A.0.05 mol Cl2 通入 100 mL 1 mol / L FeBr2 溶液中 2Br-+Cl2=Br2+2Cl-
B.0.10 mol Cl2 通入 100 mL 1 mol / L FeBr2 溶液中 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C.0.05 mol Cl2 通入 100 mL 1 mol / L FeI2 溶液中 2Fe2++Cl2=2Fe3++2Cl-
D.0.10 mol Cl2 通入 100 mL 1 mol / L FeI2 溶液中 2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
全,并用如图所示装置测量生成 O2 的体积。为了较准确地....测量出生成的 O2 在常温、常压下
的体积,有如下操作步骤:
①将导气管放入盛满水的量筒内;
②给药品加热;
③有连续气泡产生时开始收集气体;
④取出导气管;
⑤反应完全后停止加热(如图,此时导气管出口略高于液面);
⑥冷却至室温;
⑦调整量筒内外液面高度使之相同后读出量筒内气体体积数。
正确的操作顺序是
A.①②⑤⑥⑦④ B.①②③⑤④⑦ C.②③⑤④⑥⑦ D.②③⑤⑥⑦④
15、标准状况下,容器 A 装满 CO2 时重 94.6 g,装满 SO2 时重 97.6 g,装满某未知气体时重
96.4 g,则该未知气体可能是
A.CO B.HCl C.C3H8 D.C4H8
16、一种气态烷烃和一种气态烯烃的混合物 1.0 体积,在氧气中充分燃烧,生成 2.0 体积的
CO2 和 2.6 体积的水蒸气(相同条件下),则混合物中烷烃和烯烃的体积比是
A.3∶1 B.1∶3 C.2∶3 D.3∶2
2019 年高三年级 10 月联考 化学试卷(共 6 页) 第 3 页
14、取一定质量的 KClO3 与 MnO2 混合物放入如图所示的大试管中,充分加热,直至反应完
二、非选择题(本题含 5 小题,共 52 分)
17、(10 分)下图为实验室制取纯净 N2 的发生装置,因反应较为剧烈,反应一会儿后需撤去酒
精灯。
⑴该反应的化学方程式为: 。
该反应中,氧化产物和还原产物的质量比为 。
⑵A 装置中分液漏斗上的导管的作用是___________________________________________
___________________,B 装置的作用是______________________________________。
⑶工业上常用分离液态空气的方法制取 N2。该方法获得的 N2 的密度 (填“大于”、
“等于”或“小于”)实验室制得 N2 的密度,原因是
。
⑷在空气中点燃镁条,生成的产物主要是 (填含镁化合物的化学式,下同),
同时还含有微量的 ,产生该结果的主要原因是 。
该微量含镁化合物与足量稀盐酸反应的化学方程式是_________________________________。
18、(8 分)A、B、C、D 是中学化学的常见物质,其中 A、B、C 均含有同一种元素。在一定
条件下相互转化的关系如下图所示(部分反应产物已略去)。
请根据要求完成下列问题:
(1)若 A 可用于制取漂白粉,D 是生产、生活中用量最大、用途最广的金属单质,则实验
室制取 A 的离子方程式为 ,工业上常
用 B 的溶液刻蚀铜制印刷线路板,该反应的化学方程式是_____________________________。
(2)若 D 是氯碱工业的产品,B 是两性氢氧化物,则反应②的离子方程式是:
。
2019 年高三年级 10 月联考 化学试卷(共 6 页) 第 4 页
(3)若 A 是某强酸的稀溶液,则反应①的化学方程式是________________________________。
(4)若 A、C、D 都是常见气体,C 是形成酸雨的主要有害气体,则反应③的化学方程式是:
。
(5)若 A、B、C 的焰色都呈黄色,D 是气态酸性氧化物,则 D 可能是_______或________(填
化学式),鉴别这两种气体可选用试剂________________________(填写一种即可)。
19、(12 分)450℃时,在容积为 2 L 的恒容密闭容器中发生反应: A(g)+2B(g) C(g)
+D(g) ΔH。回答下列问题:
(1)若反应温度不变,能说明该反应已达化学平衡状态的是________。
A.c (A)∶c (B)∶c (C)∶c (D)=1∶2∶1∶1
B.混合气体的密度不变化
C.混合气体的平均相对分子质量不变化
D.混合气体的压强不发生变化
E.反应速率 v(C)正∶v(B)逆=1∶2
(2)若反应物的起始浓度分别为:c(A)=1 mol/L,c(B)=2.4 mol/L,在 450℃反应达到平衡
时 A 的转化率为 60%,则 B 的转化率为 ,在 450℃时该反应的平衡常数
K= 。
(3)若反应温度不变,反应物的起始浓度分别为 c (A)=2.8 mol·L-1,c (B)= a mol·L-1,
达到平衡后 c(C)=2 mol·L-1,则 a= mol·L-1。(已知 =1.414)
(4))若反应温度不变,实验测得某一时刻反应混合物中各组分的物质的量如下表:
组 分 A B C D
物质的量/mol 3 2 2 3
此时反应速率 v 正 v 逆(填“>”、“<”或“=”)
⑸若在 550℃时,该反应的平衡常数为 0.50,则 ΔH 0 (填“>”、“ <”或“=”)。
20、(12 分)Na2S2O3•5H2O(相对分子质量 248)俗称大苏打,是重要的化工原料。用 Na2SO3 和
硫粉在水溶液中加热反应,可以制得 Na2S2O3。现取 15.1 g Na2SO3 溶于 80.0 mL 水。另取 5.00
g 硫粉,用少许乙醇润湿后,再加到上述溶液中。用小火加热至微沸,反应约 1 h 后过滤。滤
液在 100℃经蒸发、浓缩、冷却至 10℃后析出 Na2S2O3·5H2O 晶体。
⑴加入的硫粉用乙醇润湿的目的是 。
2019 年高三年级 10 月联考 化学试卷(共 6 页) 第 5 页
⑵反应 1 h 后过滤,其目的是 。
⑶滤液中除 Na2S2O3 和可能未反应完全的 Na2SO3 外,最可能存在的无机杂质是 。
它是由 而产生的。如果滤液中该杂质的含量不很低,其检测的方法是:
________________________________________________________________________________
___________________________________________________________________。
⑷为了检测产品的纯度,称取 8.40 g 产品,配制成 250 mL 溶液,每次取 25.00 mL 于锥形瓶
中,滴加 作指示剂,用浓度为 0.0500 mol/L 的碘水滴定(已知 2Na2S2O3+I2=
Na2S4O6+2NaI),滴定结果如下:
滴定次数 滴定前读数(mL) 滴定后读数(mL)
第一次 0.30 35.28
第二次 0.37 36.47
第三次 1.10 36.12
则所得产品的纯度为 ,你认为影响纯度的主要原因是(不考虑操作引起的误差)
________________________________________________________________________。
21、(10 分)为了测定硫酸钾铬矾 xK2SO4·yCr2(SO4)3·zH2O 的化学式,现制得含该被研究的物
质 99.8 g 的溶液 1 L。取此溶液 200 mL,用过量的 Ba(NO3)2 溶液处理,生成 18.64 g 沉淀。
再取此溶液 200 mL,用过量氨水处理,生成 4.12 g Cr(OH)3 沉淀。求:
⑴200 mL 溶液中 n[Cr2(SO4)3]
⑵200 mL 溶液中 n(K2SO4)
⑶硫酸钾铬矾的化学式
2019 年高三年级 10 月联考 化学试卷(共 6 页) 第 6 页
2019 年高三年级 10 月联考化学参考答案及评分标准
一、选择题(每小题 3 分,共 48 分)
题
号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
答
案 B A D C A C C C A B C B B A D D
17、(满分 10 分)
⑴NH4Cl + NaNO2 N2↑+NaCl+2H2O 1∶1
⑵平衡压强,使分液漏斗中的液体能顺利滴下 使水蒸气冷凝
⑶大于 工业制法获得的 N2 中含有密度较大的稀有气体
⑷MgO Mg3N2 O2 比 N2 活泼 Mg3N2+8HCl=3MgCl2+2NH4Cl
(每空 1 分,共 10 分)
18、(满分 8 分)
⑴ MnO2+4H++2Cl- Mn2++Cl2↑+2H2O 2FeCl3+Cu=2FeCl2+CuCl2
⑵Al(OH)3 + OH―=AlO2― +2H2O 或 Al(OH)3 + OH―=[Al(OH)4]―
⑸CO2 SO2 品红溶液(或酸性 KMnO4 溶液、溴水、FeCl3 溶液等)
(每空 1 分,共 8 分)
19、(满分 12 分)
(1)CDE (2)50% 0.625(或 0.63)
(3)6.8(或 6.83 或 6.828) (4)< ⑸<
(每空 2 分,共 12 分)
20、(满分 12 分)
⑴使硫粉与溶液充分接触,提高反应速率(2 分)
⑵除去过量的硫粉 (1 分)
⑶Na2SO4(1 分);由 Na2SO3 被空气氧化(1 分);
取出少许溶液,加稀盐酸至酸性后,过滤除去 S,再加 BaCl2 溶液,若有
白色沉淀生成,则证明含有 Na2SO4 (2 分)
⑷淀粉溶液(1 分);103.3%(2 分);
含有的 Na2SO3 也会和 I2 发生反应,从而影响纯度。(2 分)
21、(满分 10 分)
⑴n[Cr (OH)3]=4.12 g÷103 g/mol=0.04 mol,∴n[Cr2(SO4)3]=0.02 mol
(3 分)
⑵n(SO42-)=18.64 g÷233 g/mol=0.08 mol
∴n(K2SO4)= 0.08 mol-0.02 mol×3=0.02 mol (3 分)
⑶
n(K2SO4)∶n[Cr2(SO4)3] ∶n(结晶水)=0.02 mol∶0.02 mol∶0.48 mol=
1∶1∶24
∴该硫酸钾铬矾的化学式为 K2SO4·Cr2(SO4)3·24H2O (4 分)
△
△
⑶Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O(其他合理给分)
⑷SO2 + 2H2S=3S↓+ 2H2O
相关文档
- 高一物理期中试卷(2017.11)2021-07-096页
- 山东省泰安四中2018-2019学年高二2021-07-097页
- 天津市武清区等五区县2016-2017学2021-07-0921页
- 化学卷·2018届甘肃省兰州一中高二2021-07-0915页
- 2018-2019学年湖北省黄石二中高一2021-07-097页
- 甘肃省玉门一中2018-2019学年高二2021-07-0912页
- 内蒙古杭锦后旗奋斗中学2018-20192021-07-099页
- 辽宁省大连市旅顺口区2018-2019学2021-07-0910页
- 2019-2020学年安徽省合肥九中高一2021-07-097页
- 化学·福建省泉州市南安市柳城中学2021-07-0917页