- 1.54 MB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第三单元
氧化还原反应
考点一 氧化还原反应的相关概念及电子转移的表示方法
1.判断正误,正确的画“√”,错误的画“
✕
”。
(1)有单质参加或有单质生成的化学反应一定是氧化还原反应
(
✕
)
(2)氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
(
✕
)
(3)某元素从游离态变为化合态,该元素可能被氧化也可能被还原
(
✕
)
(4)硝酸铜的分解产物可能是CuO、NO、NO
2
(
✕
)
(5)NaHCO
3
+H
2
HCOONa+H
2
O的反应中,NaHCO
3
被氧化
(
✕
)
(6)Na
2
O
2
与水的反应中,水是还原剂
(
✕
)
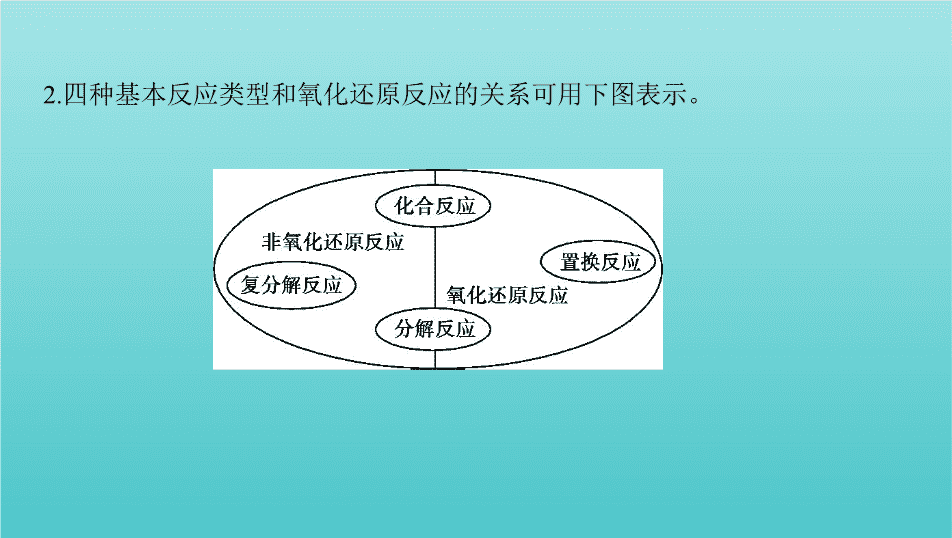
2.四种基本反应类型和氧化还原反应的关系可用下图表示。
判断正误,正确的画“√”,错误的画“
✕
”。
(1)置换反应一定属于氧化还原反应
(
√
)
(2)复分解反应一定不属于氧化还原反应
(
√
)
(3)有单质参加的化合反应或分解反应一定是氧化还原反应
(
√
)
(4)无单质参加的化合反应一定不是氧化还原反应
(
✕
)
1.氧化还原反应
2.相关概念及其关系
例如,反应MnO
2
+4HCl(浓)
MnCl
2
+Cl
2
↑+2H
2
O中,氧化剂是⑦
MnO
2
,
还原剂是⑧
HCl
,氧化产物是⑨
Cl
2
。生成1 mol Cl
2
时转移的电子数
目为⑩
2
N
A
,被氧化的HCl的物质的量是
2 mol
,HCl表现出的性质
是
还原性
和
酸性
。
3.氧化还原反应中电子转移的表示方法
(1)双线桥法
请用双线桥法表示Cu与稀硝酸反应:
。
(2)单线桥法
请用单线桥法表示Cu与稀硝酸反应:
3Cu(NO
3
)
2
+2NO↑+4H
2
O
。
4.常见的氧化剂和还原剂
(1)常见的氧化剂
物质类型
实例
还原产物
活泼的非金属单质
卤素单质X
2
X
-
O
2
O
2-
、
元素处于高价时的物质
KMnO
4
(H
+
)
Mn
2+
HNO
3
NO、NO
2
浓硫酸
SO
2
Fe
3+
Fe
2+
、Fe
某些氧化物和过氧化物
MnO
2
Mn
2+
H
2
O
2
H
2
O
(2)常见的还原剂
物质类型
实例
氧化产物
活泼的金属单质
Na、Fe、Al
Na
+
、Fe
2+
或Fe
3+
、Al
3+
某些非金属单质
H
2
、C、S
H
+
、CO或CO
2
、SO
2
变价元素中低价态化合物或离子
氧化物
CO
CO
2
SO
2
SO
3
或S
氢化物
NH
3
N
2
或
NO
H
2
S
S或SO
2
离子
S
S
Fe
2+
Fe
3+
I
-
I
2
(3)具有中间价态的物质既有氧化性,又有还原性
其中Fe
2+
、S
主要表现
还原
性,H
2
O
2
主要表现
氧化
性。
具有中间价态的物质
氧化产物
还原产物
Fe
2+
Fe
3+
Fe
S
S
S
H
2
O
2
O
2
H
2
O
题组一 氧化还原反应及基本概念判断
1.(2020浙江1月选考,4,2分)反应MnO
2
+4HCl(浓)
MnCl
2
+Cl
2
↑+2H
2
O中,
氧化产物是
(
D
)
A.MnO
2
B.HCl
C.MnCl
2
D.Cl
2
解析
在此反应中,MnO
2
是氧化剂,HCl是还原剂,MnCl
2
是还原产物,Cl
2
是
氧化产物。
2.(2019浙江宁波中学月考)为了确定某样品是否被氧化,所选试剂(括号内物
质)不正确的是
(
D
)
A.FeCl
2
(NH
4
SCN溶液) B.KI(淀粉溶液)
C.白磷(紫色石蕊溶液) D.Na
2
SO
3
(BaCl
2
溶液)
解析
亚铁离子易被氧化为铁离子,可利用NH
4
SCN溶液检验铁离子,若
溶液变为血红色则确定样品被氧化,故A正确;碘离子能被氧化为碘单质,淀粉
遇碘变蓝,可利用淀粉溶液来确定KI是否被氧化,故B正确;白磷能被氧化为五
氧化二磷,遇水反应生成磷酸,使紫色石蕊溶液变红,可以确定样品是否被氧
化,故C正确;亚硫酸根离子能被氧化为硫酸根离子,亚硫酸根离子和硫酸根离
子都能与钡离子反应生成沉淀,不能确定样品是否被氧化,故D错误。
名师点拨
氧化还原反应的有关概念及其关系
题组二 双线桥法在复杂氧化还原反应中的应用
3.(2019浙江杭州师范大学附中月考)LiAlH
4
是重要的储氢材料,可与水发生反
应:LiAlH
4
+2H
2
O
LiAlO
2
+4H
2
↑。下列说法中正确的是
(
A
)
A.氢气既是氧化产物又是还原产物
B.LiAlH
4
既是氧化剂又是还原剂
C.若生成标准状况下4.48 L H
2
,则转移0.4 mol电子
D.还原剂与氧化剂的物质的量之比为2∶1
解析
由化学方程式可知,LiAlH
4
中H元素由-1价升高为0价,被氧化,H
2
O
中H元素由+1价降为0价,被还原,氢气既是氧化产物又是还原产物,A项正确;
LiAlH
4
中H元素由-1价升高为0价,被氧化,是还原剂,B项错误;由化学方程式
可知,每1 mol LiAlH
4
反应,转移4 mol电子,生成4 mol H
2
,若生成标准状况下4.4
8 L(即0.2 mol)H
2
,则转移0.2 mol电子,C项错误;LiAlH
4
为还原剂,水为氧化剂,
还原剂与氧化剂的物质的量之比为1∶2,D项错误。
4.(2019浙江诸暨二中检测)O
2
F
2
可以发生反应:H
2
S+4O
2
F
2
SF
6
+2HF+4O
2
,
下列说法正确的是
(
D
)
A.氧气是氧化产物
B.O
2
F
2
既是氧化剂又是还原剂
C.若生成4.48 L HF,则转移0.8 mol电子
D.还原剂与氧化剂的物质的量之比为1∶4
解析
A项,氧元素的化合价由+1价降低到0价,被还原,得到的氧气为还
原产物;B项,O
2
F
2
是氧化剂;C项,因未指明气体所处的温度和压强,故无法确定
4.48 L HF的物质的量,则无法确定转移电子的物质的量;D项,由化学方程式
知还原剂与氧化剂的物质的量之比为1∶4。
方法技巧
走好关键第一步——正确标出元素化合价
正确分析氧化还原反应中电子转移的数目,其前提是确定物质中各元素(特别
是变价元素)的化合价。基本方法是先标出熟悉元素的化合价,再根据化合物
中各元素正、负化合价的代数和为零的原则求解其他元素的化合价。常见
元素的化合价可以借助化合价口诀来记忆:一价氢、钾、钠、氟、氯、溴、
碘、银;二价氧、钙、钡、镁、锌;三铝、四硅、五价磷;说变价也不难,二三
铁、二四碳、二四六硫都齐全;铜汞二价最常见。
一些特殊物质中元素化合价的判断
CuFeS
2
:Cu
+2
Fe
+2
S
-2
K
2
FeO
4
:Fe
+6
Li
2
NH:N
-3
LiNH
2
:N
-3
AlN:N
-3
Na
2
S
2
O
3
:S
+2
N
:N
+5
C
2
:C
+3
HCN:C
+2
N
-3
CuH:Cu
+1
H
-1
Fe
:Fe
+(8-
n
)
Si
3
N
4
:Si
+4
N
-3
考点二 氧化还原反应规律及应用
1.判断正误,正确的画“√”,错误的画“
✕
”。
(1)强氧化剂与强还原剂混合不一定能发生氧化还原反应
(
√
)
(2)阳离子只有氧化性,阴离子只有还原性
(
✕
)
(3)元素的非金属性越强,其氧化性越强,相应单质越活泼
(
✕
)
(4)难失电子的物质一定易得电子
(
✕
)
(5)含有最高价元素的化合物一定具有强氧化性
(
✕
)
(6)MnO
2
不与稀盐酸反应是因为H
+
浓度小
(
✕
)
2.物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反
应温度等有关。现有下列各组物质:
①Cu与HNO
3
溶液 ②Cu与FeCl
3
溶液 ③Zn与H
2
SO
4
溶液 ④Fe与FeCl
3
溶
液 ⑤Cl
2
与NaOH溶液 ⑥Fe与HNO
3
溶液 ⑦Fe与H
2
SO
4
溶液 ⑧Na与O
2
(1)由于浓度不同而发生不同氧化还原反应的是
。(填序
号,下同)
(2)由于温度不同而发生不同氧化还原反应的是
。
(3)氧化还原反应不受浓度、温度影响的是
。
答案 (1)①③⑥⑦ (2)⑤⑥⑦⑧ (3)②④
1.守恒规律
氧化还原反应中有物质失电子必有物质得电子,且得电子总数①
等于
失
电子总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,
且化合价降低总数②
等于
升高总数。
应用:运用“守恒规律”可进行氧化还原反应方程式的配平,直接计算反应物
与产物或转移电子的数量关系。
2.强弱规律
氧化性③
较强
的氧化剂与还原性④
较强
的还原剂反应,生成还原性
⑤
较弱
的还原产物和氧化性⑥
较弱
的氧化产物。
应用:在适宜条件下,用氧化性较强的物质制备氧化性较弱的物质,或用还原
性较强的物质制备还原性较弱的物质,也可用于比较物质间氧化性或还原性
的强弱。
3.价态规律
元素处于⑦
最高
价态,只有氧化性;元素处于⑧
最低
价态,只有还原
性;元素处于⑨
中间
价态,既有氧化性又有还原性,但主要表现一种性
质。物质中若含有多种元素,其性质是这些元素性质的综合体现。
应用:判断元素或物质有无氧化性或还原性。
4.转化规律
氧化还原反应中,元素相邻价态之间的转化最容易;同种元素不同价态之间发
生反应,元素的化合价只⑩
靠近
而不
交叉
;同种元素
相邻
价态之间不发生氧化还原反应。
例如:
。
应用:判断氧化还原反应能否发生及表明电子转移情况。
5.先后规律
越易失去电子的物质,失去电子后就越
难
得到电子;越易得到电子的
物质,得到电子后就越
难
失去电子。一种氧化剂同时和几种还原剂相
遇时,与还原性最强的
优先
发生反应;同理,一种还原剂同时与多种氧
化剂相遇时,与氧化性最强的
优先
发生反应。如FeBr
2
溶液中通入Cl
2
时,发生离子反应的先后顺序为2Fe
2+
+Cl
2
2Fe
3+
+2Cl
-
、2Br
-
+Cl
2
Br
2
+2
Cl
-
。
应用:判断物质发生氧化还原反应的先后顺序;判断氧化还原反应中物质氧化
性、还原性的相对强弱;判断某氧化还原反应能否发生。
转化规律在两类反应中的体现
(1)归中反应
含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定
遵循“高价+低价→中间价”,而不会出现交叉现象。简记为“两相靠,不相
交”。
(2)歧化反应
含某种元素的物质发生氧化还原反应生成含该元素不同价态的物质时,该元
素的价态变化一定遵循“中间价态→高价态+低价态”,不会出现“一边
倒”的现象,即生成物中该元素的价态不能都比中间价态高或都比中间价态
低。
如:
题组一 依据方程式判断氧化性、还原性强弱
1.(2019浙江武义一中质量检测)已知常温下在溶液中可发生如下两个离子反
应:Ce
4+
+Fe
2+
Fe
3+
+Ce
3+
、Sn
2+
+2Fe
3+
2Fe
2+
+Sn
4+
,由此可以确定Fe
2+
、Ce
3+
、Sn
2+
三种离子的还原性由强到弱的顺序是
(
A
)
A.Sn
2+
、Fe
2+
、Ce
3+
B.Sn
2+
、Ce
3+
、Fe
2+
C.Ce
3+
、Fe
2+
、Sn
2+
D.Fe
2+
、Sn
2+
、Ce
3+
解析
在氧化还原反应中还原剂的还原性比还原产物的还原性强。由
题给离子方程式可知还原性:Fe
2+
>Ce
3+
,Sn
2+
>Fe
2+
。
2.(2019浙江余姚中学月考)铊(Tl)盐与氰化钾(KCN)被列为A级危险品。已知
下列反应在一定条件下能够发生:①Tl
3+
+2Ag
Tl
+
+2Ag
+
,②Ag
+
+Fe
2+
Ag+Fe
3+
,③Fe+2Fe
3+
3Fe
2+
,下列离子的氧化性由强到弱的顺序正确的是
(
D
)
A.Tl
3+
>Fe
3+
>Ag
+
B.Fe
3+
>Ag
+
>Tl
3+
C.Tl
+
>Ag
+
>Fe
2+
D.Tl
3+
>Ag
+
>Fe
3+
解析
在氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性
。
3.(2019浙江龙湾中学月考)氯气跟氢氧化钾溶液在一定条件下发生如下反
应:Cl
2
+KOH
KX+KY+H
2
O(未配平),KX在一定条件下能自身反应:KX
KY+KZ(未配平,KY与KZ的化学计量数之比为1∶3),KX、KY、KZ均
是一元酸的钾盐,由以上条件推知在KX中氯元素的化合价是
(
C
)
A.+1 B.+3 C.+5 D.+7
题组二 判断氧化还原反应能否发生
解析
反应Cl
2
+KOH
KX+KY+H
2
O是Cl
2
的歧化反应,KX、KY中的
氯元素分别显正价和-1价;由于KX也发生歧化反应:KX
KY+KZ,可断定
KY为KCl,则KZ中Cl元素的化合价>KX中Cl元素的化合价(均为正价)。假设
KX中Cl元素为+
a
价,KZ中Cl元素为+
b
价,依据化合价守恒规律及KX
KY
+3KZ,有
a
+1=3(
b
-
a
),把
a
=1、
a
=3、
a
=5代入上式讨论,可知
a
=5,
b
=7时符合题
意。则KX中Cl元素的化合价为+5价。
4.(2019浙江效实中学检测)已知Co
2
O
3
在酸性溶液中易被还原成Co
2+
,Co
2
O
3
、
Cl
2
、FeCl
3
、I
2
的氧化性依次减弱。下列反应在水溶液中不可能发生的是
(
A
)
A.3Cl
2
+6FeI
2
2FeCl
3
+4FeI
3
B.Cl
2
+FeI
2
FeCl
2
+I
2
C.Co
2
O
3
+6HCl(浓)
2CoCl
2
+Cl
2
↑+3H
2
O
D.2Fe
3+
+2I
-
2Fe
2+
+I
2
解析
根据氧化还原反应中,氧化性:氧化剂>氧化产物,可判断B中氧化
性:Cl
2
>I
2
,C中氧化性:Co
2
O
3
>Cl
2
,D中氧化性:Fe
3+
>I
2
,A、B、C中反应均可以发
生。A项,由于I
-
的还原性强于Fe
2+
,所以Cl
2
应先氧化I
-
,而不是Fe
2+
。
方法技巧
假设法判断氧化还原反应能否进行
已知物质的氧化性或者还原性的强弱关系,判断某一氧化还原反应能否发生
时可采用假设法。
先假设反应成立,然后根据氧化剂的氧化性>氧化产物的氧化性,还原剂的还
原性>还原产物的还原性的规律,列出假设反应中的上述关系,结合题干条件
判断该结论是否符合事实。若符合事实,则反应成立;反之,则不成立。
题组三 氧化还原反应的竞争(先后规律的应用
)
5.(2019浙江师范大学附中检测)向含
a
mol FeCl
3
的溶液中加入含
b
mol Fe 和
b
mol Cu的混合粉末,充分反应(忽略离子的水解),下列说法中,不正确的是
(
D
)
A.当
a
≤
2
b
时,发生的离子反应为2Fe
3+
+Fe
3Fe
2+
B.当2
b
≤
a
≤
4
b
时,反应中转移电子的物质的量
n
(e
-
)为2
b
mol
≤
n
(e
-
)
≤
4
b
mol
C.当2
a
=5
b
时,发生的总离子反应为10Fe
3+
+4Fe+Cu
14Fe
2+
+Cu
2+
D.当2
b
<
a
<4
b
时,反应后的溶液中
n
(Fe
2+
)∶
n
(Cu
2+
)=
(
a
-2
b
)∶(
a
+
b
)
解析
A项,由于还原性:Fe>Cu,所以当
a
≤
2
b
时(即Fe过量),发生的离子反
应为2F
+Fe
3Fe
2+
,正确;B项,根据反应2Fe
3+
+Fe
3Fe
2+
,2Fe
3+
+Cu
2Fe
2+
+Cu
2+
,当2
b
≤
a
≤
4
b
时,反应转移电子的物质的量为2
b
mol
≤
n
(e
-
)
≤
4
b
mol,正确;C项,
=
时,发生的离子反应为5Fe
3+
+2Fe+
Cu
7Fe
2+
+
Cu
2+
,即10Fe
3+
+4Fe+Cu
14Fe
2+
+Cu
2+
,正确;D项,
2Fe
3+
+Fe
3Fe
2+
2
b
b
3
b
2Fe
3+
+Cu
2Fe
2+
+ Cu
2+
a
-2
b
a
-2
b
所以
n
(Fe
2+
)∶
n
(Cu
2+
)=(3
b
+
a
-2
b
)∶
=(
a
+
b
)∶
,错误
。
6.(2019浙江舟山中学月考)向含有Fe
2+
、I
-
、Br
-
的溶液中通入适量氯气,溶液
中各种离子的物质的量变化如下图所示。有关说法不正确的是
(
B
)
A.线段BC代表Fe
3+
物质的量的变化情况
B.原混合溶液中
c
(FeBr
2
)=6 mol·L
-1
C.当通入Cl
2
2 mol时,溶液中已发生的离子
反应可表示为2Fe
2+
+2I
-
+2Cl
2
2 Fe
3+
+I
2
+4Cl
-
D.原溶液中
n
(Fe
2+
)∶
n
(I
-
)∶
n
(Br
-
)=2∶1∶3
解析
根据还原性:Br
-