- 909.00 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第1课时 价层电子对互斥理论
[明确学习目标] 1.认识共价分子结构的多样性和复杂性。2.能根据价层电子对互斥理论判断简单分子或离子的构型。
学生自主学习
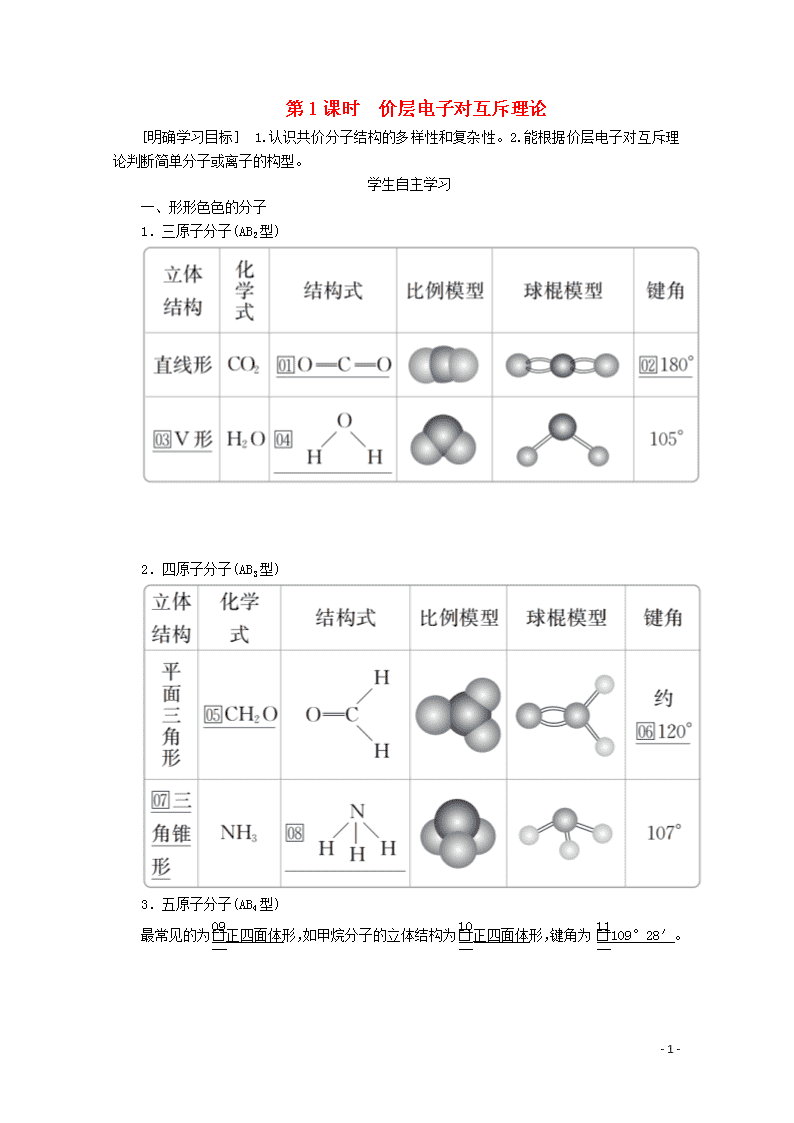
一、形形色色的分子
1.三原子分子(AB2型)
2.四原子分子(AB3型)
3.五原子分子(AB4型)
最常见的为正四面体形,如甲烷分子的立体结构为正四面体形,键角为109°28′。
- 10 -
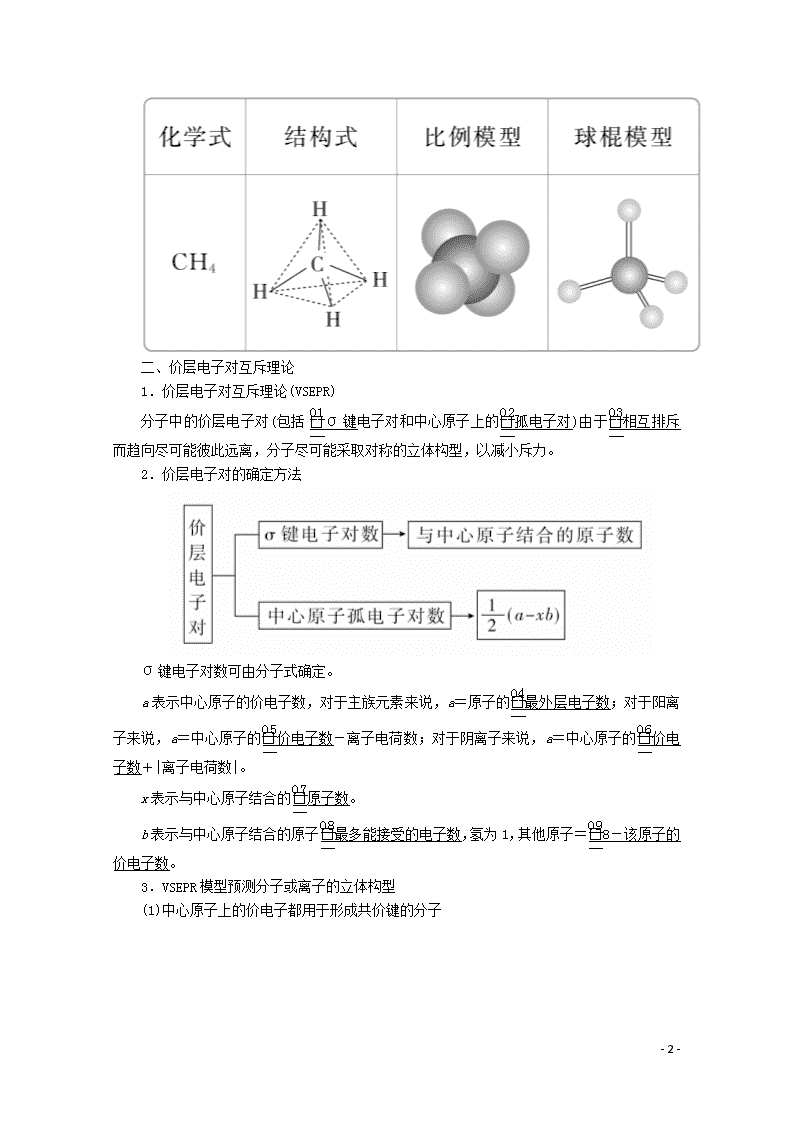
二、价层电子对互斥理论
1.价层电子对互斥理论(VSEPR)
分子中的价层电子对(包括σ键电子对和中心原子上的孤电子对)由于相互排斥而趋向尽可能彼此远离,分子尽可能采取对称的立体构型,以减小斥力。
2.价层电子对的确定方法
σ键电子对数可由分子式确定。
a表示中心原子的价电子数,对于主族元素来说,a=原子的最外层电子数;对于阳离子来说,a=中心原子的价电子数-离子电荷数;对于阴离子来说,a=中心原子的价电子数+|离子电荷数|。
x表示与中心原子结合的原子数。
b表示与中心原子结合的原子最多能接受的电子数,氢为1,其他原子=8-该原子的价电子数。
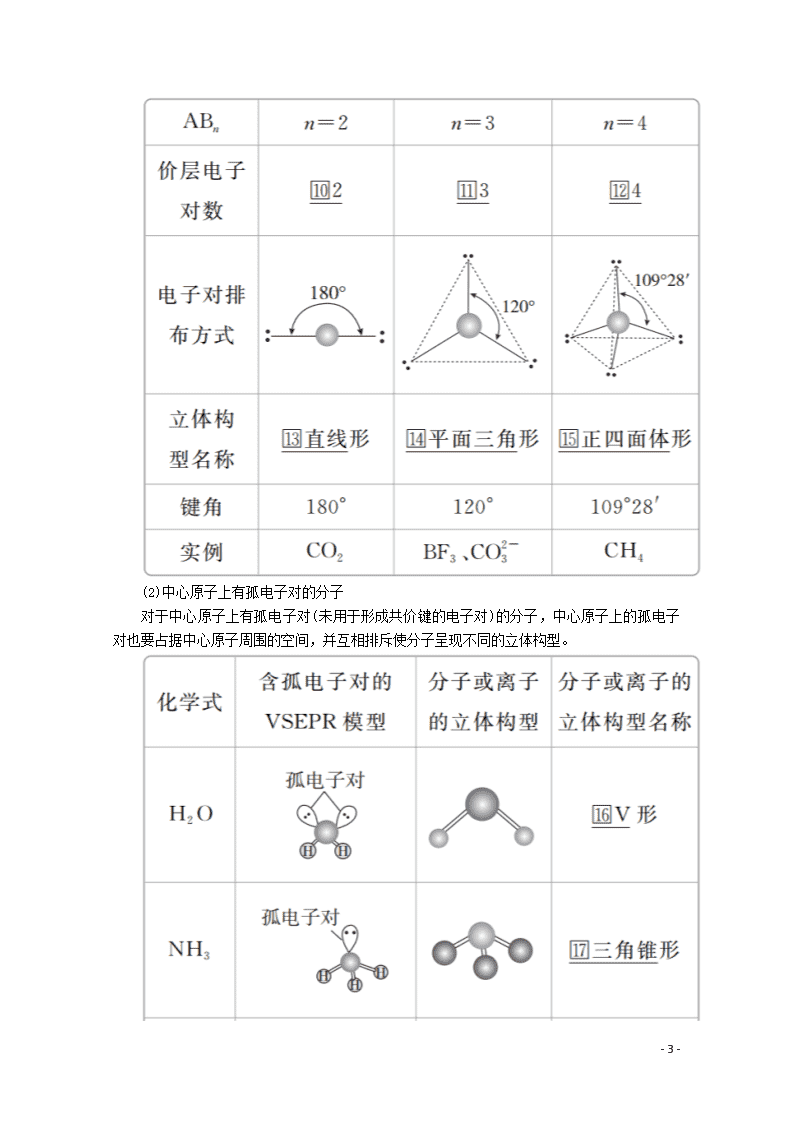
3.VSEPR模型预测分子或离子的立体构型
(1)中心原子上的价电子都用于形成共价键的分子
- 10 -
(2)中心原子上有孤电子对的分子
对于中心原子上有孤电子对(未用于形成共价键的电子对)的分子,中心原子上的孤电子对也要占据中心原子周围的空间,并互相排斥使分子呈现不同的立体构型。
- 10 -
1.五原子的分子空间构型都是正四面体吗?
提示:不是,只有中心原子所连四个键的键长相等时才为正四面体。如CH3Cl因C—H键和C—Cl键键长不相等,故CH3Cl分子的四面体不再是正四面体。
2.VSEPR模型和分子的立体构型二者相同吗?
提示:不一定相同。(1)VSEPR模型指的是包括σ键电子对和孤电子对在内的空间构型;分子的立体构型指的是组成分子的所有原子(只考虑分子内的σ键)所形成的空间构型。
(2)若分子中没有孤电子对,VSEPR模型和分子立体构型一致;若分子中有孤电子对,VSEPR模型和分子立体构型不一致。
3.如何计算SO2的成键电子对数、孤电子对数、价层电子对数?
提示:SO2分子中的中心原子是S,成键电子对数为2。
孤电子对数=(a-xb)=×(6-2×2)=1,
价层电子对数=2+1=3。
课堂互动探究
一、形形色色的分子
1.四原子分子不一定都是平面三角形或三角锥形。如白磷(P4)分子,四个磷原子位于正四面体的四个顶点,键角为60°。
2.AB4型分子或离子CX4(X为卤素原子或氢原子)、SiCl4、SiH4、NH、SiO属于正四面体构型,AB4型分子(如CH4)中的B原子被其他原子取代后仍为四面体形,但不一定是正四面体形结构。
3.记住一些常见分子的立体构型及键角,则可推测组成相似的其他分子的立体构型。 如CO2与CS2、H2O与H2S、NH3与PH3、CH4与CCl4等。
[即时练]
1.下列分子的立体结构模型正确的是( )
A.CO2的立体结构模型:
- 10 -
B.H2O的立体结构模型:
C.NH3的立体结构模型:
D.CH4的立体结构模型:
答案 D
解析 CO2的立体构型为直线形,A不正确;H2O的立体构型为V形,B不正确;NH3的立体构型为三角锥形,C不正确;CH4的立体构型为正四面体形,D正确。
2.下列分子的空间构型是平面三角形的是( )
A.P4 B.C2H2 C.BF3 D.CH3Cl
答案 C
规律方法
常见的立体构型为直线形的分子有BeCl2、HCN、C2H2、CO2等;常见的立体构型为V形的分子有H2O、H2S、SO2等;常见的立体构型为平面三角形的分子有BF3、SO3等;常见的立体构型为三角锥形的分子有PH3、PCl3、NH3等;常见的立体构型为正四面体形的分子有CH4、CCl4、SiH4、SiF4等;是四面体形但不是正四面体形的有CH3Cl、CH2Cl2、CHCl3等。记住常见分子的立体构型可类推出同类别物质的立体构型。
二、根据价层电子对互斥理论判断分子的立体构型
(1)对于ABn型分子,利用VSEPR理论预测分子立体构型的思路:价层电子对数=σ键电子对数+孤电子对数VSEPR模型分子的立体构型。如H2O和NH3的中心原子上的价层电子对数都是4,这些价层电子对相互排斥(中心原子上的孤电子对也要占据中心原子周围的空间,并参与相互排斥),形成四面体形的VSEPR模型,略去该模型中的中心原子上的孤电子对,便可得H2O分子呈V形,NH3分子呈三角锥形,如下图所示。
- 10 -
常见分子的VSEPR模型和分子的立体构型如下表所示:
- 10 -
(2)当ABn型分子的中心原子上的价电子都用于形成共价键时(如CO2、CH4分子中的碳原子),它们的立体构型也可用中心原子周围的原子数n来预测,概括如下:
[即时练]
3.用价层电子对互斥理论判断SO3的立体构型为( )
A.正四面体形 B.V形
C.三角锥形 D.平面三角形
答案 D
解析 SO3的中心原子硫原子的价电子数为6,与中心原子结合的原子数为3,氧原子最多能接受的电子数为2,则中心原子的孤电子对数=(6-3×2)=0,故价层电子对数=σ键电子对数=3,SO3的立体构型与其VSEPR模型一致,为平面三角形,故选D。
4.填写下列空白:
- 10 -
答案
本课归纳总结
分子空间构型的确定方法
价层电子对数=σ键电子对数+中心原子上的孤电子对数
VSEPR模型分子的立体构型。
学习效果检测
1.下列分子的空间构型是直线形的是( )
A.CH4 B.C2H2 C.BF3 D.H2O
答案 B
解析 CH4的空间构型是正四面体,BF3的空间构型是平面三角形,H2O的空间构型是V形。
2.下列关于价电子对互斥理论的叙述不正确的是( )
A.价电子对互斥理论可用来预测分子的空间构型
- 10 -
B.分子中中心原子的价电子对的相互排斥作用决定了分子的空间构型
C.中心原子上的孤电子对不参与相互排斥作用
D.分子中键角越大,价电子对之间的斥力越小,分子越稳定
答案 C
解析 中心原子上的孤电子对会占据中心原子周围的空间,并参与相互排斥作用。
3.下列常见分子的立体构型最相近的是( )
A.CO2和SO2 B.CH4和NH3
C.CH2O和BCl3 D.H2O和BeCl2
答案 C
解析 CO2和SO2的立体构型分别为直线形和V形,A错误;CH4和NH3的立体构型分别为正四面体形和三角锥形,B错误;CH2O和BCl3的立体构型均为平面三角形,其中后者为正三角形,C正确;H2O和BeCl2的立体构型分别为V形和直线形,D错误。
4.已知:①CS2 ②PCl3 ③H2S ④CH2O ⑤H3O+ ⑥NH ⑦BF3 ⑧SO2。请回答下列问题:
(1)中心原子没有孤电子对的是________(填序号,下同)。
(2)立体构型为直线形的分子或离子有________;立体构型为平面三角形的分子或离子有________。
(3)立体构型为V形的分子或离子有________。
(4)立体构型为三角锥形的分子或离子有________。立体构型为正四面体形的分子或离子有________。
答案 (1)①④⑥⑦ (2)① ④⑦ (3)③⑧
(4)②⑤ ⑥
解析 ①CS2的中心原子的价电子对数=2+=2,不含孤电子对,故为直线形;②PCl3的中心原子的价电子对数=3+=4,含1对孤电子对,故为三角锥形;③H2S的中心原子的价电子对数=2+=4,含2对孤电子对,故为V形结构;④CH2O的中心原子的价电子对数为3,不含孤电子对,故为平面三角形;⑤H3O+的中心原子的价电子对数=3+=4,含1对孤电子对,故为三角锥形;⑥NH的中心原子的价电子对数=4+=4,不含孤电子对,故为正四面体形;⑦BF3的中心原子的价电子对数=3+=3,不含孤电子对,故为平面三角形;⑧SO2的中心原子的价电子对数=2+=3,含1对孤电子对,故为V形结构。
- 10 -
- 10 -
相关文档
- 高中化学第二章分子结构与性质3-22021-08-0616页
- 2019届一轮复习人教版分子结构与性2021-08-0610页
- 高中化学第二章分子结构与性质第三2021-08-065页
- 2020高中化学 第一章 原子结构与性2021-07-093页
- 高考化学第一轮复习课件第2讲 分2021-07-094页
- 高二化学第2章 分子结构与性质 章2021-07-098页
- 化学高考一轮复习课件:第13章 第2讲2021-07-0950页
- 备战2021 高考化学 加餐练34 分子2021-07-096页
- 2020届高考化学一轮复习分子结构与2021-07-0922页
- 2020届高考化学一轮复习分子结构与2021-07-0931页