- 784.50 KB
- 2021-08-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
2
节 铝 金属材料
学习目标
第
1
课时 铝 金属材料
1.
了解
铝的物理性质和化学性质
。
2.
了解铝的用途
铝
联想
·
质疑
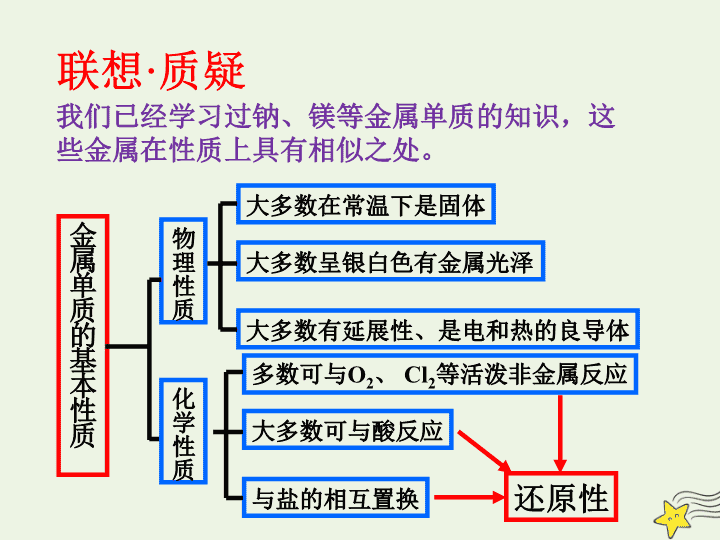
金属单质的基本性质
物理性质
化学性质
大多数在常温下是固体
大多数呈银白色有金属光泽
大多数有延展性、是电和热的良导体
多数可与
O
2
、
Cl
2
等活泼非金属反应
大多数可与酸反应
与盐的相互置换
还原性
我们已经学习过钠、镁等金属单质的知识,这些金属在性质上具有相似之处。
银白色金属光泽的轻金属
良好的延展性、导电性和导热性
一、铝的物理性质
-
3
e
-
Al
3+
+13
8
2
分析结构 推测性质
铝比较活泼,具有
还原性
Al
+13
8
2
3
根据金属活动性顺序表,铝比铁活泼,但铝为什么却不像铁那样容易被空气腐蚀
?
思考与探究
1
、
常温下,铝在空气中会发生氧化产生
致密氧化膜,保护铝不再被氧气氧化
。
加热时,铝在纯氧中燃烧、铝与氯气、硫等非金属反应
2Al+3Cl
2
=
2AlCl
3
点燃
2Al+3S
=
Al
2
S
3
加热
二、铝的化学性质
2
、与水反应
2Al+6H
2
O===2Al(OH)
3
↓
+3H
2
↑
(了解)
Al
与冷水不反应,可以在沸水中发生缓
慢反应
将两张滤纸都折漏斗状,套在一起,使四周都有四层。取出内层,在底部剪一个孔,用
水
润湿,再和另一个漏斗套在一起,架在铁圈上,下面放置盛沙的蒸发皿。
把炒干的
氧化铁粉末和铝粉
混合均匀,放在纸漏斗中,
上面加少量氯酸钾并在混合物中间插一根镁条
,用小木条引燃镁条,观察现象
。
3
、与某些金属氧化物反应
现象
2
Al +Fe
2
O
3
=====
高温
剧烈反应,发出耀眼的光芒,产生大量的烟,纸漏斗被烧穿,有红热液珠落下,液珠冷却后变为黑色。
2
Fe +Al
2
O
3
③哪些金属氧化物可以与铝粉发生类
似的反应
?
②
找出氧化剂、还原剂、氧化产物、
还原产物。
①
上述反应属于四种基本反应类型的
哪一类?
置换反应
铝热反应
铝在高温条件下和(
活泼性小于铝的
)金属氧化物发生的反应
铝热剂
铝粉和(活泼性小于铝的)金属氧化物的混合物
归纳总结
镁条、氯酸钾的作用?
放热提供能量;助燃剂
铝热反应的原理?
①
Al
在高温下表现出强还原性,把某些金属从它的氧化物中置换出来。
②
反应放热
铝热反应的应用:
焊接铁轨、定向爆破、冶炼难熔金属。
a)
与稀盐酸、稀硫酸发生置换反应
b)
常温下,铝遇
冷
浓硝酸、
冷
浓硫酸发生
钝化
反应(
钝化属于化学变化)
铝制槽罐用于浓硝酸运输
4
、与酸反应
2Al+6H
+
=
=
2Al
3+
+3H
2
↑
Al
与稀硝酸?
Al+4HNO
3
(
稀
)==Al(NO
3
)
3
+NO↑+2H
2
O
练一练
写出下列铝热反应的化学反应方程式
⑴ 铝与
MnO
2
反应
⑵铝与
Cr
2
O
3
反应
⑶铝与
Fe
3
O
4
反应
5
、与盐溶液的反应(如
与硫酸铜溶液)
2Al+3Cu
2+
==3Cu+2Al
3+
6
、铝与强碱反应
2Al+2NaOH+6H
2
O==2Na
[Al(OH)
4
]
+3H
2
↑
四羟基合铝酸钠
现象:铝溶解,产生气泡。
2Al+2NaOH+6H
2
O=2Na[Al(OH)
4
]+3H
2
↑
2Al+6HCl==2AlCl
3
+3H
2
↑
注意:
金属铝与酸、碱反应时放出氢气量的关系?
1
、酸碱过量,等量的铝产生的气体的物质的量之比?
2
、铝过量,等物质的量的酸、碱反应时产生的气体的
物质的量之比?
相关文档
- 2020版高中化学 第4章 材料家族中2021-08-064页
- 2020版高中化学 第4章 材料家族中2021-08-063页
- 2020版高中化学 第4章 材料家族中2021-08-064页
- 高中化学第4章材料家族中的元素单2021-07-0915页
- 新教材高中化学第四章材料家族中的2021-07-0815页
- 高中化学第4章材料家族中的元素第22021-07-078页
- 2021届(鲁科版)高考化学一轮复习材料2021-07-078页
- 2019届一轮复习鲁科版材料家族中的2021-07-0610页
- 2018版高考届一轮复习鲁科版第4章2021-07-0614页
- 2020版高中化学 第4章 材料家族中2021-07-053页