- 335.05 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
考点一 原子结构与化学键
考点清单
考点基础
1.原子的构成及各微粒之间的数量关系
(1)原子的构成
原子 X) (A
Z
( ):
( - ):
( ):
Z
A Z
Z
质子 个 决定① 元素的 种类原子核 中子 个 决定② 同位素的 种类
核外电子 个 最外层电子数决定③ 元素的化学
性质
(2)各微粒间的数量关系
X表示质量数为A、质子数为Z的一个原子。
a.核电荷数=核内质子数=原子核外电子数;
b.质量数(A)=质子数(Z)+中子数(N);
c.离子所带电荷数=|质子数-核外电子总数|。
A
Z
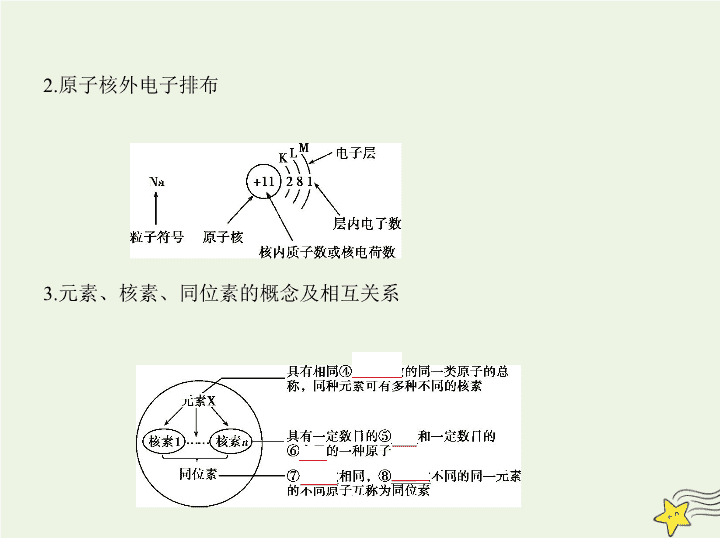
2.原子核外电子排布
3.元素、核素、同位素的概念及相互关系
4.化学键与分子间作用力
说明 (1)离子化合物中一定含有离子键,离子键只能存在于离子化合物
中。
(2)共价键可存在于离子化合物、共价化合物和单质中。
(3)熔融状态下能导电的化合物是离子化合物,如NaCl;熔融状态下不能导
电的化合物是共价化合物,如HCl。
考点二 元素周期律及其应用
考点基础
项目 同周期(左→右) 同主族(上→下)
原子
结构
核电荷数 逐渐增大 逐渐增大
电子层数 相同 逐渐增多
原子半径 逐渐减小(稀有气体元
素除外)
逐渐增大
离子半径 阳离子逐渐减小,阴离
子逐渐减小,r(阴离子)>
r(阳离子)
逐渐增大
性质 化合价 最高正化合价由+1→+
7(O、F除外),最低负化
合价=-(8-主族序数)(H
除外)
最高正化合价=主族序
数(O、F除外)
元素的金属性和非金
属性
金属性逐渐减弱
非金属性逐渐增强
(稀有气体元素除外)
金属性逐渐增强
非金属性逐渐减弱
离子的氧化性、还原
性
阳离子氧化性逐渐增
强
阴离子还原性逐渐减
弱
阳离子氧化性逐渐减
弱
阴离子还原性逐渐增
强
气态氢化物稳定性 逐渐增强 逐渐减弱
最高价氧化物对应的
水化物的酸碱性
碱性逐渐减弱
酸性逐渐增强
碱性逐渐增强
酸性逐渐减弱
考点三 元素周期表及其应用
考点基础
1.元素周期表的结构
: 2
: 8
: 8
(7 : 18
) : 18
: 32
: 32
: , 7
: , 7(18 : 8 9 10) 0
第一周期 ① 种 元素
短周期 第二周期 ② 种 元素
第三周期 ③ 种 元素周期
个 第四周期 ④ 种 元素
横行 第五周期 ⑤ 种 元素长周期 第六周期 ⑥ 种 元素
第七周期 ⑦ 种 元素
主族 由长周期和短周期元素共同构成 共⑧ 个 主族族 副族 完全由长周期元素构成 共⑨ 个 副族个 第Ⅷ族 第⑩ 、、 三 个纵行纵行
: 18
族 第� 纵 行
2.元素原子最外层电子数与族的关系
(1)最外层电子数为1~2的元素:ⅠA族、ⅡA族、副族、0族(He)。
(2)最外层电子数在3~7之间的元素一定是主族元素。
(3)最外层电子数为8的元素:0族(He除外)。
3.元素周期表的构成规律
(1)同构规律
稀有气体原子与同周期非金属元素的阴离子、下周期金属元素的阳离子,
具有相同的电子层结构。
(2)同主族序数差规律
a.ⅠA族元素随电子层数的增加,原子序数依次相差2、8、8、18、18、32;
b.ⅡA族元素随电子层数的增加,原子序数依次相差8、8、18、18、3
2;0族元素依次差8、8、18、18、32、32;
c.ⅢA~ⅦA族元素随电子层数的增加,原子序数依次相差8、18、18、32、
32。
(3)对角线关系
对角线元素(右图中的A与D)存在着相似性,如Li与Mg、Be与Al等,但只适
用于第二、三周期。这是由A、D的原子半径相近引起的。
方法1 元素金属性、非金属性强弱的比较
1.比较元素金属性强弱的方法
(1)金属与水(或非氧化性酸)的反应越容易,其对应元素的金属性越强。
(2)最高价氧化物对应水化物的碱性越强,则对应金属元素的金属性越强。
(3)在金属活动性顺序中,金属的位置越靠前,其金属性越强。
(4)同一周期,金属元素越靠前,其金属性越强;同一主族,金属元素越靠下,其
金属性越强。
(5)金属与盐溶液的置换反应,若A元素的单质能置换出B元素的单质,则A
元素的金属性强于B元素。
方法技巧
(6)一般金属阳离子的氧化性越强,则对应金属元素的金属性越弱。(注:氧
化性Fe3+>Cu2+>Fe2+,金属性Fe>Cu)
(7)电化学原理:不同金属形成原电池时,通常作负极的金属的金属性
强;通常在电解池中的阴极上先析出的金属的金属性弱。
2.比较元素非金属性强弱的方法
(1)非金属单质与H2越易化合,则其对应元素的非金属性越强。
(2)形成的氢化物越稳定,则其对应元素的非金属性越强。
(3)最高价氧化物对应水化物的酸性越强,其对应元素的非金属性越强。
(4)同一周期(稀有气体元素除外),非金属元素越靠右,其非金属性越强;同
一主族,非金属元素越靠上,其非金属性越强。
(5)非金属之间的置换反应,若A元素的单质能置换出B元素的单质,则A元
素的非金属性强于B元素。
方法2 微粒半径大小的比较
1.微粒半径大小的比较规律
原子半径 ①同一周期,随着原子序数递增,原子半径逐渐减
小(稀有气体元素除外)。如:
r(Na)>r(Mg)>r(Al)>r(Si)>r(P)>r(S)>r(Cl)
②同一主族,随着电子层数递增,原子半径逐渐增
大。如:
r(Li)r(Ca),r(Rb)>r(K),所以r(Rb)>r(Ca)
离子半径 ①同种元素的微粒半径:阴离子大于原子,原子大
于阳离子,低价阳离子大于高价阳离子。如:r(Cl-)>
r(Cl),r(Fe)>r(Fe2+)>r(Fe3+)
②电子层结构相同的离子,核电荷数越大,半径越
小。如:r(O2-)>r(F-)>r(Na+)>r(Mg2+)>r(Al3+)
③带相同电荷的离子,电子层数越多,半径越大。
如:r(Li+)r(Na+)>r(Mg2+)
2.“三看”法快速判断简单微粒半径大小
一看电子层数:最外层电子数相同时,电子层数越多,半径越大。
二看核电荷数:当电子层结构相同时,核电荷数越大,半径越小。
三看核外电子数:当核电荷数相同时,核外电子数越多,半径越大。
例 (2019湖南四校摸底,7)短周期主族元素R、X、Y、Z、M的原子序数
依次增大,它们位于三个周期。Y和M同主族,火山喷口附近或地壳的岩层
中存在游离态的M,X元素的最高价氧化物对应的水化物与其气态氢化物
相遇会有白烟生成。这五种元素组成一种离子化合物Q,取一定量Q溶于
蒸馏水得到溶液,向此溶液中滴加稀氢氧化钠溶液,产生沉淀的物质的量与
氢氧化钠溶液体积的关系如图所示。下列说法不正确的是 ( )
A.简单氢化物的沸点:Y>X
B.简单离子的半径:M>Y>Z
C.R与除Z以外的其他3种元素均能形成共价化合物
D.Y与其他4种元素均可形成至少两种二元化合物
解题导引 Al(OH)3溶于NaOH溶液;NH4Al(SO4)2属于复盐。
解析 短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们占
据三个周期,则R为H;Y和M同主族,火山喷口附近或地壳的岩层中存在游
离态的M,则M为S、Y为O;X元素的最高价氧化物对应的水化物与其气态
氢化物相遇会有白烟生成,则X为N;根据图像可知,生成的沉淀为Al(OH)3,
则Z为Al。滴加NaOH溶液,沉淀量不变时说明N 与OH-反应,则Q中一定
含有Al3+和N ,结合Al3+、N 消耗NaOH溶液的体积可推知Q应该为NH4
Al(SO4)2。H2O在常温下为液体,NH3在常温下为气体,故简单氢化物的沸
点:H2O>NH3,A项正确;S2-有3个电子层,O2-、Al3+均有2个电子层,电子层结
构相同时核电荷数越大,离子半径越小,故三种离子的半径:S2->O2->Al3+,B项
正确;H与N、O、S可分别形成共价化合物NH3、H2O、H2S,C项正确;O与
H可形成H2O、H2O2,O与N可形成NO、NO2、N2O4等,O与S可形成SO2、SO3,
但O与Al只能形成Al2O3,D项错误。
4H
4H
4H
答案 D
相关文档
- 广东省2021版高考化学一轮复习课时2021-08-0611页
- 2020版高考化学一轮复习原子结构与2021-07-0914页
- 2020届高考化学一轮复习原子结构与2021-07-0915页
- 2021届高考化学一轮复习原子结构与2021-07-0824页
- 2019届一轮复习人教版原子结构与化2021-07-089页
- 广东省2021版高考化学一轮复习第五2021-07-0856页
- 2021高考化学一轮复习专题十原子结2021-07-0723页
- 2020届高考化学一轮复习原子结构与2021-07-0623页
- 北京版2021高考化学一轮复习专题七2021-07-059页
- 2021高考化学一轮复习专题十原子结2021-07-0524页