- 444.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第15讲 化学实验
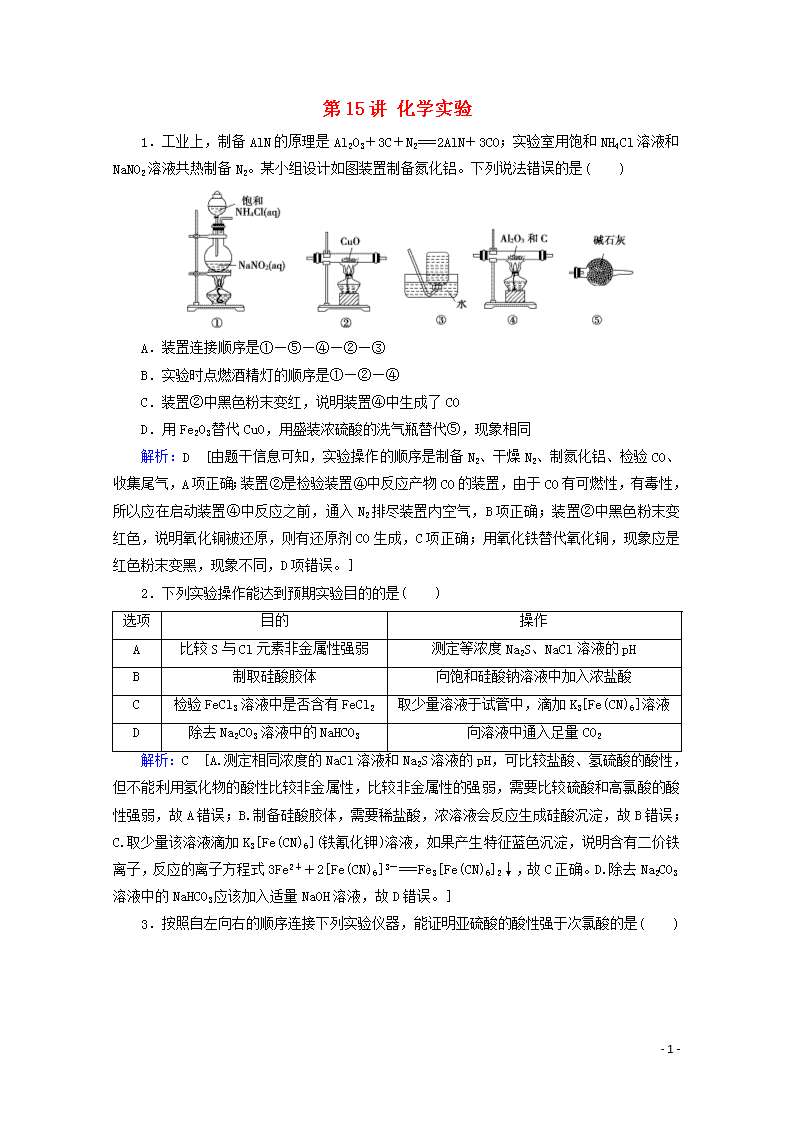
1.工业上,制备AlN的原理是Al2O3+3C+N2===2AlN+3CO;实验室用饱和NH4Cl溶液和NaNO2溶液共热制备N2。某小组设计如图装置制备氮化铝。下列说法错误的是( )
A.装置连接顺序是①—⑤—④—②—③
B.实验时点燃酒精灯的顺序是①—②—④
C.装置②中黑色粉末变红,说明装置④中生成了CO
D.用Fe2O3替代CuO,用盛装浓硫酸的洗气瓶替代⑤,现象相同
解析:D [由题干信息可知,实验操作的顺序是制备N2、干燥N2、制氮化铝、检验CO、收集尾气,A项正确;装置②是检验装置④中反应产物CO的装置,由于CO有可燃性,有毒性,所以应在启动装置④中反应之前,通入N2排尽装置内空气,B项正确;装置②中黑色粉末变红色,说明氧化铜被还原,则有还原剂CO生成,C项正确;用氧化铁替代氧化铜,现象应是红色粉末变黑,现象不同,D项错误。]
2.下列实验操作能达到预期实验目的的是( )
选项
目的
操作
A
比较S与Cl元素非金属性强弱
测定等浓度Na2S、NaCl溶液的pH
B
制取硅酸胶体
向饱和硅酸钠溶液中加入浓盐酸
C
检验FeCl3溶液中是否含有FeCl2
取少量溶液于试管中,滴加K3[Fe(CN)6]溶液
D
除去Na2CO3溶液中的NaHCO3
向溶液中通入足量CO2
解析:C [A.测定相同浓度的NaCl溶液和Na2S溶液的pH,可比较盐酸、氢硫酸的酸性,但不能利用氢化物的酸性比较非金属性,比较非金属性的强弱,需要比较硫酸和高氯酸的酸性强弱,故A错误;B.制备硅酸胶体,需要稀盐酸,浓溶液会反应生成硅酸沉淀,故B错误;C.取少量该溶液滴加K3[Fe(CN)6](铁氰化钾)溶液,如果产生特征蓝色沉淀,说明含有二价铁离子,反应的离子方程式3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓,故C正确。D.除去Na2CO3溶液中的NaHCO3应该加入适量NaOH溶液,故D错误。]
3.按照自左向右的顺序连接下列实验仪器,能证明亚硫酸的酸性强于次氯酸的是( )
- 8 -
A.①③②⑤④⑥ B.①③⑥⑤④
C.①②③⑥④⑤ D.①②⑥⑤④
解析:A [本题采用间接法证明亚硫酸的酸性强于次氯酸。③的作用是除去二氧化硫中的氯化氢,②的作用是证明亚硫酸的酸性大于碳酸,⑤的作用是除去二氧化硫,通过④中品红不褪色,⑥中出现白色沉淀即可证明碳酸的酸性强于次氯酸,从而间接证明亚硫酸的酸性强于次氯酸。]
4.下列有关仪器使用方法或实验操作正确的是( )
A.用胶头滴管向试管里滴加溶液,滴管都不能插入液面下
B.用向上排空气法可以收集NO气体
C.用pH试纸测定氯水的pH
D.乙醇和乙酸乙酯可用饱和Na2CO3溶液鉴别
解析:D [对有特殊要求的反应,如向FeSO4溶液中滴加NaOH溶液制Fe(OH)2。须将长胶头滴管插入液面下,避免空气中O2氧化Fe(OH)2,A错误;NO气体易于O2反应,不能用排空气法收集,B错误;氯水具有漂白性,不能用pH试纸测定其pH,C错误;乙醇可溶于碳酸钠溶液,而乙酸乙酯难溶于碳酸钠溶液,D正确。]
5.乙酸乙酯广泛用于药物、染料、香料等工业,某学习小组设计以下两套装置用乙醇、乙酸和浓硫酸分别制备乙酸乙酯(沸点77.2 ℃)。下列说法不正确的是( )
A.浓硫酸能加快酯化反应速率
B.不断蒸出酯,会降低其产率
C.装置b比装置a原料损失的少
D.可用分液的方法分离出乙酸乙酯
- 8 -
解析:B [A.乙酸与乙醇在浓硫酸作用下加热发生酯化反应,化学反应为:CH3COOH+C2H5OHCH3COOC2H5+H2O,该反应为可逆反应,浓硫酸吸水利于平衡向生成乙酸乙酯方向移动。故浓硫酸的作用为催化剂、吸水剂,浓硫酸能加快酯化反应速率,故A正确;B.该制备乙酸乙酯反应为可逆反应,不断蒸出酯,减少生成物浓度,有利于反应正向移动,会提高其产率,故B错误;C.乙醇、乙酸易挥发,甲装置则采取直接加热的方法,温度升高快,温度不易于控制,装置b采用水浴受热均匀,相对于装置a原料损失的少,故C正确;D.分离乙酸乙酯时先将盛有混合物的试管充分振荡,让饱和碳酸钠溶液中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,静置分层后取上层得乙酸乙酯,故D正确。]
6.某化学学习小组用如图所示装置制备、收集Cl2,并进行性质验证实验(夹持装置略去)。下列说法正确的是( )
A.用KMnO4和浓盐酸制备Cl2时,只选①
B.③用于Cl2收集时,b为进气口
C.④中加入NaBr溶液和CCl4,通入Cl2反应后振荡、静置,下层溶液呈橙红色
D.⑤中通入Cl2使品红溶液褪色后,取出溶液加热可恢复红色
解析:C [A.KMnO4和浓盐酸反应制备Cl2,①不可行,高锰酸钾可溶于水,氯气可以从长颈漏斗中逸出。选②可达到实验目的,A错误;B.排空气法收集氯气时,因氯气的密度比空气大,则应从a进气,B错误;C.Cl2的氧化性比Br2大,通入NaBr溶液中,会发生氧化还原反应生成Br2,进而被CCl4萃取在下层溶液中,显橙红色,C正确;D.Cl2能使品红溶液褪色,主要是发生了氧化还原反应,不可逆,因此取出溶液加热不能恢复红色,D错误。]
7.下列试剂的保存方法正确的是( )
A.硝酸银固体通常应密封保存于无色广口瓶中
B.疫苗一般应冷藏存放,以避免蛋白质变性
C.HF溶液通常应密封保存于细口玻璃瓶中
D.Na2SiO3溶液通常应密封保存于带玻璃塞的细口瓶中
解析:B [硝酸银见光易分解,应密封于棕色试剂瓶中,A项错误。疫苗中含有蛋白质,易变性,一般低温保存,B项正确。HF能与玻璃中的SiO2反应,应存放于塑料瓶中,C项错误。Na2SiO3溶液属于矿物胶,易把玻璃塞与瓶颈粘在一起,应存放于带橡胶塞的试剂瓶中,D项错误。]
- 8 -
8.已知:①在酸性溶液中Cr2+(蓝色)易被O2氧化,Cr3+(绿色)最稳定;②当Cr没有被钝化时,很容易将Cu、Sn等从它们的盐溶液中置换出来;③Cr溶于稀盐酸时生成蓝色溶液。下列叙述错误的是( )
A.Cr与盐酸反应生成的盐为CrCl3
B.CrCl2溶液在保存时需要加入少量铬
C.CrCl2溶液需要密闭保存
D.CrCl2溶液在空气中放置容易由蓝色变为绿色
解析:A [由“Cr溶于稀盐酸时生成蓝色溶液”可知,Cr与盐酸反应生成的盐为CrCl2,A项错误。因Cr2+易被O2氧化,CrCl2溶液在保存时加入少量铬可防止Cr2+被氧化,B项正确。因为Cr2+易被O2氧化,所以保存时需要密闭保存,C项正确。在溶液中Cr2+(蓝色)易被O2氧化为Cr3+(绿色),D项正确。]
9.已知:可用亚铜盐(CuCl)的氨水溶液或盐溶液来吸收混合气体中的CO,使其生成CuCl·CO·2H2O。下列气体的制备及收集实验能达到目的的是( )
选项
装置Ⅲ收集的气体
装置Ⅰ中
试剂a、b
装置Ⅱ中
试剂c
装置Ⅳ中
试剂d
A
SO2
浓硫酸
与铜片
浓硫酸
NaOH溶液
B
HBr
浓硫酸与
溴化钠
浓硫酸
水
C
Cl2(忽略水蒸气)
浓盐酸与
二氧化锰
饱和氯化
钠溶液
NaOH溶液
D
CO
浓硫酸与甲酸
浓硫酸
CuCl与氨水的混合液
解析:C [因为SO2易溶于NaOH溶液,装置Ⅳ中易产生倒吸现象,可用倒置的漏斗防倒吸,A项错误。浓硫酸具有强氧化性,HBr会被浓硫酸氧化为Br2,B项错误。甲酸为液态,不是固体,而且CO的密度与空气的相近,不宜用排空气法收集,D项错误。]
10.为探究硫酸亚铁的分解产物,将硫酸亚铁装入如图所示的装置a中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是( )
- 8 -
A.分解的气体产物中有SO3、SO2,应该先检验SO3
B.装置b中的试剂为Ba(NO3)2溶液,反应后有白色沉淀生成
C.装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2
D.装置d之后需要增加尾气处理装置
解析:A [硫酸亚铁高温下分解生成氧化铁、二氧化硫和三氧化硫;先把混合气体通入氯化钡溶液中,二氧化硫气体与氯化钡溶液不反应,三氧化硫气体与氯化钡溶液反应生成硫酸钡白色沉淀,因此分解的气体产物中应该先检验SO3,A正确。二氧化硫溶于水,溶液显酸性,酸性条件下,硝酸根离子将二氧化硫氧化为硫酸根离子,再与钡离子结合生成硫酸钡沉淀,所以无法判断使硝酸钡溶液出现白色沉淀的是SO2还是SO3,B错误。装置c中的试剂为酸性KMnO4溶液,作用是检验混合气体中的SO2,如果溶液褪色,证明存在SO2,C错误。装置d中装有氢氧化钠溶液,吸收多余的二氧化硫气体,因此装置d之后不需要增加尾气处理装置,D错误。]
11.实验室欲测定铁铝合金的组成,将铁铝合金溶解后,取试样25.00 mL,分离并测定Fe3+的浓度,实验方案设计如图所示。
已知:乙醚易挥发,易燃烧。
回答下列问题:
(1)常温下,将铁铝合金溶解的试剂是________(填标号)。
a.稀盐酸 B.稀硫酸
- 8 -
c.稀硝酸 D.浓硝酸
(2)已知氢氧化铁实际上是三氧化二铁的水合物,则通过称量氢氧化铁固体质量的方法来确定c(Fe3+)时,该方案理论上的主要缺点是____________________________________
________________________________________________________________________。
(3)操作X是________,操作X后检验溶液中是否有Fe3+残留的方法是_______________。
(4)蒸馏装置如图所示,装置中存在的错误是________________________________。
(5)将含Fe3+的溶液定容至100 mL需要的仪器是________________。
(6)已知滴定反应为Ce4++Fe2+===Ce3++Fe3+,当滴定达到终点时,消耗0.100 0 mol·L-1Ce(SO4)2溶液15.00 mL,则初始试样中c(Fe3+)=________。若改用稀硫酸酸化的K2Cr2O7溶液滴定含Fe2+的待测液,则该反应的离子方程式为________________________。
解析:(1)由流程图可知,合金溶解后溶液中存在的是Fe3+,所以加入的一定是氧化性酸,由于铁、铝在冷的浓硝酸中发生钝化,所以只能使用稀硝酸,c正确。(2)已知氢氧化铁实际上是三氧化二铁的水合物,所以该水合物的最大问题在于其n值不确定,所以通过称量氢氧化铁固体质量的方法来确定c(Fe3+)是不合理的。(3)乙醚是不溶于水的液体,所以操作X应该是分液。检验Fe3+的方法是滴加KSCN溶液,观察溶液颜色是否变为红色,如果显红色说明残留,否则无残留。(4)图示是蒸馏装置是完全封闭的装置,这样进行加热是很危险的。(5)将含Fe3+的溶液定容至100 mL,应该将溶液转移至100 mL容量瓶中,洗涤烧杯,加水定容,所以需要的仪器为100 mL容量瓶、烧杯、玻璃棒、胶头滴管。
(6)Ce(SO4)2的物质的量为15.00×0.1000÷1000=0.0015 (mol),则滴定消耗的Fe2+的物质的量为0.0015 mol,又实验是将Fe3+溶液定容为100 mL,取出25 mL与过量还原铁粉又得到Fe2+溶液,然后进行滴定,所以100 mL溶液中Fe2+的物质的量为0.0015×4=0.006(mol)。溶液中的Fe2+来自于反应Fe+2Fe3+===3Fe2+,所以原来Fe3+的物质的量为0.004 mol,这些Fe3+来自于25.00 mL试样,所以初始试样中c(Fe3+)=1000×0.004÷25=0.16(mol·L-1)。若改用稀硫酸酸化的K2Cr2O7溶液滴定含Fe2+的待测液,Cr2O被还原为Cr3+,离子方程式为Cr2O+6Fe2++14H+===6Fe3++2Cr3++7H2O。
答案:(1)c (2)氢氧化铁(Fe2O3·nH2O)没有固定的组成 (3)分液 从水溶液中取样,滴加少量KSCN溶液显红色说明有残留,否则无残留 (4)体系密闭
(5)100 mL容量瓶、烧杯、玻璃棒、胶头滴管
(6)0.16 mol·L-1 Cr2O+6Fe2++14H+===6Fe3++2Cr3++7H2O
- 8 -
12.氯化铵俗称卤砂,主要用于干电池、化肥制备等。某化学研究小组设计如下实验制备卤砂并进行元素测定。
Ⅰ.实验室用NH3和HCl气体在A中制备卤砂,所需装置如下。
(1)装置接口连接顺序是________→a;________→b。(装置可重复选用)
(2)C装置的作用是________________,D装置盛装的物质是________________。
(3)写出用上述装置制备氨气的一组试剂:__________________________________
_______________________________________________________________________。
Ⅱ.测定卤砂中Cl元素和N元素的质量之比。
该研究小组准确称取a g卤砂,与足量氧化铜混合加热,充分反应后把气体产物按下图装置进行实验。收集装置收集到的气体为空气中含量最多的气体,其体积换算成标准状况下的体积为VL,碱石灰增重b g。
(4)E装置内的试剂为________,卤砂与氧化铜混合加热反应的化学方程式为________________________。
(5)卤砂中Cl元素和N元素的质量之比为________(用含b、V的式子表示)。
(6)为了测定卤砂中氯元素的质量,他们设计的实验方案是将a g卤砂完全溶解于水,加入过量AgNO3溶液,然后测定生成沉淀的质量。请你评价该方案是否合理,并说明理由________________________________________________________________________
________________________________________________________________________。
解析:Ⅰ.(1)制取氯化铵,可以由氨气和氯化氢反应制备,应该选用B装置分别制备氨气和氯化氢,干燥除杂后通入A中反应,根据氨气的密度小于氯化氢,应该由b口通入氨气,a口通入氯化氢,因此装置接口连接顺序是c→f→g→a;b←e←d←c ;(2)根据上述分析,C装置中装入碱石灰可以干燥氨气,D装置盛装浓硫酸可以干燥氯化氢;(3)根据装置图,可以选用浓氨水和碱石灰制备氨气;Ⅱ.(4)氯化铵与氧化铜混合加热,发生的反应为2NH4Cl+3CuO3Cu+N2↑+2HCl↑+3H2O,F装置中的碱石灰可以吸收氯化氢,则E装置内可以装入浓硫酸,吸收反应过程中生成的水蒸气,G装置用于收集氮气;(5)氮气的物质的量为=mol,氯化氢的物质的量为=
- 8 -
,卤砂中Cl元素和N元素的质量之比为×35.5 g·mol-1∶mol×28 g·mol-1==;(6)若氯化铵纯净,其电离出的氯离子全部沉淀,故通过沉淀质量可求得氯离子质量,因此该方案合理(或不合理,氯化铵不纯,杂质离子也发生了沉淀反应等其他合理答案)。
答案:(1)c→f→g c→d→e (2)干燥氨气 浓硫酸 (3)浓氨水和碱石灰(或其他合理答案) (4)浓硫酸 2NH4Cl+3CuO3Cu+N2↑+2HCl↑+3H2O
(5)(或等其他合理答案) (6)合理,氯化铵纯净,其电离出的氯离子全部沉淀,故通过沉淀质量可求得氯离子质量(或不合理,氯化铵不纯,杂质离子也发生了沉淀反应等其他合理答案)
- 8 -
相关文档
- 2020届二轮复习化学实验基础知识课2021-08-2490页
- 2020届高考化学二轮复习化学实验基2021-08-249页
- 2020高考化学二轮复习课时作业4化2021-08-2313页
- 2021版高考化学一轮复习核心素养测2021-08-239页
- 2021版高考化学一轮复习专题10化学2021-08-2339页
- 2020届一轮复习人教版化学实验热点2021-08-239页
- 2019高考化学高分突破二轮复习专题2021-08-2338页
- 2021届一轮复习人教版化学实验常用2021-08-2322页
- 2020届二轮复习化学实验综合课件(762021-08-2376页
- 2019届二轮复习30化学实验综合课件2021-08-2336页