- 65.50 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
水的电离和溶液的酸碱性
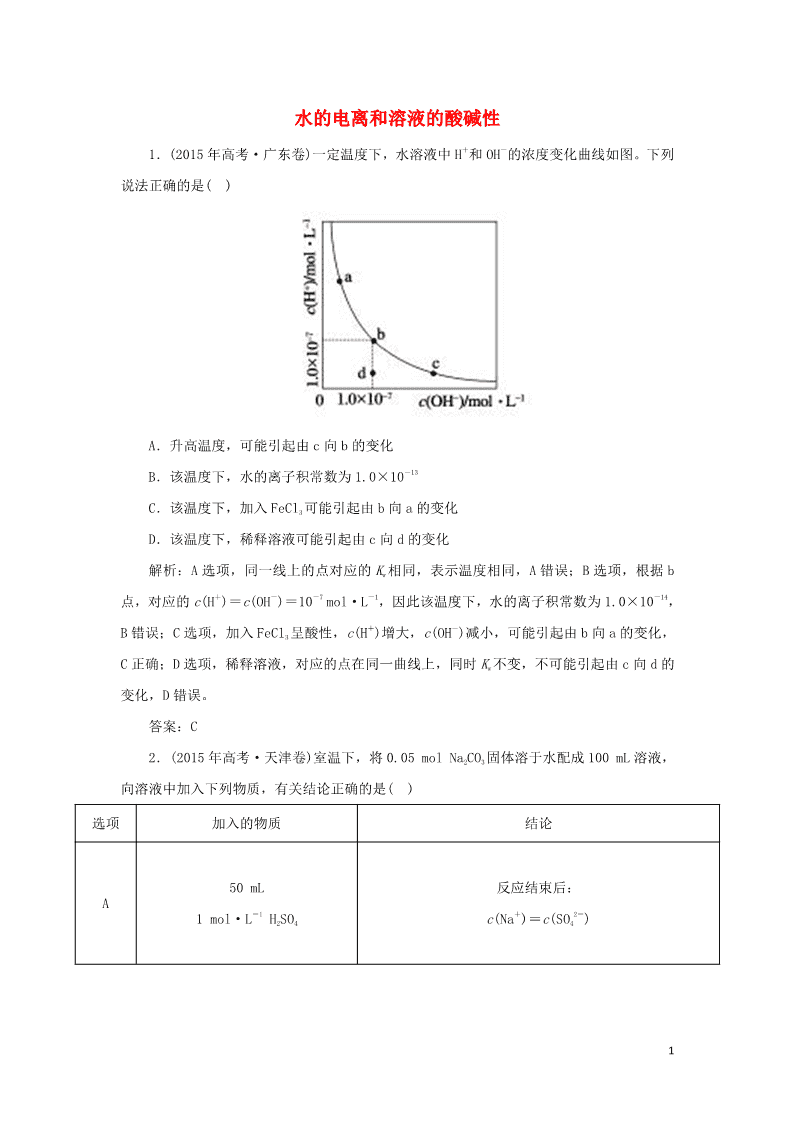
1.(2015 年高考·广东卷)一定温度下,水溶液中 H+和 OH-的浓度变化曲线如图。下列
说法正确的是( )
A.升高温度,可能引起由 c 向 b 的变化
B.该温度下,水的离子积常数为 1.0×10-13
C.该温度下,加入 FeCl3 可能引起由 b 向 a 的变化
D.该温度下,稀释溶液可能引起由 c 向 d 的变化
解析:A 选项,同一线上的点对应的 Kw 相同,表示温度相同,A 错误;B 选项,根据 b
点,对应的 c(H+)=c(OH-)=10-7 mol·L-1,因此该温度下,水的离子积常数为 1.0×10-14,
B 错误;C 选项,加入 FeCl3 呈酸性,c(H+)增大,c(OH-)减小,可能引起由 b 向 a 的变化,
C 正确;D 选项,稀释溶液,对应的点在同一曲线上,同时 Kw 不变,不可能引起由 c 向 d 的
变化,D 错误。
答案:C
2.(2015 年高考·天津卷)室温下,将 0.05 mol Na2CO3 固体溶于水配成 100 mL 溶液,
向溶液中加入下列物质,有关结论正确的是( )
选项 加入的物质 结论
A
50 mL
1 mol·L-1 H2SO4
反应结束后:
c(Na+)=c(SO4
2-)
2
B 0.05 mol CaO
C 50 mL H2O
由水电离出的
c(H+)·c(OH-)不变
D
0.1 mol
NaHSO4 固体
反应完全后,溶液 pH 减小,c(Na+)不变
解析:0.05 mol Na2CO3 与 0.05 mol H2SO4 完全反应:Na2CO3+H2SO4===Na2SO4+CO2↑+H2O,
反应后溶质为 Na2SO4,根据物料守恒反应结束后 c(Na+)=2c(SO4
2-),A 项错误;向溶液中加
入 0.05 mol CaO,则 CaO+H2O===Ca(OH)2,则 c(OH-)增大,且 Ca2++CO3
2-===CaCO3↓,使 CO3
2
-+H2O HCO3
-+OH-平衡向左移,c(HCO3
-)减小,故
c(OH-)
c(HCO3-)增大,B 项正确;加水
稀释有利于水解,CO3
2-+H2O HCO3
-+OH-水解平衡向右移动,水电离出的 n(H+),n(OH
-)均增大,但稀释后 c(H+),c(OH-)均降低,C 项错误;加入 0.1 mol NaHSO4 固体,NaHSO4===Na
++H++SO4
2-,CO3
2-+2H+===CO2↑+H2O,则反应后溶液为 Na2SO4 溶液,溶液呈中性,故溶液
的 pH 减小,但引入了 Na+,故 c(Na+)增大,D 项错误。
答案:B
3.(2013 年高考·大纲全国卷)如图表示水中 c(H+)和 c(OH-)的关系,下列判断错误的
是( )
A.两条曲线上任意点均有 c(H+)×c(OH-)=Kw
B.M 区域内任意点均有 c(H+)10-7 mol/L,B
项正确;C 项,水的电离是吸热反应,升温促进水的电离,c(H+)、c(OH-)及 Kw 都增大,所
以 T1
相关文档
- 化学第三章水溶液中的离子平衡第32021-08-237页
- 2019届二轮复习水溶液中的离子平衡2021-08-2315页
- 广西专用2020版高考化学二轮复习选2021-08-233页
- 高中化学第三章水溶液中的离子平衡2021-08-2316页
- 高中化学第三章水溶液中的离子平衡2021-08-2315页
- 第三章水溶液中的离子平衡第二节水2021-08-237页
- 2020届二轮复习水溶液中的离子平衡2021-08-2333页
- 全国通用2021高考化学一轮复习第八2021-08-238页
- 高中化学第三章水溶液中的离子平衡2021-08-2316页
- 2019高中化学 第三章 水溶液中的离2021-08-235页