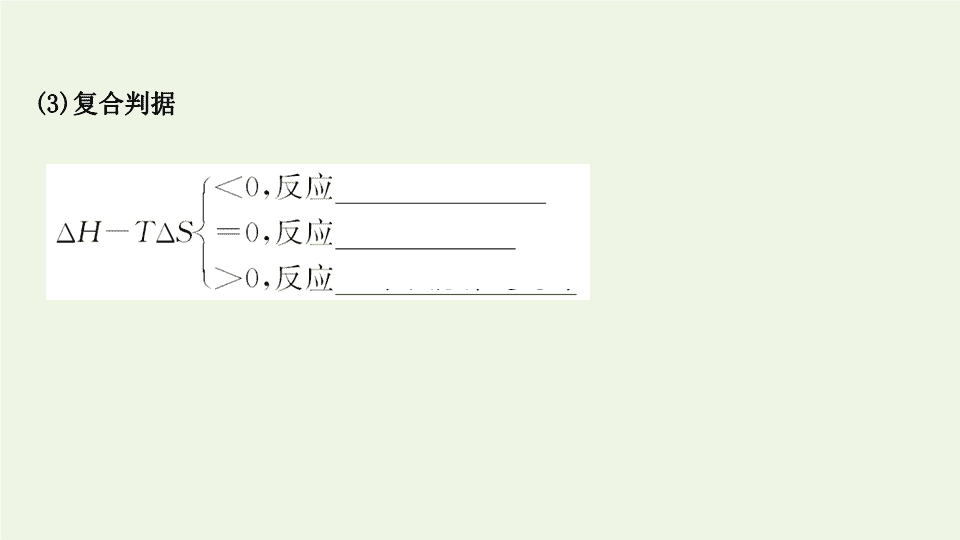- 1.63 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
微项目 探讨如何利用工业废气中的二氧化碳合成甲醇
——
化学反应选择与反应条件优化
1.
化学反应方向的判据
(1)
焓判据
:
放热过程中体系能量
_____,ΔH__0,
具有自发进行的倾向
,
但有些
吸热反应也可以自发进行
,
故只用焓变判断反应方向不全面。
(2)
熵判据
:
体系的混乱度
_____,
即熵增
,ΔS>0,
反应有自发进行的倾向
,
但有
些熵减的过程也可能自发进行
,
故只用熵变来判断反应方向也不全面。
必备知识
·
素养奠基
降低
<
增加
(3)
复合判据
2.
外界条件对化学平衡的影响
若其他条件不变
,
改变下列条件对化学平衡的影响如下
:
条件的改变
(
其他条件不变
)
化学平衡的移动
浓度
增大反应物浓度或减小生成物浓度
向
_______
方向移动
减小反应物浓度或增大生成物浓度
向
_______
方向移动
正反应
逆反应
条件的改变
(
其他条件不变
)
化学平衡的移动
压强
(
对有
气体存在
的反应
)
反应前后气体
分子数改变
增大压强
向
_____________
的方向移动
减小压强
向
_____________
的方向移动
反应前后气体
分子数不变
改变
压强
___________
温度
升高温度
向
_____
反应方向移动
降低温度
向
_____
反应方向移动
催化剂
使用催化剂
___________
气体体积减小
气体体积增大
平衡不移动
吸热
放热
平衡不移动
3.
外界因素对化学反应速率的影响
影响因素
影响结果
(
其他条件不变
)
浓度
固体或
纯液体
浓度为常数
,
增加反应物的量
,
反应速率
_____(
固
体物质的表面积影响反应速率
)
气体或
溶液
增大反应物的浓度
,
反应速率
_____
温度
升温
反应速率
_____
降温
反应速率
_____
催化剂
使用催化剂能同时同倍改变正、逆反应的速率
不变
加快
加快
减慢
影响因素
影响结果
(
其他条件不变
)
压强
加压
(
缩小体积
)
对有气体参加的反应
,
正、逆反应速率均
_____
减压
(
扩大体积
)
对有气体参加的反应
,
正、逆反应速率均
_____
加快
减小
【
情境
·
思考
】
自从
2019
年
6
月以来
,
北半球正在遭遇一场破纪录的高温。就连原本寒冷的北极地区也遭遇了
100
多场野火的肆虐。全球变暖的罪魁祸首是工业废气中
CO
2
的排放
,
因此有关
CO
2
的综合利用越来越受到人们的关注。而甲醇是一种重要的化工原料
,
广泛用于有机合成、医药、农药、燃料、高分子等领域。而且甲醇是一种重要的清洁燃料。
如果用
CO
2
来合成甲醇
,
从元素守恒角度分析应该需要哪种元素
?
请你写出一个制取甲醇的化学方程式。
提示
:
需要氢元素
,CO
2
+3H
2
====CH
3
OH+H
2
O
。
关键能力
·
素养形成
项目活动
1:
选择合适的化学反应
利用
CO
2
合成甲醇
,
如果选取水或氢气作为氢源
,
反应如下
:
①CO
2
(g)+3H
2
(g)====CH
3
OH(g)+H
2
O(g)
②CO
2
(g)+2H
2
O(g)====CH
3
OH(g)+ O
2
(g)
上述两个反应在常温常压下的焓变和熵变如下
:
反应
ΔH/(kJ·mol
-1
)
ΔS/(J·mol
-1
·K
-1
)
①
-48.97
-177.16
②
+676.48
-43.87
【
活动探究
】
1.
分析判断利用
CO
2
合成甲醇的两个反应能否正向自发进行
,
应选用哪个反应合成甲醇
?
提示
:
反应①的
ΔH<0,ΔS<0,
因此在低温时
ΔH-TΔS<0,
反应正向自发进行。
反应②的
ΔH>0,ΔS<0,
因此在任何温度下
ΔH-TΔS
均不能为负值
,
反应正向不能自发进行。
因此应选用反应①合成甲醇。
2.
在利用反应①合成甲醇时
,
可能会伴随如下副反应
:
CO
2
(g)+H
2
(g)====CO(g)+H
2
O(g) ΔH=+41.17kJ·mol
-1
ΔS=+42.08J·mol
-1
·K
-1
。判断此反应能否正向自发进行。
提示
:
由于此反应
ΔH>0,ΔS>0,
因此在高温时
ΔH-TΔS<0,
反应正向自发进行。
【
思考讨论
】
(1)
判断反应①的正向自发进行的最高温度为多少
?
提示
:
276.42K
。
ΔH-TΔS<0
反应才能自发进行
,
因此有
-48.97 kJ·mol
-1
-T×
(-177.16×10
-3
kJ·mol
-1
·K
-1
)<0,
解得
T<276.42K
。因此反应在温度低于
276.42K
时反应正向自发进行。
(2)
判断反应①的副反应正向自发进行的最低温度为多少
?
提示
:
978.37K
。
ΔH-TΔS<0
反应才能自发进行
,
因此有
+41.17kJ·mol
-1
-T×
(+42.08×10
-3
kJ·mol
-1
·K
-1
)<0,
解得
T>978.37K
。因此反应在温度高于
978.37K
时正向自发进行。
【
探究总结
】
反应能否自发进行的判断方法
(1)
当
ΔH<0,ΔS>0
时
,
反应正向一定能自发进行。
(2)
当
ΔH>0,ΔS<0
时
,
反应正向一定不能自发进行。
(3)
当
ΔH<0,ΔS<0
时
,
在低温下反应正向能自发进行。
(4)
当
ΔH>0,ΔS>0
时
,
在高温下反应正向能自发进行。
【
迁移应用
】
1.(2020·
银川高二检测
)
用钌的配合物作催化剂
,
一定条件下可直接光催化分
解
CO
2
发生反应
:2CO
2
(g) 2CO(g)+O
2
(g)
。下列有关焓变与熵变说法不正
确的是
(
)
A.
该反应的
ΔS>0
B.
该反应的
ΔH<0
C.
该反应的逆反应在一定条件下也能自发进行
D.
该反应的熵变效应大于焓变效应
催化剂
====
【
解析
】
选
B
。该反应是一个气体分子数增多的反应
,
也就是一个熵增的反应
,A
正确。该反应是分解反应
,
且该反应的逆反应是
CO
的燃烧
,
是放热反应
,
所以该反应是吸热反应
,B
错误。虽然该反应的逆反应是熵减反应
,
但反应放热
,
一定条件下可以自发进行
,C
正确。该反应
ΔS>0,ΔH>0,
能自发进行说明熵变的影响大于焓变
,D
正确。
2.(2020·
濮阳高二检测
)
下列说法不正确的是
(
)
A.Na
与
H
2
O
的反应是熵增的放热反应
,
该反应能自发进行
B.
某吸热反应能自发进行
,
因此该反应是熵增反应
C.(NH
4
)
2
CO
3
在室温下就能自发的分解
,
说明该反应的
ΔS<0
D.2NO(g)+2CO(g)====N
2
(g)+2CO
2
(g)
常温下能自发进行
,
说明该反应的
ΔH<0
【
解析
】
选
C
。
(NH
4
)
2
CO
3
====2NH
3
↑+CO
2
↑+H
2
O
为
ΔS>0
的反应。
3.(2020·
吴忠高二检测
)
下列对化学反应预测正确的是
(
)
选项
化学反应方程式
已知条件
预测
A
M(s)====X(g)+Y(s)
ΔH>0
它是非自发反应
B
W(s)+xG(g)====2Q(g)
ΔH<0,
自发
反应
x
可能等于
1
、
2
、
3
C
4X(g)+5Y(g)====4W(g)+6G(g)
能自发反应
ΔH
一定小于
0
D
4M(s)+N(g)+2W(l)====4Q(s)
常温下
,
自发
进行
ΔH>0
【
解析
】
选
B
。
A
项
,ΔH>0,ΔS>0,
高温下该反应能自发进行
;C
项
,
该反应
ΔS>0,
若使
ΔH-TΔS<0,ΔH
可能大于
0
也可能小于
0;D
项
,
该反应
ΔS<0,
若常温下自发进行
,
则
ΔH<0
才能使
ΔH-TΔS<0
。
项目活动
2:
选择适宜的反应条件
通过上述的分析可以通过反应①利用二氧化碳和氢气合成甲醇
,
反应如下
CO
2
(g)+3H
2
(g)====CH
3
OH(g)+H
2
O(g)
ΔH=-48.97kJ·mol
-1
。
【
活动探究
】
1.
利用所学知识分析如何提高反应的速率和甲醇的产率
?
提示
:
提高
CO
2
和
H
2
的浓度、加压、升高温度
,
使用催化剂均可以加快反应的速率。从化学平衡角度提高
CO
2
和
H
2
的浓度、降低
CH
3
OH
和
H
2
O
的浓度、加压、降低温度均有利于化学平衡向右移动
,
能够提高甲醇的产率。
2.
在一定条件下测得不同的
H
2
和
CO
2
投料比体系中甲醇的产率如下
:
不同
n(H
2
)∶n(CO
2
)
对反应的影响
注
:α
为转化率
,φ
为产率
,
反应条件为温度
553 K
、总压
2MPa,
无催化剂。
n(H
2
)∶n(CO
2
)
2
3
5
7
α(CO
2
)/%
11.63
13.68
15.93
18.71
φ(CH
3
OH)/%
3.04
4.12
5.26
6.93
从上述数据中你能得到什么结论
?
提示
:
从上述表格中能够得到的结论是增大氢气的比例可以提高
CO
2
的转化率和甲醇的产率。
3.
下图分别是压强和温度对反应①中甲醇产率的影响。
(1)
在实际生产中是不是压强越大越好
?
提示
:
不是。要考虑生产的实际
,
选择合适的压强
,
如动力和设备的承受力等方面。
(2)
请分析甲醇的产率在温度为
523K
时最高的原因。
提示
:
在
523K
之前
,
随温度的升高反应速率加快
,
使甲醇产率增大
;
超过
523K
时
,
甲醇的产率降低的原因可能是催化剂的活性降低、副反应的发生等。
4.
下图是不同的催化剂组成对甲醇产率的影响和选择性的影响。
催化剂组成改变对甲醇产率和选择性的影响
组成
CuO/
(wt.%)
ZnO/
(wt.%)
Al
2
O
3
/
(wt.%)
ZrO
2
/
(wt.%)
MnO/
(wt.%)
φ
(CH
3
OH)/
[g·(kg-
催化
剂
)
-1
·h
-1
]
选择性
/%
CuO/ZnO/
Al
2
O
3
65.8
26.3
7.9
0
0
78
40
CuO/ZnO/
ZrO
2
62.4
25.0
0
12.6
0
96
88
CuO/ZnO/
ZrO
2
/MnO
65.8
26.6
0
3.6
4
88
100
CuO/ZnO/
ZrO
2
/MnO
65.8
26.6
0
5.6
2
138
91
注
:
反应条件为
n(H
2
)∶n(CO
2
)=3,
温度
553 K,
总压
4MPa;wt.%:
重量百分含量
;
选择性
:
生成甲醇的二氧化碳在全部二氧化碳反应物中所占比例。
从表格中的数据能得出什么结论
?
提示
:
改变催化剂的组成
,
可以有效地提高甲醇的产率和选择性。
【
思考讨论
】
(1)
压强的改变对反应①的副反应有何影响
?
提示
:
从速率角度看
,
压强的改变会改变其反应速率
;
但是由于此反应前后气体的系数相等
,
因此压强的改变对平衡没有影响。
(2)
在实际生产中适宜温度的选择原则是什么
?
提示
:
在实际生产中温度的选择要考虑催化剂的催化活性
,
要使催化剂的活性最大。
【
探究总结
】
化工生产适宜条件选择的一般原则
条件
原则
从化学反应速率分析
既不能过快
,
又不能太慢
从化学平衡移动分析
既要注意外界条件对速率和平衡影响的一致性
,
又要注意二者影响的矛盾性
从原料的利用率分析
增加易得廉价原料
,
提高难得高价原料的利用
率
,
从而降低生产成本
从实际生产能力分析
如设备承受高温、高压能力等
从催化剂的使用活性分析
注意催化剂的活性对温度的限制
【
迁移应用
】
1.(2020·
昆明高二检测
)
低温脱硝技术可用于处理废气中的氮氧化物
,
发生的
化学反应为
2NH
3
(g)+NO(g)+NO
2
(g) 2N
2
(g)+3H
2
O(g)
ΔH<0
。
在恒容的密闭容器中
,
下列有关说法正确的是
(
)
A.
平衡时
,
其他条件不变
,
升高温度可使该反应的平衡常数增大
B.
平衡时
,
其他条件不变
,
增加
NH
3
的浓度
,
废气中氮氧化物的转化率减小
C.
单位时间内消耗
NO
和
N
2
的物质的量比为
1∶2
时
,
反应达到平衡
D.
其他条件不变
,
使用高效催化剂
,
废气中氮氧化物的转化率增大
【
解析
】
选
C
。由于该反应为放热反应
,
升高温度时
,
平衡左移
,
该反应的平衡常数减小
,A
错
;
增大一种反应物的浓度
,
自身的转化率降低
,
而另外反应物的转化率增大
,B
错
;
单位时间内消耗
NO
和
N
2
的物质的量之比为
1∶2
时
,
说明
v
正
=v
逆
,
反应达到平衡
,C
正确
;
催化剂只能改变反应速率
,
不能使平衡发生移动
,
即不能改变转化率
,D
错。
2.(2020·
晋江高二检测
)
在催化剂作用下
,
用乙醇制乙烯
,
乙醇转化率和乙烯选择性
(
生成乙烯的物质的量与乙醇转化的物质的量的比值
)
随温度、乙醇进料量
(
单位
:mL·min
-1
)
的关系如图所示
(
保持其他条件相同
)
。
在
410
~
440 ℃
温度范围内
,
下列说法不正确的是
(
)
A.
当乙醇进料量一定时
,
随乙醇转化率增大
,
乙烯选择性升高
B.
当乙醇进料量一定时
,
随温度的升高
,
乙烯选择性不一定增大
C.
当温度一定时
,
随乙醇进料量增大
,
乙醇转化率减小
D.
当温度一定时
,
随乙醇进料量增大
,
乙烯选择性增大
【
解析
】
选
A
。根据图象
,
当乙醇进料量一定时
,
随乙醇转化率增大
,
乙烯选择性逐渐升高
,
但达到一定温度后
,
乙烯选择性都逐渐降低
,
故
A
项错误、
B
项正确
;
根据题中第一个图
,
当温度一定时
,
随乙醇进料量增大
,
乙醇转化率减小
,
故
C
项正确
;
根据题中第二个图
,
当温度一定时
,
随乙醇进料量增大
,
乙烯选择性增大
,
故
D
项正确。
3.(2020·
东城区高二检测
)
一定条件下
,
用
Fe
2
O
3
、
NiO
或
Cr
2
O
3
作催化剂对燃煤烟气进行回收
,
使
SO
2
转化生成
S
。催化剂不同
,
相同其他条件
(
浓度、温度、压强
)
情况下
,
相同时间内
SO
2
的转化率随反应温度的变化如图
,
下列说法不正确的是
(
)
A.
不考虑催化剂价格因素
,
选择
Fe
2
O
3
作催化剂可以节约能源
B.
相同其他条件下
,
选择
Cr
2
O
3
作催化剂
,SO
2
的平衡转化率最小
C.a
点后
SO
2
的转化率减小的原因可能是温度升高
,
催化剂活性降低了
D.
选择
Fe
2
O
3
作催化剂
,
最适宜温度为
340
~
380 ℃
温度范围
【
解析
】
选
B
。根据图象可知
,
当温度在
340 ℃
时
,
在
Fe
2
O
3
作催化剂条件下
,
反应先达到平衡
,SO
2
的平衡转化率最大
,A
正确
;
相同其他条件下在
260 ℃
、
300 ℃
时
,
选择
Cr
2
O
3
作催化剂
,SO
2
的转化率均不是最小的
,B
错误
;
催化剂催化能力需要维持在一定的温度下
,
温度太高
,
催化剂活性可能会降低
,C
正确
;340
~
380 ℃
温度范围内
,Fe
2
O
3
的催化能力最大
,
二氧化硫的转化率也是最大
,
反应速率最快
,D
正确。
课堂检测
·
素养达标
1.(2020·
潍坊高二检测
)
下列有关化学反应方向及其判据的说法中正确的是
(
)
A.
非自发反应就是不可能发生的反应
,
自发反应就是能较快进行的反应
B.
高温、高压下可以使石墨转化为金刚石是自发的化学反应
C.
由能量判据和熵判据组合而成的复合判据适合于所有的反应
D.
反应
NH
3
(g)+HCl(g)====NH
4
Cl(s)
在低温下能自发进行
,
说明该反应的
ΔH>0
【
解析
】
选
C
。
A
项
,
非自发反应在一定条件下也能发生
,
自发反应进行的也不一定较快
,
错误
;B
项
,
石墨转化为金刚石
,ΔH>0,
该反应是非自发进行的化学反应
,
错误
;C
项
,
能量判据和熵判据组合而成的复合判据
,
只要
ΔH-TΔS<0,
反应就可以自发进行
,
若
ΔH-TΔS>0,
反应就不能自发进行
,
正确
;D
项
,
反应
NH
3
(g)+HCl(g)
====NH
4
Cl(s)
在低温下能自发进行
,ΔH-TΔS<0,
从化学方程式知
TΔS<0,
说明
ΔH<0,
错误。
【
补偿训练
】
(2020·
盐城高二检测
)
将煤气化后所得的重要产品之一是甲醇。其制备反应
:
CO(g) +2H
2
(g) CH
3
OH(g)
ΔH<0
。为了增加甲醇的产量
,
同时保证较高的
生产效率。工厂应采取的正确措施是
(
)
A.
高温、高压
B.
适宜温度、高压、催化剂
C.
低温、低压、不断分离出甲醇
D.
低温、高压、催化剂
【
解析
】
选
B
。
ΔH<0
表明此反应为放热反应
,
不能加太高的温度但温度不能太低
,
温度太低反应速率太低
;
正反应方向是气体体积减小的方向
,
所以可以加压使化学平衡正向移动
;
另外选择合适的催化剂加快反应速率。
2.(2020·
佛山高二检测
)
以甲醇为原料在一定条件下合成乙烯
,2CH
3
OH(g)
C
2
H
4
(g)+2H
2
O(g)
。 某研究小组将甲醇蒸气以一定的流速持续通过相同量的同
种催化剂
,
不同温度得到如下图象
,
则下列结论不正确的是 世纪金榜导学
号
(
)
A.
一段时间后甲醇反应率下降可能是催化剂活性下降
B.
综合图
1
、图
2
可知
,
甲醇还发生了其他反应
C.
若改变甲醇蒸气的流速
,
不会影响甲醇反应率和乙烯产率
D.
制乙烯比较适宜的温度是
450 ℃
左右
【
解析
】
选
C
。 催化剂活性是受温度影响的
,
温度太高
,
催化剂会失去活性
,
故
A
正确
;
根据
2CH
3
OH(g) C
2
H
4
(g)+2H
2
O(g),
由图
1
知
450 ℃
时甲醇的反应速率
比
400 ℃
快
,
图
2450 ℃ C
2
H
4
(g)
的产率低于
400 ℃
的产率
,
所以有其他反应发生
,
故
B
正确
;
若改变甲醇蒸气的流速
,
甲醇反应率和乙烯产率都将改变
,
故
C
错
;
由
图
2
知
450 ℃
左右制乙烯产率比较高
,
故
D
正确。
3.(2020·
宁波高二检测
)
工业上主要利用碳热还原重晶石制得硫化钡
,
进而生产各种钡化合物。如图为不同反应温度下
,
实验中碳热还原硫酸钡反应体系的平衡组成随反应温度的变化关系。下列说法正确的是
(
)
A.
约
150 ℃,
体系中开始出现
BaS,
说明温度越高反应速率越快
B.400 ℃
时发生的化学反应方程式
:BaSO
4
+2C BaS+2CO
2
↑
C.CO
一定无法还原重晶石
D.
温度高于
400 ℃
后
,
硫酸钡才能转化为
BaS
△
====
【
解析
】
选
B
。根据图象
,
约在
150 ℃
时
,
体系中开始出现
BaS,
说明反应在
150 ℃
开始反应
,
不能说明温度越高反应速率越快
,
故
A
错误
;
根据图象在
400 ℃
时
BaSO
4
物质的量分数为
0,C
的物质的量百分数减小
,BaS
物质的量百分数增大
,
CO
2
的物质的量分数增大
,
因此
400 ℃
时发生反应的反应物是
BaSO
4
和
C,
生成物是
CO
2
和
BaS,
反应方程式为
BaSO
4
+2C BaS+2CO
2
↑,
故
B
正确
;
根据图象
400 ℃
时
,
CO
的物质的量分数为
0,
结合加热时
C
与
CO
2
反应生成
CO,
则
CO
能还原
BaSO
4
,
故
C
错
误
;
根据图象
,
在
150 ℃
左右
BaSO
4
转化成
BaS,
故
D
错误。
△
====
4.(2020·
长沙高二检测
)
在一定条件下探究二甲醚的制备反应为
2CO(g)+
4H
2
(g) CH
3
OCH
3
(g)+H
2
O(g)
ΔH,
测定结果如图所示。下列判断错误的是
(
)
A.
该反应的
ΔH<0
B.
该反应伴随着副反应的发生
C.
工业选择的较适宜温度为
280
~
290 ℃
D.
加入催化剂可以提高
CH
3
OCH
3
的产率
【
解析
】
选
D
。由题图知
,
随着温度升高
,CO
的转化率降低
,
所以升高温度
,
平衡逆向移动
,
则该反应是放热反应
,ΔH<0,A
项正确
;
从图中可知
,CO
的转化率降低的同时
,CH
3
OCH
3
的产率在不同温度下差别大
,
即说明该反应伴随着副反应的发生
,B
项正确
;
在
280
~
290 ℃
间
,CH
3
OCH
3
的产率很高
,
工业选择的较适宜温度为
280
~
290 ℃,C
项正确
;
加入催化剂可以改变反应达到平衡的时间
,
但不能提高
CH
3
OCH
3
的产率
,D
项错误。
5.(2020·
泰安高二检测
)
甲醇是一种重要的试剂
,
氢气和二氧化碳在一定条件
下可合成甲醇
:CO
2
(g)+3H
2
(g) CH
3
OH(g)+H
2
O(g),
在密闭容器中充入
3 mol
氢气和
1 mol
二氧化碳
,
测得混合气体中甲醇的体积分数与温度的关系如图
A
所
示
:
试回答下列问题
:
世纪金榜导学号
(1)
该反应是
________(
填“放热”或“吸热”
)
反应。该反应平衡常数的表达式是
_______________________,
为了降低合成甲醇的成本可采用的措施是
________________
。
(
任意写一条合理的建议
)
(2)
解释
0
~
T
0
内
,
甲醇的体积分数变化趋势
:___________________________
。
(3)
氢气在
Q
点的转化率
________(
填“大于”“小于”或“等于”
,
下同
)
氢气在
W
点的转化率
;
其他条件相同
,
甲醇在
Q
点的正反应速率
________
甲醇在
M
点的正反应速率。
(4)
图
B
表示氢气转化率
α(H
2
)
与投料比 的关系
,
请在图
B
中画出两条
变化曲线并标出曲线对应的条件
,
两条曲线对应的条件分别为一条曲线对应的
压强是
1.01×10
5
Pa;
另一条曲线对应的压强是
3.03×10
5
Pa(
其他条件相同
)
。
【
解析
】
(1)T
0
时
,
升高温度
,
甲醇的体积分数减小
,
平衡逆向移动
,
正反应为放热
反应
;
该反应平衡常数的表达式为
K= ,
为了降低合成甲醇
的成本
,
应该尽可能的使平衡向右移动
,
可采用的措施有增加
CO
2
的充入量等
;
(2)
温度低于
T
0
时
,
反应未达到平衡
,
反应正向进行
,
使甲醇的体积分数逐渐增大
;
(3)
温度低于
T
0
时
,
反应未达到平衡
,
反应正向进行
,
氢气在
Q
点的转化率小于平衡
时的转化率
,W
点达到平衡
,
因此氢气在
Q
点的转化率小于
W
点的转化率
;
平衡之前
,
甲醇的正反应速率逐渐增大
,
甲醇在
Q
点的正反应速率小于
W
点的反应速率
,
升高
温度
,
反应速率增大
,
甲醇在
M
点的正反应速率大于
W
点
,
因此甲醇在
Q
点的正反应
速率小于在
M
点的正反应速率
;
(4)
根据方程式
,
增大压强
,
平衡正向移动
,
氢气转化率
α(H
2
)
增大
,
增大投料
比
,
氢气转化率
α(H
2
)
减小
,
画出相应曲线。
答案
:
(1)
放热
K=
增加
CO
2
的充入量
(2)
温度低于
T
0
时
,
反应未达到平衡
,
反应正向进行
,
使甲醇的体积分数逐渐增大
(3)
小于 小于
(4)
课题任务
:
丙烯腈生产条件的选择
【
情境创设
】
聚丙烯腈纤维
(
腈纶
)
广泛用来代替羊毛
,
或与羊毛混纺制成毛织物等
,
可代替部分羊毛制作毛毯和地毯等织物
,
因此俗称人造羊毛。合成聚丙烯腈的单体是丙烯腈
,
丙烯腈是一种重要的有机合成单体
,
是多种有机高聚物的原料。
课题探究
·
素养提升
目前
,
工业上合成丙烯腈的主要方法是丙烯氨氧化法。主要分两步进行
:
(1)
丙烷脱氢制丙烯
;
(2)
丙烯氨氧化生成丙烯腈。
【
素养解读
】
1.
核心素养
:
(1)
变化观念与平衡思想
:
认识化学变化有一定限度、速率
,
是可以调控的。能多角度、动态地分析化学变化
,
运用化学反应原理解决简单的实际问题。
(2)
证据推理与模型认知
:
建立观点、结论和证据之间的逻辑关系。通过分析、推理等方法认识研究对象的本质特征、构成要素及其相互关系
,
建立认知模型
,
并能运用模型解释化学现象
,
揭示现象的本质和规律。
2.
素养目标
:
通过丙烯腈生产条件的选择
,
了解化学反应方向、限度、速率在化学生产中的应用。
【
素养探究
】
【
探究一
】
丙烷脱氢制丙烯反应的研究
1.
丙烷脱氢制丙烯时可能发生的反应如下
:
主反应
:
①C
3
H
8
(g)====C
3
H
6
(g)+H
2
(g)
ΔH=+125 kJ·mol
-1
副反应
:
②C
3
H
8
(g)====C
2
H
4
(g)+CH
4
(g)
ΔH=+81 kJ·mol
-1
③C
2
H
4
(g)+H
2
(g)====C
2
H
6
(g)
Δ
H=-137 kJ·mol
-1
④C
3
H
8
(g)+H
2
(g)====C
2
H
6
(g)+CH
4
(g)
Δ
H=-56 kJ·mol
-1
(1)
分析主反应和副反应正向能否自发进行。
提示
:
根据
ΔH-TΔS
可以判断
,
升高温度有利于主反应和副反应②的自发进行
,
而降温有利于副反应③和④的自发进行。
(2)
工业生产中通常采用在反应体系中通入一定量的水蒸气
,
实验测得
,
常压下丙烷脱氢的平衡转化率
y%
与温度
T
、水烃比
M
的关系如图
:
①
从图中可以得出什么结论
?
提示
:
从图中的变化趋势
,
可以得出
:
相同温度下
,
水烃比
M
越大
,
丙烷的平衡转化率越高
;
水烃比
M
一定时
,
温度越高
,
丙烷的平衡转化率越高。
②在实际的工业生产中应怎样利用上述结论
?
提示
:
可以向体系中通入高温水蒸气的方式来提高丙烷的转化率。
2.
研究发现
,
随温度的升高
,
丙烷的平衡转化率提高
,
但是丙烯的产率却降低
,
原因可能是丙烷裂解加剧
,
从而使丙烯的选择性降低
,
同时生成单质碳附着在催化剂表面而失活。通常
,
工业上采用向体系中加入氧化剂
——
氧气或二氧化碳的方式解决此问题。
请你分析引入氧化剂
CO
2
时
,
对丙烷脱氢制丙烯有何影响
?(
注
:CO
2
(g)+H
2
(g)====
CO(g)+H
2
O(g)
ΔH=-41 kJ·mol
-1
)
提示
:
(1)
通入
CO
2
后会与体系内的
H
2
发生反应
,
从而降低氢气的浓度
,
有利于提高主反应的平衡转化率
;
(2)
在高温下
CO
2
可以与催化剂表面的碳反应
,
有利于催化剂活性的保持
;
(3)CO
2
与
H
2
的反应为放热反应
,
有利于降低能耗。
【
探究二
】
探究丙烯氨氧化法制丙烯腈
工业上可用“丙烯氨氧化法”生产
,
主要副产物有丙烯醛
(CH
2
=
CHCHO)
和乙腈
(CH
3
CN)
。反应如下
:
①C
3
H
6
(g)+NH
3
(g)+ O
2
(g)====C
3
H
3
N(g)+3H
2
O(g)
ΔH=-515 kJ·mol
-1
②C
3
H
6
(g)+O
2
(g)====C
3
H
4
O(g)+H
2
O(g)
ΔH=-353 kJ·mol
-1
1.
两个反应在热力学上趋势均很大
,
分析其原因。分析有利于提高丙烯腈平衡
产率的反应条件有哪些
?
提示
:
因为两个反应均为放热量大的反应
,
所以热力学趋势大
;
反应①为气体体积增大的放热反应
,
所以降低温度、降低压强有利于反应正向进行
,
从而提高丙烯腈的平衡产率。
2.
下图为丙烯腈产率与反应温度的关系曲线
,
分析丙烯腈的产率随温度变化的原因。
提示
:
因为该反应为放热反应
,
平衡产率应随温度升高而降低
,
反应刚开始进行
,
尚未达到平衡状态
,460 ℃
以前是建立平衡的过程
,
所以随温度的升高
,
丙烯腈的产率逐渐升高
;
高于
460 ℃
时
,
丙烯腈产率降低。原因可能有
:①
反应放热
,
平衡产率应随温度升高而降低
;②
催化剂在一定温度范围内活性较高
,
若温度过高
,
活性降低
;③
根据题意
,
副产物有丙烯醛
,
副反应增多导致产率下降。
3.
丙烯腈和丙烯醛的产率与
n(
氨
)/n(
丙烯
)
的关系如图所示。
请分析最佳
n(
氨
)/n(
丙烯
)
约为多少
?
简述理由。
提示
:
根据图象可知
,
当
n(
氨
)/n(
丙烯
)
约为
1.0
时
,
该比例下丙烯腈产率最高
,
而副产物丙烯醛产率最低。
【
探究三
】【
迁移应用
】
1.
分析丙烯腈的生产过程中提高丙烯腈反应选择性的关键因素是什么
?
提示
:
催化剂。由于主反应①为气体体积增大的放热反应
,
副反应②为气体体积
不变的放热反应
,
因此温度和压强的改变无法对这两个反应区分
,
只能通过催化
剂来提高丙烯腈的选择性。
2.
分析工业生产丙烯腈时最佳的进料气氨、丙烯、空气的理论体积比是多少
?
提示
:
根据化学反应
C
3
H
6
(g)+NH
3
(g)+ O
2
(g)====C
3
H
3
N(g)+3H
2
O(g),
氨、丙烯、
氧气按
2∶2∶3
的体积比加入反应达到最佳状态
,
而空气中氧气约占
20%,
所以进
料气氨、丙烯、空气的理论体积约为
2∶2∶15,
即
1∶1∶7.5
。
【
素养评价
】
1.
变化观念与平衡思想
——
水平
1:
能根据观察和实验获得的现象和数据概括化学变化发生的条件、特征与规律。
2.
变化观念与平衡思想
——
水平
3:
认识反应条件对化学反应速率和化学平衡的影响
,
能运用化学反应原理分析影响化学变化的因素。
3.
证据推理与模型认知
——
水平
3:
能从定性与定量结合上收集证据
,
能通过定性分析和定量计算推出合理的结论。
4.
证据推理与模型认知
——
水平
4:
能对复杂的化学问题情境中的关键要素进行分析以建构相应的模型
,
能选择不同模型综合解释或解决复杂的化学问题。
5.
变化观念与平衡思想
——
水平
1:
能根据观察和实验获得的现象和数据概括化学变化发生的条件、特征与规律。
6.
变化观念与平衡思想
——
水平
3:
认识反应条件对化学反应速率和化学平衡的影响
,
能运用化学反应原理分析影响化学变化的因素。
7.
证据推理与模型认知
——
水平
3:
能从定性与定量结合上收集证据
,
能通过定性分析和定量计算推出合理的结论。
8.
科学态度与社会责任
——
水平
3:
依据实际条件并运用所学的化学知识和方法解决生产、生活中简单的化学问题。
相关文档
- 2018届二轮复习化学实验基础知识课2021-08-2468页
- 2017-2018学年四川省新津中学高二2021-08-2410页
- 高中化学:1-3《有机化合物的命名2》2021-08-2415页
- 【化学】河南省周口市中英文学校202021-08-246页
- 广东省江门市第二中学2018-2019学2021-08-248页
- 新人教版高二化学选修3:3_4离子晶体2021-08-244页
- 高中化学《有机化学基础》3_4有机2021-08-2410页
- 2017-2018学年湖南省醴陵二中、醴2021-08-249页
- 高二化学下学期期中试题实验班2021-08-2421页
- 试题君之课时同步君2016-2017学年2021-08-2412页