- 290.00 KB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考总复习
第3讲 化学键
[考纲要求]
1.了解化学键的定义。2.了解离子键、共价键的形成。3.了解化学反应的本质。4.掌握电子式的表示方法。
离子键和共价键
1.化学键:使______________________的作用力。
2.分类
3.离子键与共价键
(1)概念
①离子键:阴、阳离子通过________形成的化学键。
②共价键:原子间通过________所形成的化学键。
(2)对比
项目
离子键
共价键
成键粒子
________
____
成键方式
得失电子形成阴、阳离子
形成__________
成键条件
活泼金属元素与活泼非金属元素
一般在非金属原子之间
作用力实质
________
存在举例
存在于离子化合物中,如NaCl、KCl、MgCl2、CaCl2、ZnSO4、NaOH等
(1)非金属单质,如H2、O2等;
(2)共价化合物,如HCl、CO2、CH4等;
(3)某些离子化合物,如NaOH、Na2O2等
4.极性键与非极性键
5.电子式
在元素符号周围用“·”或“×”来代表原子的________(价电子)的式子。
11
高考总复习
[回扣判断](正确的打“√”,错误的打“×”)
(1)形成离子键的静电作用指的是阴、阳离子间的静电吸引作用( )
(2)某些金属与非金属原子间也能形成共价键( )
(3)金属元素和非金属元素形成的化学键一定是离子键( )
(4)所有物质中均含有化学键( )
(5)有化学键断裂的变化一定是化学变化( )
(6)某元素的最外层只有一个电子,它跟卤素结合时,所形成的化学键一定是离子键( )
(7)H2O的电子式H+[]2-H+( )
(8)羟基的电子式为·H( )
(9) ( )
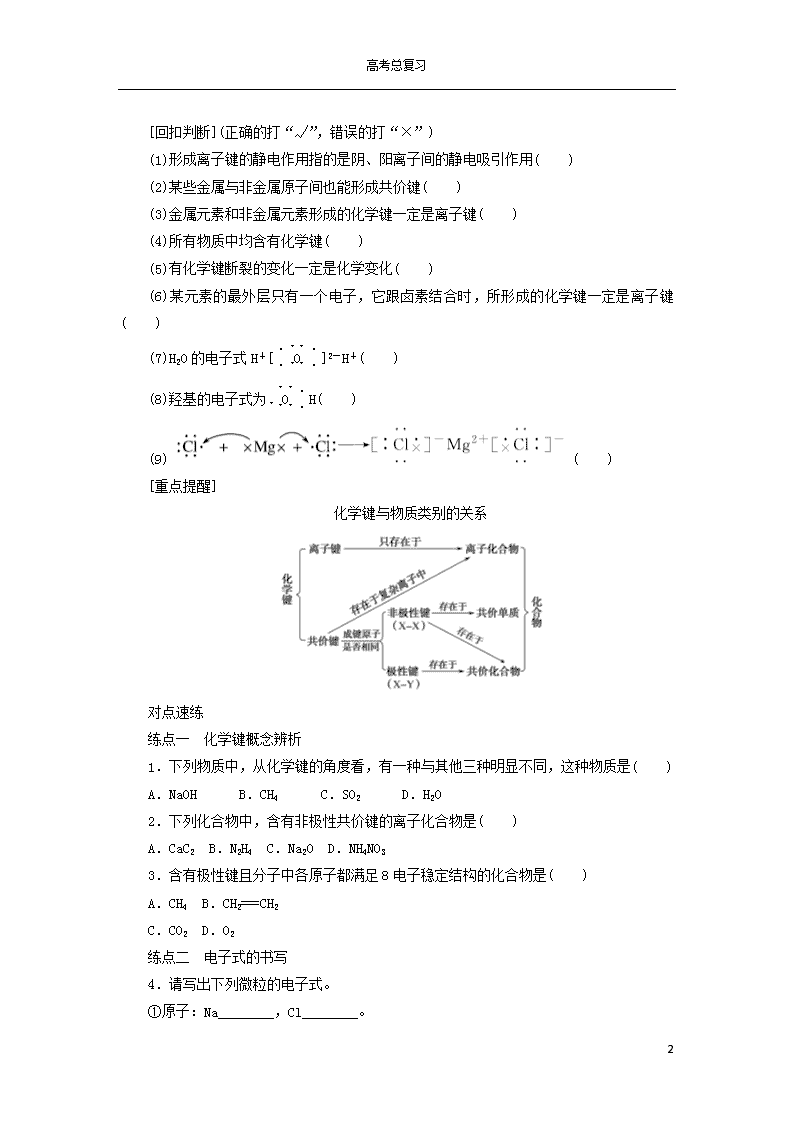
[重点提醒]
化学键与物质类别的关系
对点速练
练点一 化学键概念辨析
1.下列物质中,从化学键的角度看,有一种与其他三种明显不同,这种物质是( )
A.NaOH B.CH4 C.SO2 D.H2O
2.下列化合物中,含有非极性共价键的离子化合物是( )
A.CaC2 B.N2H4 C.Na2O D.NH4NO3
3.含有极性键且分子中各原子都满足8电子稳定结构的化合物是( )
A.CH4 B.CH2===CH2
C.CO2 D.O2
练点二 电子式的书写
4.请写出下列微粒的电子式。
①原子:Na________,Cl________。
11
高考总复习
②简单离子:Na+________,F-________。
③复杂离子:NH________,OH-________。
④离子化合物:
MgCl2________________________________________________________________________,
Na2O________________________________________________________________________,
Na2O2________________________________________________________________________。
⑤非金属单质及共价化合物:
N2________,H2O________,CO2________。
5.用电子式表示下列化合物的形成过程:
Na2S:________________________________________________________________________;
CaCl2:________________________________________________________________________;
CH4:________________________________________________________________________;
CO2:________________________________________________________________________。
练后感悟
电子式书写常见的5大误区
(1)漏写未参与成键的电子,如N2误写为N⋮⋮N,应写为:N⋮⋮N:
(2)化合物类型不清楚,漏写或多写[ ]及错写电荷数,如NaCl误写为·Na+::,应写为Na+[::]-,HF误写为H+[::]-,应写为H::
(3)不考虑原子间的结合顺序,如HClO的电子式为H:: :,而非H:::
(4)不考虑原子最外层有几个电子,均写成8电子结构,如CH的电子式为,而非
(5)不考虑AB2型离子化合物中2个B是分开写还是一起写,如CaBr2、CaC2的电子式分别为:
11
高考总复习
[::]-Ca2+[::]-、Ca2+[:C⋮⋮C:]2-
练点三 化学键与化合物类别
6.一定条件下,氨与氟气发生反应:4NH3+3F2===NF3+3NH4F,其中NF3空间结构与NH3相似。下列有关说法错误的是( )
A.除F2单质外,反应物和生成物均为共价化合物
B.NF3中各原子均满足8电子稳定结构
C.NF3中只含极性共价键
D.NH4F中既含有离子键又含有共价键
微粒间的作用与物质变化
知识梳理
1.化学键与化学反应
旧化学键的____和新化学键的____是化学反应的本质。
2.分子间作用力
(1)定义:________________的作用力,又称________。
(2)特点
分子间作用力比化学键____得多,它主要影响物质的____、____等物理性质,而化学键主要影响物质的化学性质。
(3)变化规律
一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力____,物质的熔、沸点也____。例如,熔、沸点:I2____Br2____Cl2____F2。
3.氢键
(1)定义:分子间存在的一种比分子间作用力____的相互作用。
(2)形成条件
除H外,形成氢键的原子通常是____、____、____。
(3)存在
氢键存在广泛,如蛋白质分子、醇、羧酸分子、H2O、NH3、HF等分子之间。分子间氢键会使物质的熔点和沸点____。
11
高考总复习
[回扣判断](正确的打“√”,错误的打“×”)
(1)共价化合物溶于水,分子内共价键被破坏,单质溶于水,分子内共价键不被破坏( )
(2)共价化合物熔点都低于离子化合物( )
(3)分子内共价键越强,分子越稳定,其熔、沸点也越高( )
(4)有化学键断裂的变化一定是化学变化( )
[重点提醒]
化学键与物质的溶解或熔化过程
(1)离子化合物的溶解或熔化过程
离子化合物溶于水或熔化后均电离成自由移动的阴、阳离子,离子键被破坏。
(2)共价化合物的溶解过程
①有些共价化合物溶于水后,能与水反应,其分子内共价键被破坏,如CO2和SO2等。
②有些共价化合物溶于水后,与水分子作用形成水合离子,从而发生电离,形成阴、阳离子,其分子内的共价键被破坏,如HCl、H2SO4等。
③某些共价化合物溶于水后,其分子内的共价键不被破坏,如蔗糖(C12H22O11)、酒精(C2H5OH)等。
(3)单质的溶解过程
某些活泼的非金属单质溶于水后,能与水反应,其分子内的共价键被破坏,如Cl2、F2等。
对点速练
练点一 化学键与物质的性质
1.从化学键的观点看,化学反应的实质是“旧键的断裂和新键的形成”,据此你认为下列变化属于化学变化的是( )
①对空气进行降温加压 ②金刚石变成石墨 ③NaCl熔化 ④碘溶于CCl4中 ⑤HCl溶于水电离出H+和Cl-
⑥电解熔融的Al2O3制取Al
A.②③⑤ B.②⑤⑥
C.②⑥ D.②③⑤⑥
2.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
A.将SO2通入水中 B.烧碱溶于水
C.将HCl通入水中 D.硫酸氢钠溶于水
3.现代无机化学对硫氮化合物的研究是最为活跃的领域之一。如图是已经合成的最著名的硫氮化合物的分子结构。下列说法不正确的是( )
11
高考总复习
A.该物质的分子式为S4N4
B.该物质各原子最外层都达到8电子稳定结构
C.该物质的分子中既含有极性键又含有非极性键
D.该分子中N的化合价为-3
练点二 分子间作用力和氢键
4.在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是( )
A.范德华力、范德华力、范德华力
B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键
D.共价键、共价键、共价键
5.下列现象与氢键有关的是( )
①NH3的熔、沸点比ⅤA族其他元素氢化物的高;②小分子的醇、羧酸可以和水以任意比互溶;③冰的密度比液态水的密度小;④水分子高温下很稳定
A.①②③④ B.①②③ C.①② D.①③
6.下图中每条折线表示元素周期表中第ⅣA~ⅦA族中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是( )
A.H2S B.HCl C.PH3 D.SiH4
练后归纳
化学键对物质性质的影响
(1)对物理性质的影响
金刚石、晶体硅、石英、金刚砂等物质硬度大、熔点高,就是因为其中的共价键很强,破坏时需消耗很多的能量。
11
高考总复习
NaCl等部分离子化合物,也有很强的离子键,故熔点也较高。
(2)对化学性质的影响
N2分子中有很强的共价键,故在通常状况下,N2很稳定;
H2S、HI等分子中的共价键较弱,故它们受热时易分解。
1.[2018·全国卷Ⅲ]W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到含YZW的溶液。下列说法正确的是( )
A.原子半径大小为W<X<Y<Z
B.X的氢化物水溶液酸性强于Z的
C.Y2W2与ZW2均含有非极性共价键
D.标准状况下W的单质状态与X的相同
2.[2018·天津卷,2]下列有关物质性质的比较,结论正确的是( )
A.溶解度:Na2CO3W
C.化合物熔点:Y2X3 > >
3.(1)稍强 (2)O F N (3)升高
回扣判断 答案:(1)× (2)× (3)× (4)×
2对点速练
1.答案:C
2.解析:A项,只破坏共价键;B项,只破坏离子键;C项,只破坏共价键;D项,NaHSO4===Na++H++SO,离子键和共价键都被破坏。
答案:D
3.解析:由图可知,该分子的分子式为S4N4,A正确;因为S原子最外层为6个电子,若形成两个共价单键,则达8电子稳定结构,N原子最外层为5个电子,若形成3个共价单键,则达8电子稳定结构,据图可知,B正确;该分子中既含有极性键(N—S键)又含有非极性键(N—N键),C正确;N—S共用电子对偏向N,N—N共用电子对不偏移,故该分子中N的化合价为-2,D错误。
答案:D
4.解析:“石蜡→液体石蜡→石蜡蒸气”属于石蜡的 “三态”之间的转化,由于石蜡属于分子晶体,所以转化的过程中要克服分子间作用力;“石蜡蒸气→裂化气”属于石油的裂化,属于化学变化,必然要破坏化学键(共价键),答案选B。
答案:B
5.解析:水分子高温下很稳定是因为分子中O—H键的键能大。
答案:B
6.解析:在第ⅣA~ⅦA族元素的氢化物中,NH3、H2O、HF因存氢键,故沸点反常的高,则含a的线为第ⅣA族元素的氢化物,则a点为SiH4。
答案:D
真题全体验
1.解析:根据元素周期律,可知原子半径:Na>Cl>O>F,A项错误;HF是弱酸,HCl为强酸,酸性:HF<HCl,B项错误;Na2O2中O原子与O原子之间以非极性键结合,ClO2的结构式为O—Cl—O,无非极性键,C项错误;标准状况下,F2、O2均为气态,D项正确。
答案:D
11
高考总复习
2.解析:碳酸钠的溶解度大于碳酸氢钠的溶解度,A项错误;非金属性:Cl>P,故气态氢化物的热稳定性: HCl>PH3,B项错误;C2H5SH、C2H5OH均为分子晶体,但C2H5OH能够形成分子间氢键,故沸点:C2H5SHBe,故最高价氧化物对应的水化物的碱性:LiOH>Be(OH)2,D项错误。
答案:C
3.解析:根据短周期元素W、X、Y和Z在周期表中的相对位置可知四种元素位于二、三周期,又知这四种元素原子的最外层电子数之和为21,可设Y的最外层电子数为x,则有x+(x+2)+(x+3)+(x+4)=21,x=3,所以W、X、Y、Z依次为N、O、Al、Cl。A项,NH3分子之间存在氢键,故沸点:NH3>HCl,错误;B项,Y的氧化物对应水化物为Al(OH)3,W的氧化物对应水化物若为HNO3,则HNO3酸性强于Al(OH)3,错误;C项,Al2O3为离子晶体,而AlCl3为分子晶体,离子键要比分子间作用力强得多,故一般离子晶体、熔沸点高于分子晶体熔沸点,错误;D项,O2-与Al3+的电子层结构相同,但O2-的核电荷数少,故其半径较大,正确。
答案:D
4.解析:由题干信息可知,X、Y、Z、M四种元素分别为:C、Mg、Si、S。
(1)由S原子的结构示意图,可知S位于第三周期、ⅥA族。
(2)Z是硅元素,在自然界中常见的二元化合物为SiO2。
(3)C与S的单质在高温下反应的化学方程式为C+2SCS2,不同原子吸引电子对的能力不同,故C和S之间的化学键为极性共价键。
(4)镁单质可用于航空航天合金材料的制备,镁单质与盐酸发生置换反应:Mg+2HCl===MgCl2+H2↑。
答案:(1)三 ⅥA
(2)Si SiO2
(3)C+2SCS2 极性
(4)Mg Mg+2HCl===MgCl2+H2↑
11
相关文档
- 高中化学课时作业4离子键苏教版必2021-08-249页
- 高中化学必修一全册课后优化训练:1-2021-08-246页
- 四川省南充市高中2020届高三第一次2021-08-249页
- 2020高中化学第三章烃的含氧衍生物2021-08-245页
- 2020版高中化学 第1章 认识化学科2021-08-243页
- 2020版高中化学 第2章第1节与化学2021-08-2412页
- 2019高中化学 第一章 从实验学化学2021-08-246页
- 高中化学第四章电化学基础4金属的2021-08-243页
- 2019-2020学年高中化学人教版必修22021-08-2414页
- 高中化学选修五(人教版 练习):第三章 2021-08-246页