- 1.69 MB
- 2021-08-24 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第2课时 化学反应为人类提供能量
一、化学反应为人类提供能量
1.物质发生化学反应的实质与能量变化的原因
2.化学反应中能量转化的主要形式
(1)即热饭盒、铝热反应:化学能主要转化为热能;
(2)电解饱和食盐水制备烧碱、氢气和氯气:电能主要转化为化学能。
17
(3)绿色植物进行光合作用时,光能转化为化学能。
(4)煤燃烧时,化学能主要转化为热能和光能。
例1 下列说法中正确的是( )
A.化学反应中的能量变化,其表现形式除热能外还可能是光能和电能等
B.化学反应中的能量变化不一定遵循能量守恒定律
C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同
D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
考点 化学能与热能的相互转化
题点 化学反应中能量变化的相关综合
答案 A
解析 化学反应中的能量变化一定遵循能量守恒定律;物质发生化学反应都伴随着能量的变化,所以反应物的总能量与生成物的总能量一定不同;在一个确定的化学反应中,反应物的总能量(E1)与生成物的总能量(E2)之间的关系:E1>E2,化学反应为放热反应,E1<E2,化学反应为吸热反应。
思维启迪
任何化学反应除遵循质量守恒定律外,同样也遵循能量守恒定律,不同形式的能量之间可以转化,但总能量保持不变。反应物与生成物的能量差若以热能形式表现出来,即为放热反应或吸热反应。
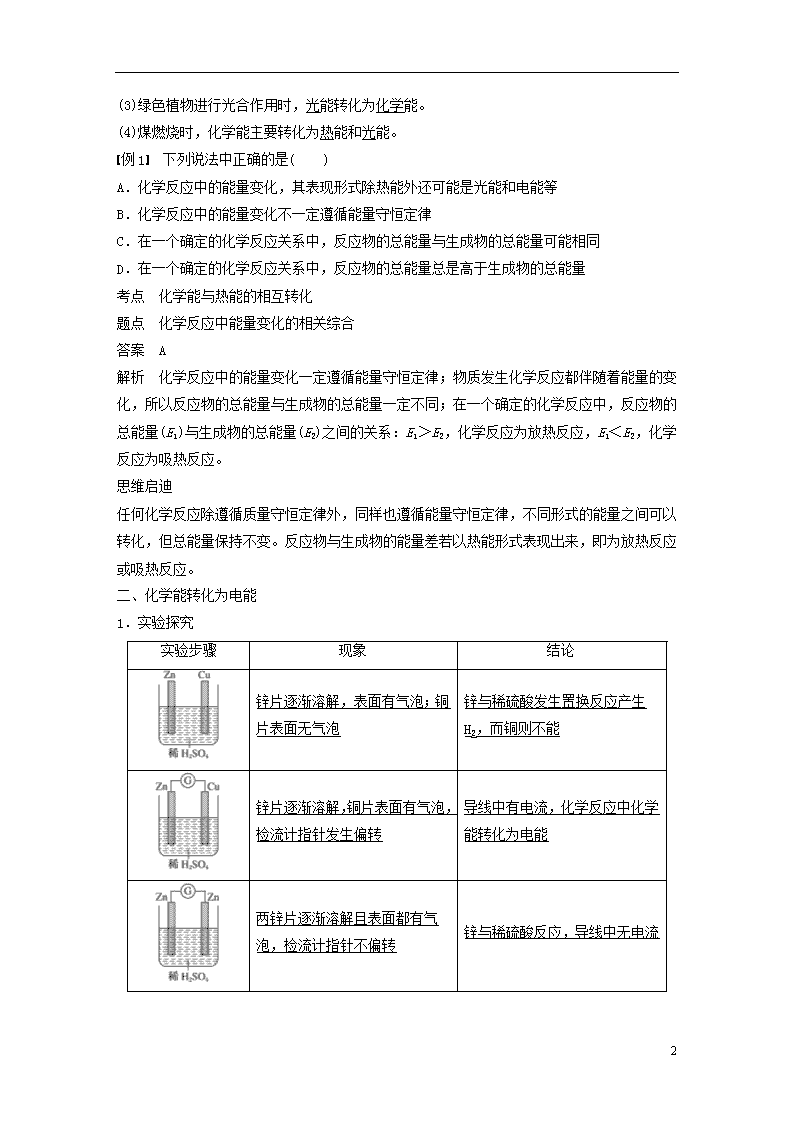
二、化学能转化为电能
1.实验探究
实验步骤
现象
结论
锌片逐渐溶解,表面有气泡;铜片表面无气泡
锌与稀硫酸发生置换反应产生H2,而铜则不能
锌片逐渐溶解,铜片表面有气泡,检流计指针发生偏转
导线中有电流,化学反应中化学能转化为电能
两锌片逐渐溶解且表面都有气泡,检流计指针不偏转
锌与稀硫酸反应,导线中无电流
17
无现象
乙醇是非电解质,导线中无电流
2.原电池的概念
原电池是将化学能转化为电能的装置;
原电池的反应本质是氧化还原反应。
3.原电池的构成条件
理论上,自发的氧化还原反应均可构成原电池。
具体条件是:(1)具有活动性不同的两个电极(金属与金属或金属与能导电的非金属)。
(2)溶液:两电极均插入电解质溶液中。
(3)导线:两电极用导线相连,形成闭合回路。
4.原电池的工作原理
(1)分析下图并填空
原电池总反应式:Zn+2H+===Zn2++H2↑;
(2)能量转化:化学能转变为电能。
5.原电池工作原理的应用
(1)比较金属活动性
原电池中,做负极的金属活动性一般比做正极的金属活动性强。
(2)改变化学反应速率
如:在Zn和稀硫酸反应时,滴加少量CuSO4溶液,则Zn置换出的铜和锌能构成原电池的正负极,从而加快Zn与稀硫酸反应的速率。
(3)设计原电池
如:把Fe+2Fe3+===3Fe2+设计成原电池,可用Fe做负极,铜(或石墨)做正极,FeCl3溶液做电解质溶液。
(4)制造多种化学电源
①干电池(又称一次电池):如锌锰电池;
②蓄电池(又称二次电池):如铅蓄电池、镍氢电池、锂电池(手机用);
17
③燃料电池:如氢氧燃料电池,其能量转化率高,对环境无污染。
(1)电子只能在导体中定向移动,不能通过溶液。
(2)电解质溶液中离子移动方向:阳离子移向正极、阴离子移向负极。
例2 如图所示装置能够组成原电池的是_________________________________________。
其他不能构成原电池的说明理由:__________________________________________________。
考点 能源与构成原电池的条件
题点 原电池的形成条件与判断方法
答案 EFG
A装置的两个电极的活泼性相同,电子不会流动形成电流;B装置为非电解质溶液,不能发生氧化还原反应;C装置电解质溶液在两个分开的装置中,不成形成闭合回路;D装置无导线连接电极,不能形成闭合回路。它们均不能构成原电池
思维启迪——原电池的判断方法
一看反应原理(能否自发地进行氧化还原反应);二看构成条件(两极一液成回路:两个活泼性不同的电极,插入电解质溶液中,装置形成闭合回路)。
例3 如图所示检流计的指针发生偏转,同时A极的质量减小,B极上有气泡产生,C为电解质溶液,下列说法错误的是( )
A.B极为原电池的正极
B.A、B、C分别可以为Zn、Cu和稀盐酸
17
C.C中阳离子向A极移动
D.A极发生氧化反应
考点 原电池工作原理及正负极的判断
题点 原电池工作原理
答案 C
解析 原电池中,负极金属失去电子,发生氧化反应溶解,质量减小,故A极为负极,B极为正极,A、D项正确;A、B、C分别为Zn、Cu和稀盐酸时,可以构成原电池,且现象符合题意,B项正确;电解质溶液中阳离子移向正极,C项错误。
17
思维启迪——多个角度判断原电池的正极和负极
例4 ①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活泼性由大到小的顺序是( )
A.①③②④ B.①③④②
C.③④②① D.③①②④
答案 B
解析 ①②相连时,外电路电流从②流向①,则金属活泼性①大于②;①③相连时,③为正极,则金属活泼性①大于③;②④相连时,②上有气泡逸出,则金属活泼性④大于②;③④相连时,③的质量减少,则金属活泼性③大于④,故金属活泼性由大到小的顺序为①③④②。
思维启迪——形成原电池、比较金属活动性
根据原电池原理比较金属活动性,做负极的金属活动性较强,做正极的金属活动性较弱。
例5 某原电池的离子方程式是Zn+Cu2+===Zn2++Cu,该原电池正确的组成是( )
选项
正极
负极
电解质溶液
A
Cu
Zn
HCl
B
Zn
Cu
CuSO4
C
Cu
Zn
CuSO4
D
Cu
Zn
ZnCl2
考点 原电池原理的应用
题点 设计原电池
答案 C
解析 将Zn+Cu2+===Zn2++Cu拆成两个半反应:
氧化反应(负极反应):Zn-2e-===Zn2+。
还原反应(正极反应):Cu2++2e-===Cu。
则电池的负极是Zn,正极是比锌不活泼的金属或导电的非金属,电解质溶液中含Cu2+。
方法技巧——设计原电池的方法
17
(1)依据:已知一个氧化还原反应,首先分析找出氧化剂、还原剂,一般还原剂为负极材料(或在负极上被氧化),氧化剂(电解质溶液中的阳离子)在正极上被还原。
(2)选择合适的材料
①电极材料:电极材料必须导电。负极材料一般选择较活泼的金属材料,或者在该氧化还原反应中,本身失去电子的材料。
②电解质溶液:电解质溶液一般能与负极反应。
原电池是把化学能转化为电能的装置。其工作原理是
1.判断正误(正确的打“√”,错误的打“×”)
(1)用导线连接铜片和锌片插入到稀H2SO4中,锌片上有大量气泡( )
(2)原电池中电子流出的一极是正极,发生氧化反应( )
(3)NaOH+HCl===NaCl+H2O是放热反应,可以设计成原电池( )
(4)原电池中的阳离子由负极区向正极区移动( )
(5)在Zn|稀硫酸|Cu原电池中,电子由锌通过导线流向铜,再由铜通过电解质溶液到达锌( )
(6)把锌粒放入盛有盐酸的试管中,加入几滴CuCl2溶液,气泡放出速率加快( )
答案 (1)× (2)× (3)× (4)√ (5)× (6)√
2.(2017·北京101中学期中)下列设备工作时,将化学能转化为电能的是( )
A
B
C
D
锂离子电池
太阳能集热器
燃气灶
硅太阳能电池
考点 能源与构成原电池的条件
题点 能量的转化方式
17
答案 A
解析 A项,锂离子电池是把化学能转化为电能,故正确;B项,太阳能集热器是把太阳能转化为热能,故错误;C项,燃烧是放热反应,是把化学能转化为热能,故错误;D项,硅太阳能电池是把太阳能转化为电能,故错误。
3.(2017·合肥高一检测)某学生将检流计用导线与两个电极连接在一起,再将两个电极同时插入某种电解质溶液中,能观察到有电流产生的是( )
A.用铜片、铅笔芯做电极插入稀硫酸中
B.用两个铜片做电极插入硝酸银溶液中
C.用锌片、铜片做电极插入番茄中
D.用铜片、铁片做电极插入酒精中
答案 C
解析 要构成原电池,除要形成闭合回路外,还需要有两个活动性不同的电极材料,一般其中一个电极要能与电解质溶液发生自发的氧化还原反应。A项,铜和石墨与稀硫酸均不反应;B项,电极材料相同;D项,酒精是非电解质;C项,一些水果中含有有机酸,可做电解质溶液。
4.(2017·湖南郴州适应性测试)如图为某兴趣小组制作的番茄电池,下列说法正确的是( )
A.电子由铜通过导线流向锌
B.该装置是将电能转化为化学能的装置
C.锌电极发生氧化反应
D.电流由锌通过导线流向铜
考点 原电池工原理和正负极的判断
题点 原电池工作原理
答案 C
解析 A项,铜做正极,锌做负极,因此电子由锌流向铜,故错误;B项,该装置将化学能转化为电能,故错误;C项,锌做负极失去电子,发生氧化反应,故正确;D项,电子与电流的方向相反,因此电流由铜极流向锌极,故错误。
5.如图所示装置,检流计指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
17
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀AgNO3溶液
D.A是Ag,B是Fe,C为稀AgNO3溶液
答案 D
解析 A极逐渐变粗,说明A极为原电池的正极,溶液中的金属阳离子得到电子后在A极上析出;B极逐渐变细,说明B极为原电池的负极,失去电子后变成离子进入溶液中。A和B两项中的反应为Zn+H2SO4===ZnSO4+H2↑,则在A选项中A极变细,B选项中A极不变。C和D两项中的反应为Fe+2AgNO3===2Ag+Fe(NO3)2,其中C选项中A极变细,D选项中A极变粗。
6.在铜锌原电池中(如下图),以硫酸铜为电解质溶液,锌为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式为_______________________________。
锌片上观察到的现象为__________________________________________________________;
铜为________极,电极上发生的是________(填“氧化”或“还原”)反应,电极反应式________________________________________________________________________;铜片上观察到的现象为______________________________________________________________,原电池总反应的离子方程式为_______________________________________________________。
考点 原电池工作原理和正负极的判断
题点 常考多变的锌铜原电池
答案 负 氧化 Zn-2e-===Zn2+ 锌片溶解 正 还原 Cu2++2e-===Cu 铜极变粗 Zn+Cu2+===Zn2++Cu
解析 CuSO4溶液为电解质溶液时,铜锌原电池的负极为锌,电极反应式为Zn-2e-===Zn2+,所以锌片不断溶解,正极为铜,电极反应式为Cu2++2e-===Cu,所以铜极不断变粗,原电池总反应式为Zn+Cu2+===Zn2++Cu。
[对点训练]
题组一 原电池的构成条件
17
1.下列各组的电极材料和电解液,不能组成原电池的是( )
A.铜片、石墨棒,乙醇
B.铜片、石墨棒,硝酸银溶液
C.锌片、铜片,稀盐酸
D.铜片、铂片,FeCl3溶液
答案 A
2.如图所示各装置中,不能构成原电池的是(烧杯中所盛液体都是稀硫酸)( )
考点 能源与构成原电池的条件
题点 原电池的形成条件与判断
答案 D
解析 原电池的形成条件包括活动性不同的电极、电解质溶液、形成闭合回路、自发进行氧化还原反应。对图示各个装置进行观察,发现只有D不能形成闭合回路,因此不能形成原电池。
题组二 原电池工作原理
3.下列关于原电池的叙述,正确的是( )
A.构成原电池的正极和负极材料必须是两种活泼性不同的金属
B.原电池是将化学能转变为电能的装置
C.在原电池中,电子流出的一极是负极,该电极被还原
D.原电池放电时,电流的方向是从负极到正极
考点 原电池工作原理和正负极的判断
题点 原电池构成和原理的理解
答案 B
解析 构成原电池的正极和负极可以是两种活泼性不同的金属,也可以是导电的非金属(如石墨棒)和金属,A错误;原电池是将化学能转变为电能的装置,B正确;在原电池中,负极上发生失去电子的氧化反应,正极上发生得到电子的还原反应,所以电子从负极沿导线流向正极,C错误;原电池放电时,电子从负极沿导线流向正极,则电流的方向是从正极到负极,D错误。
17
4.如图所示,两电极一为碳棒,一为铁片,若检流计的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是( )
A.a为负极,是铁片,烧杯中的溶液为硫酸
B.b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C.a为正极,是碳棒,烧杯中的溶液为硫酸
D.b为正极,是碳棒,烧杯中的溶液为硫酸铜溶液
答案 C
解析 Fe、C形成的原电池中,负极铁失去电子,变成+2价的亚铁离子,由于a极上有大量气泡产生,所以为正极(C):2H++2e-===H2↑,a为正极,是碳棒;b为负极,是铁片;电解质溶液为硫酸溶液。
5.某实验兴趣小组按如图装置实验后,所记录内容合理的是( )
实验记录
①Zn片为负极,质量减少,Cu为正极,质量不变;
②外电路电流方向是:由Cu→Zn;
③SO向Zn极移动,Cu2+向Cu极移动;
④Zn电极发生氧化反应;
⑤正极反应式:Cu2++2e-═Cu;
⑥电子流动方向:锌极→导线→铜极→电解质溶液→锌极
A.①②④ B.②③④
C.②③④⑤ D.③⑤⑥
答案 C
解析 该装置为原电池,锌片为负极,发生氧化反应,电极反应为Zn-2e-===Zn2+,铜片为正极,铜片上发生还原反应,电极反应为Cu2++2e-===Cu,电子由锌片经导线流向铜片,电解质溶液中没有电子通过,SO向负极Zn极移动,Cu2+向正极Cu极移动,电流由铜片经导线流向锌片。
6.人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-。据此判断氧化银是( )
17
A.负极,被氧化 B.正极,被还原
C.负极,被还原 D.正极,被氧化
考点 原电池工作原理和正负极的判断
题点 正、负极的判断
答案 B
解析 电池的电极反应式:Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag+2OH-,从中可以看出锌的化合价升高,所以锌为负极,被氧化,而氧化银中的银化合价降低,被还原,故氧化银为正极,被还原,故B符合题意。
7.(2017·武汉高一检测)如图将锌片和铜片用导线连接后放入稀硫酸中,发生原电池反应,下列叙述错误的是( )
A.溶液的pH增大
B.溶液中的Zn2+浓度增大
C.溶液中的SO浓度增大
D.溶液的密度增大
考点 原电池的工作原理和正负极的判断
题点 常考多变的锌铜原电池
答案 C
解析 A项,氢离子浓度降低,溶液的pH增大,正确;B项,锌不断溶解,溶液中的Zn2+浓度增大,正确;C项,由于在反应过程中溶液中的SO没有参加反应,所以溶液中c(SO)不变,错误;D项,原电池放电时,溶液由硫酸溶液逐渐变成硫酸锌溶液,所以溶液的密度增大,正确。
8.(2018·哈六中期中)有关电化学知识的描述正确的是( )
A.CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中一定是银作正极
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极、铜作正极
D.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
答案 D
17
解析 所给反应不是氧化还原反应,没有电子转移,虽然为放热反应,但不能将该反应设计成原电池,A项错误;根据所给反应,负极材料应该是Cu,但正极材料可以用Ag,也可以用碳棒等惰性电极,B项错误;当铁和铜作为电极放入浓硝酸中时,铁因钝化瞬间停止反应,而铜可持续被浓硝酸溶解,所以铜是负极,C项错误。
题组三 原电池工作原理的应用
9.X、Y、Z、W四种金属片浸在稀盐酸中,用导线连接,可以组成原电池,实验结果如图所示:
则四种金属的活泼性由强到弱的顺序为( )
A.Z>Y>X>W B.Z>X>Y>W
C.Z>Y>W>X D.Y>Z>X>W
考点 原电池工作原理的应用
题点 比较金属活泼性的强弱
答案 A
10.(2018·南宁六中5月考试)下面是四个化学反应,你认为理论上不可用于设计原电池的化学反应是( )
A.2Al+2NaOH+2H2O===2NaAlO2+3H2↑
B.2H2+O22H2O
C.Mg3N2+6H2O===3Mg(OH)2+2NH3↑
D.CH4+2O2CO2+2H2O
考点 原电池原理的应用
题点 能否设计原电池的化学反应分析
答案 C
解析 只有属于氧化还原反应,才能用于设计原电池;A、B、D属于氧化还原反应,均可以设计为原电池。C不属于氧化还原反应,不能设计成原电池,C正确。
11.(2018·北京四中4月月考)为将反应2Al+6H+===2Al3++3H2
17
↑的化学能转化为电能,下列装置能达到目的的是(铝条均已除去氧化膜)( )
考点 原电池原理的应用
题点 原电池的设计
答案 B
解析 A项为原电池,铝为负极,但总反应为2Al+2OH-+6H2O===2[Al(OH)4]-+3H2↑,不符合;C项为原电池,但硝酸是氧化性酸,则总反应为Al+4H++NO===Al3++NO↑+2H2O,不符合;D项装置中有外接电源,不属于原电池,不符合。
12.小颖同学用如图所示装置研究原电池原理,下列说法错误的是( )
A.若将图1装置的Zn、Cu直接接触,Cu片上能看到气泡产生
B.图2装置中SO向Cu片移动
C.若将图2中的Zn片改为Mg片,Cu片上产生气泡的速率加快
D.图2与图3中正极生成物的质量比为1∶32时,Zn片减轻的质量相等
考点 原电池原理的应用
题点 原电池工作原理的探究
答案 B
解析 Zn、Cu直接接触就能构成闭合回路而形成原电池,Cu片上可看到有气泡产生,A项正确;SO带负电荷,应该向负极Zn片移动,B项错误;由于Mg的失电子能力强于Zn,所以将Zn片改为Mg片后,电子转移速率加快,生成H2的速率也加快,C项正确;假设图2中正极产生2 g H2,则转移2 mol电子,消耗负极65 g Zn,而图3中正极析出64 g Cu,也转移2 mol电子,消耗负极65 g Zn,故Zn片减轻的质量相等,D项正确。
17
[综合强化]
13.(2017·南宁高一检测)某同学为了探究原电池产生电流的过程,设计了如图实验。
(1)打开K,观察到的现象为
________________________________________________________________________
________________________________________________________________________。
(2)关闭K,观察到的现象是
________________________________________________________________________
________________________________________________________________________。
此电池的负极的电极反应式为
________________________________________________________________________
________________________________________________________________________。
(3)关闭K,溶液中阳离子向________(填“Zn”或“C”)极移动,外电路中,电子流动方向是________________________________________________________________________。
考点 原电池原理的应用
题点 原电池的综合探究实验
答案 (1)锌棒上附着有红色固体
(2)碳棒上附着有红色固体 Zn-2e-===Zn2+
(3)C Zn→C(或负极→正极)
解析 (1)打开K,锌与硫酸铜接触,置换出铜,所以可以看到锌棒上附着有红色固体。(2)关闭K,形成原电池,锌做负极,碳做正极,溶液中的铜离子在碳棒上得到电子生成铜,看到碳棒上附着有红色固体;负极反应为Zn-2e-===Zn2+。(3)关闭K,溶液中的阳离子向正极移动,即向碳棒移动,电子从锌出来经过导线流向碳。
14.(2017·咸宁高一检测)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Cu+2Ag+===2Ag+Cu2+”设计一个化学电池(正极材料用碳棒),回答下列问题:
(1)该电池的负极材料是________,发生________(填“氧化”或“还原”)反应,电解质溶液是____________。
(2)正极上出现的现象是________________________________________________________。
(3)若导线上转移电子1 mol,则生成银______ g。
考点 原电池原理的应用
题点 原电池的设计
17
答案 (1)Cu 氧化 AgNO3溶液
(2)碳棒上出现银白色物质
(3)108
解析 (1)根据电池的总反应,可知负极一般是失电子的物质,所以负极材料应该是铜,发生氧化反应,电解质溶液是一种可溶性的银盐溶液,所以是AgNO3溶液。(2)正极上是溶液中的银离子得到电子变成银单质,所以正极上的现象是碳棒上出现银白色物质。(3)当导线上转移1 mol电子的时候,正极上会析出1 mol银单质,所以正极上生成的银的质量是108 g。
15.某化学兴趣小组为了探究铝电极在原电池中的作用,在常温下,设计并进行了以下一系列实验,实验结果记录如下。
编号
电极材料
电解质溶液
检流计指针偏转方向
1
Al、Mg
稀盐酸
偏向Al
2
Al、Cu
稀盐酸
偏向Cu
3
Al、C(石墨)
稀盐酸
偏向石墨
4
Al、Mg
氢氧化钠溶液
偏向Mg
5
Al、Zn
浓硝酸
偏向Al
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所做的电极(正极或负极)是否相同?____________(填“是”或“否”)。
(2)由实验3完成下列填空:
①铝为________极,电极反应式:
________________________________________________________________________;
②石墨为________极,电极反应式:
________________________________________________________________________;
③电池总反应式:
________________________________________________________________________。
(3)实验4中铝做负极还是正极?________,理由是______________________________。
写出铝电极的电极反应式:________________________________________________。
(4)解释实验5中检流计指针偏向铝的原因:
________________________________________________________________________
________________________________________________________________________
________________________________________________________________________。
(5)根据实验结果总结出影响铝在原电池中做正极或负极的因素:
________________________________________________________________________。
考点 原电池工作原理和正负极的判断
17
题点 多角度判断正、负极
答案 (1)否 (2)①负 2Al-6e-===2Al3+ ②正
6H++6e-===3H2↑ ③2Al+6HCl===2AlCl3+3H2↑
(3)负极 在NaOH溶液中,活动性:Al>Mg Al+4OH--3e-===[Al(OH)4]-
(4)Al在浓硝酸中发生钝化,Zn在浓硝酸中发生反应,被氧化,即在浓硝酸中,活动性:Zn>Al,Al是原电池的正极
(5)①另一个电极材料的活动性;②电解质溶液
解析 在稀盐酸中的活动性:Mg>Al>Cu。由实验1和2可知,原电池中检流计指针是偏向正极。在实验3中检流计指针偏向石墨,由上述规律可知,Al是负极,石墨是正极,化学反应是Al失去电子被氧化为Al3+,盐酸中的H+得到电子被还原为H2。在NaOH溶液中活动性:Al>Mg,则Al是负极,Mg是正极。Al在浓硝酸中发生钝化,Zn在浓硝酸中被氧化,即在浓硝酸中活动性:Zn>Al,Zn是负极,Al是正极,所以在实验5中检流计指针偏向铝。
17
相关文档
- 高中化学必修1第4章第4节第1课时(氨2021-08-247页
- 化学(B)卷·2019届广西田阳高中高二12021-08-247页
- 人教版高中化学选修五 4_1 油脂第22021-08-243页
- 高中化学人教版必修2(练习)3_2_1 乙2021-08-2412页
- 2020高中化学 期末君之讲稿(九)配制2021-08-245页
- 人教版高中化学选修4练习:第三章章2021-08-248页
- 2020高中化学 共价键 分子的立体结2021-08-2411页
- 高中化学知识点大全2021-08-2414页
- 2019-2020学年新教材高中化学课后2021-08-247页
- 高中化学人教版选修四(课件)第四章 2021-08-2450页