- 987.05 KB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
12
课时
常见的化学反应及化学反应的应用
化学
|
第一部分 考点过关
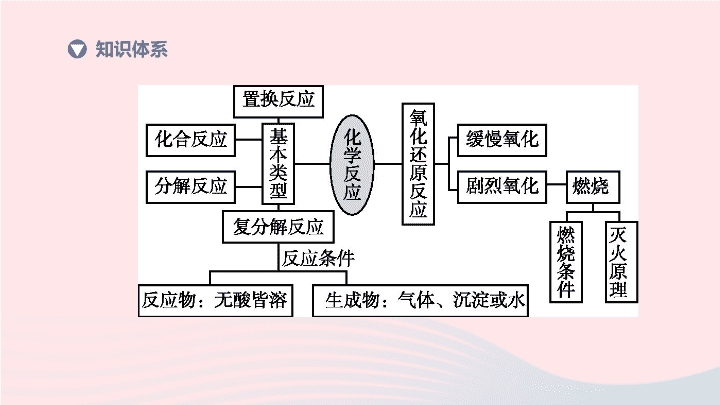
知识体系
反应类型
定义
表达式
特点
化合反应
由
物质反应
生成
物质的化学反应
A+B+…
M
多变一
1.
化合反应、分解反应、置换反应和复分解反应的特点
说明化合反应、分解反应、置换反应和复分解反应的特点,并能辨认具体化学反应的基本类型
.
(1)
基本反应类型特点
重点梳理
两种或两种以上
一种
反应类型
定义
表达式
特点
分解反应
由
物质反应
生成
_______________
物质
的化学反应
M
A+B
+…
一变多
置换反应
由一种
和一种
反应生成另一种
和另一种
的化学反应
A+BC B+AC
单换单
复分解
反应
由两种
互相
生成两种新的
的化学反应
AB+CD
AD+CB
双交换
价不变
(
续表
)
一种
两种或两种以上
单质
化合物
单质
化合物
化合物
变换成分
化合物
(2)
基本反应类型规律
①在
4
种基本反应类型中,一定有单质参加的反应是
反应,一定有单质生成的反应是
反应,一定没有单质参加和生成的反应是
反应
.
②知道复分解反应进行的条件
一般情况下,若反应物中没有酸,则其他反应物皆可溶;生成物中一定有
、
或
.
置换
置换
复分解
沉淀
气体
水
放出热量
吸收热量
(2)
化学能及能量的转化
①化学能:物质发生
时所释放的能量
.
②能量的转化:
如:化学能
→
热能
→
机械能
化学能
→
电能
→
光能
化学变化
【
注意
】
化学反应中往往伴随能量的变化,有些反应要从环境中吸收热量,有些则要放出热量
.
如氧化反应总是向环境放出热量;光合作用要吸收利用太阳能,在黑暗的环境里无法进行;呼吸作用一般是缓慢氧化的一种,也释放热量
.
3.
燃烧的条件,剧烈氧化和缓慢氧化,火灾自救的一般方法
(1)
列举说出一些缓慢氧化现象
缓慢氧化是进行速度慢、不易察觉,没有发光但有放热的一种氧化反应
.
如:
、呼吸作用和
等
.
(2)
列举一些剧烈氧化的现象
——
燃烧、爆炸
①燃烧:通常所说的燃烧是指可燃物跟
发生的一种
、
的剧烈的氧化反应
.
如:
、
等
.
金属的锈蚀
食物的腐败
氧气
发光
放热
木材的燃烧
天然气的燃烧
②爆炸:燃烧引起的爆炸是由于
或
在有限空间内达到
,遇到
迅速燃烧,瞬间产生大量的
,气体体积
造成的
.
爆炸
(
填
“
一定
”
或
“
不一定
”)
属于化学变化;由燃烧引起的爆炸
(
填
“
一定
”
或
“
不一定
”)
属于化学变化
.
③自燃:因缓慢氧化积聚热量使温度升高达到着火点,不经点火而自发燃烧起来
.
可燃性气体
易燃物粉尘
爆炸极限
明火
热
急剧膨胀
不一定
一定
④燃烧、爆炸、自燃都是氧化反应,都放出热量,但反应条件、剧烈程度、现象不同
.
图
H12-1
可燃物
与氧气
(
或空气
)
接触
温度达到着火点
隔离可燃物
隔绝氧气
温度降到着火点以下
(4)
列举火灾自救的有效措施
①发生火灾时,保持镇定,先了解火源的正确位置,然后报警求助
.
②楼内失火时,要关好门窗,以降低火势及烟雾蔓延的速度
.
③发现因电造成失火时,应先切断电源
.
④室内浓烟密布时,应匍匐在地上爬行并用湿毛巾捂住口鼻
.
⑤用湿毛巾等物品塞住门和窗户的缝隙,以免浓烟渗入
.
⑥打开窗户,在窗前呼叫求救
.
4.
催化剂在化学反应中的应用:
举例说明催化剂作用和催化剂
在化学反应中能改变其他物质的反应
,而本身的
和
在反应前后都不改变的物质叫催化剂
(
工业上称触媒
).
催化剂在反应中起的作用叫
.
速率
质量
化学性质
催化作用
【
注意
】
(1)
催化剂具有选择性,既不是万能的,也不是唯一的
.
(2)
应抓住
“
一变两不变
”
来正确理解:
①能
其他物质的化学反应速率,注意不要把其中的
“
改变
”
片面地理解为
“
加快
”
;
②反应前后本身的质量
;反应前后本身的化学性质
.
改变
不变
不变
5.
质量守恒定律
(1)
描述质量守恒定律
①内容:
反应的各物质的质量总和
反应
的各物质的质量总和
.
②验证:当有气体参加反应或反应后有气体生成时,该反应必须在
容器内进行才能验证质量守恒定律
.
③使用范围
a.
质量守恒定律只适用于
变化,不适用于
变化
.
b.
质量守恒定律指
“
质量
”
守恒,不包括其他方面的守恒,如体积等
.
c.
没有参加反应的物质的质量
(
填
“
能
”
或
“
不能
”)
计入
“
总和
”
中
.
参加化学
等于
生成
密闭
化学
物理
不能
(2)
会从分子、原子的角度解释质量守恒定律
微观解释:在化学反应前后,原子的
、
、
均保持不变
.
简略记法
“
二变六不变
”
:物质的种类、分子的种类一定改变;元素的种类、元素的质量、物质的总质量、原子的种类、原子的数目、原子的质量均不变
.
(3)
用质量守恒定律分析、解释常见现象
种类
数目
质量
6.
化学方程式,根据化学方程式进行生成物和反应物之间的计算
(1)
说出化学方程式的意义
①可以表示出反应物和生成物各是什么物质,该反应需要在什么条件下进行
.
②体现出反应物的一种化学性质,生成物的一种制法
.
③表现出反应中各物质之间的
和
比
.
④体现出质量守恒定律
.
分子个数
质量
(2)
正确书写常见的化学方程式
①书写原则
a.
必须遵守
. b.
必须遵循
.
②书写步骤
a.
将
的化学式写在左边,将
的化学式写在右边,中间用短线连接,并在短线上方注明
.
b.
在化学式的前边配上适当的数字使短线两边各
的个数相等,体现出
,然后将短线改为
.
c.
若反应中有气体或沉淀生成,应在该化学式右边注明
“
”
或
“
”
;如果反应物也有气体或不溶性固体,则无须注明
.
客观事实
质量守恒定律
反应物
生成物
反应条件
原子
质量守恒定律
等号
↑
↓
(3)
根据化学方程式进行生成物和反应物之间的计算
①根据化学方程式进行计算的一般步骤
a.
设未知数
(
用
x
或
y
等字母表示
)
;
b.
正确书写有关化学方程式
(
一定要配平
)
,同时注意标
“↑”
或
“↓”
等;
c.
计算出有关物质间的质量比
(
即相对分子质量和之比
)
,写在化学方程式相应的化学式正下方;
d.
有关物质的质量比下面写出已知量和未知量;
e.
将有关的四个量列成比例式,并求出未知量;
f.
简单地写出答案;
g.
单位问题
——
若设未知量时是
“
设
××
未知量为
x
”
,则求出未知量时一定要有单位,如
x
=25 g
,且单位左右不能加括号
.
②解题常见的错误
a.
未配平或分子式写错;
b.
求质量比时,忘记化学式前的系数,相对分子质量
(
总和
)
计算错误;
c.
填错有关反应物、生成物的已知量和未知量;
d.
必须是纯物质的质量,纯物质的质量
=
不纯物质的质量
×
纯度;
e.
同一物质分子式、相对分子质量
(
总和
)
与质量上下不对齐;
f.
比例式无法处理或计算错误
.
对点练习
考点
1
化合反应、分解反应、置换反应和复分解反应的特点
A
2.
[2018·
苏州
]
如图
H12-2
所示的化学反应基本类型是
(
)
图
H12-2
A.
化合反应
B.
分解反应
C.
置换反应
D.
复分解反应
A
考点
2
化学反应中的能量变化:知道化学反应中存在能量变化和转化
C
3.
下列叙述正确的是
(
)
A.
化学反应过程中都会发生放热现象
B.
在化学反应中只有燃烧反应才能放出热量
C.
化学反应伴随着能量变化
D.
人类利用的能量都是通过化学反应获得的
考点
3
燃烧的条件、剧烈氧化和缓慢氧化、火灾自救的一般方法
4.
[2019·
山西
]
土星是太阳系里的气态行星,约含有
92.4%
的
H
2
、
7.4%
的
He
和
0.2%
的
CH
4
等,平均温度为
-150 ℃.
它没燃烧成火球的原因可能有:①可燃物种类太多;②氦气含量太高;③没有适宜的温度;④没有支持燃烧的氧气
.
其中分析正确的一项是
(
)
A.
①②
B.
①③
C.
②④
D.
③④
[
答案
]
D
[
解析
]
物质燃烧的条件是可燃物、温度达到可燃物的着火点并与支持燃烧的物质接触。土星上约含有
92.4%
的
H
2
、
7
.
4%
的
He
和
0
.
2%
的
CH
4
等,平均温度为
-150 ℃
。它没有燃烧成火球的原因可能有:
③
燃烧必须达到可燃物的着火点,没有适宜的温度就不能燃烧;
④
氧气能支持氢气和甲烷燃烧,没有支持燃烧的氧气则燃烧不能发生。
考点
4
催化剂在化学反应中的应用:举例说明催化剂作用和催化剂
5.
[2019·
衢州
]
如图
H12-3
为小科与妈妈在牛排馆用餐的对话,小科叙述中的
“?”
可能是
(
)
图
H12-3
A.
加热还原氧化铜反应时通入足量氢气
B.
二氧化碳溶于水后加入紫色石蕊试液
C.
加热氯酸钾制取氧气时加入二氧化锰
D.
将氧化钙转化成氢氧化钙时要加入水
[
答案
]
C
[
解析
]
根据题意,加速了蛋白质分解的木瓜蛋白酶是生物催化剂;加热氯酸钾制取氧气时加入的二氧化锰同样能加快反应速率,是该反应的催化剂。
6.
小慧同学在一次实验中误把高锰酸钾当成了二氧化锰加入氯酸钾中,加热时,氯酸钾的分解速率明显加快
.
于是她惊奇地告诉同学小华:高锰酸钾也可以作为氯酸钾分解的催化剂
.
小华同学经过思考后,认为小慧同学得出的结论不科学
.
(1)
小华的理由是
.
(2)
如何证明高锰酸钾不是氯酸钾分解的催化剂:
.
(3)
高锰酸钾能加快氯酸钾分解速率的原因是
.
未验证反应前后高锰酸钾的质量和化学性质是否改变
单独加热
KMnO
4
能产生
O
2
,说明
KMnO
4
不是催化剂
高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,二氧化锰对氯酸钾的分解有催化作用,所以高锰酸钾能加快氯酸钾分解的速率
考点
5
质量守恒定律
C
7.
[2019·
张家界
]
我国古代典籍中有
“
银针验毒
”
的记载,其反应原理之一是
4Ag+2H
2
S+O
2
2X+2H
2
O.
则
X
的化学式为
(
)
A.S B.SO
2
C.Ag
2
S D.SO
3
8.
[2019·
徐州
]
甲、乙、丙、丁
4
种物质在密闭容器中充分反应,测得反应前后各物质的质量如下表所示
.
下列说法正确的是
(
)
A.
甲和丙两物质中的元素种类与丁元素种类不同
B.
乙一定是反应的催化剂
C.
参加反应的甲、丙的质量比一定是
7
∶
1
D.
甲、丁一定都是单质
C
物质
甲
乙
丙
丁
反应前质量
/g
30
3
6
8
反应后质量
/g
16
m
4
24
9.
四种物质在一定的条件下充分混合反应,测得反应前后各物质的质量分数如图
H12-4
所示
.
则有关说法中不正确的是
(
)
图
H12-4
A.
丁一定是化合物
B.
乙可能是这个反应的催化剂
C.
生成的甲、丙两物质的质量比为
8
∶
1
D.
参加反应的丁的质量一定等于生成甲和丙的质量之和
C
考点
6
化学方程式,根据化学方程式进行生成物和反应物之间的计算
10.
[2019·
上海
]
一定量甲烷
(CH
4
)
在氧气中不完全燃烧,生成一氧化碳、二氧化碳和水的物质的量之比可能为
(
)
A.1
∶
1
∶
2 B.2
∶
1
∶
4
C.2
∶
3
∶
6 D.3
∶
1
∶
8
D
11.
把干燥、纯净的氯酸钾和二氧化锰的混合物
31.5 g
装入大试管中,加热制取氧气
.
待完全反应后,将试管冷却、称量,得到
21.9 g
固体物质
.
计算制得氧气多少克
?21.9 g
固体物质中含有哪些物质
?
各多少克
?
例
1
初中化学的很多反应可以表示为甲
+
乙
→
丙
+
丁,其中甲、乙、丙、丁既可能是单质也可能是化合物
.
下列说法中,正确的是
(
)
A.
若甲、乙、丙、丁均是化合物,则该反应一定是复分解反应
B.
若甲、乙、丙分别是酸、碱、盐,则丁一定是水
C.
若甲是一氧化碳,乙是金属氧化物,则丙一定是二氧化碳
D.
若甲是锌,丙是氢气,则乙一定是稀硫酸
重点一 化合反应、分解反应、置换反应和复分解反应的特点
B
重点二 燃烧的条件
例
2
[2014·
杭州
]
小明在生活中观察到:点燃的小木棒燃烧端朝上,往往没燃尽就熄灭,而燃烧端朝下,往往不易熄灭
.
从燃烧的条件来看,你认为燃烧端朝上的小木棒,没燃尽就熄灭的最主要原因是
,若将小木棒事先涂油,燃烧端朝上也不易熄灭,请说明原因:
.
小木棒温度不易达到着火点
着火点较低的油燃烧产生热量,使小木棒温度较易达到着火点
【
变式
1
】
[2019·
北京
]
用如图
H12-5
所示装置进行实验
.
升温至
60 ℃
的过程中,仅①燃烧;继续升温至
260 ℃
的过程中,仅③燃烧
.
下列分析不正确的是
(
)
A.
①燃烧,说明白磷是可燃物
B.
对比①③,可说明红磷的着火点比白磷的高
C.
对比②③,可验证燃烧需可燃物与氧气接触
D.
④未燃烧,说明无烟煤不是可燃物
图
H12-5
[
答案
]
D
[
解析
]
升温至
60 ℃
的过程中,白磷燃烧,说明白磷是可燃物;对比
①③
,白磷在较低的温度下就能燃烧,红磷在较高的温度下才能燃烧,说明红磷的着火点比白磷高;
②
中的红磷被沙子覆盖,不能与氧气接触,
③
中的红磷露置在空气中与氧气接触,
②
中的红磷不燃烧,
③
中的红磷燃烧,说明可燃物燃烧需要与氧气接触;无烟煤属于可燃物,实验过程中没有燃烧,是因为温度未达到其着火点
.
重点三 催化剂在化学反应中的应用
例
3
为探究催化剂对过氧化氢
(H
2
O
2
)
分解的催化效果,某研究小组做了如下实验:
图
H12-6
实验一 图
H12-6
中的实验能否证明
MnO
2
是过氧化氢分解反应的催化剂
?
并说明理由:
.
不能;因为没有确认
MnO
2
的质量和化学性质在反应前后是否改变
数据记录表如下:
实验二 从表格的设计可以看出,该实验的目的是
.
1% H
2
O
2
溶液
/mL
50
50
50
加入
MnO
2
的质量
/g
0.1
0.2
0.4
测量
40 s
末得到
O
2
体积
/mL
MnO
2
质量的多少对
H
2
O
2
分解的速率是否有影响
【
变式
2
】
[2019·
金华
]
某品牌加酶洗衣粉使用方法中提示:用温水浸泡
.
某科学兴趣小组对该加酶洗衣粉洗涤效果与水温之间的关系进行研究,每次实验所选的衣料、奶渍的量、洗衣粉的用量和用水量均相同
.
在不同水温条件下,测得这种加酶洗衣粉除去衣服上奶渍所需的时间,实验结果如下表所示:
根据表中有关数据判断,能正确表示温度对该酶催化效率影响的图像是
(
)
水温
/℃
30
40
50
60
70
80
除去奶渍所需的时间
/s
28
12
6
4
12
17
图
H12-7
B
重点四 质量守恒定律
例
4
[2017·
杭州
]
小金进行如图
H12-8
所示实验来验证质量守恒定律
.
在实验中用电子天平和量筒准确测量出表中
m
1
、
m
2
、
m
3
、
m
4
和
V
(
实验中操作正确,
O
2
的密度为
ρ
g/cm
3
).
图
H12-8
实验序号
1
2
…
m
1
(MnO
2
)/g
m
2
(KClO
3
)/g
m
3
(
试管
)/g
m
4
(
试管
+
加热后剩余固体
)/g
量筒内收集气体的体积
V
/cm
3
(1)
装置中试管口略向下倾斜的原因是
.
(2)
根据质量守恒定律,
m
1
、
m
2
、
m
3
、
m
4
、
V
和
ρ
之间应存在的等量关系为
.
防止冷凝水倒流引起试管炸裂
m
1
+m
2
+m
3
-m
4
=
ρV
例
4
[2017·
杭州
]
小金进行如图
H12-8
所示实验来验证质量守恒定律
.
在实验中用电子天平和量筒准确测量出表中
m
1
、
m
2
、
m
3
、
m
4
和
V
(
实验中操作正确,
O
2
的密度为
ρ
g/cm
3
).
图
H12-8
实验序号
1
2
…
m
1
(MnO
2
)/g
m
2
(KClO
3
)/g
m
3
(
试管
)/g
m
4
(
试管
+
加热后剩余固体
)/g
量筒内收集气体的体积
V
/cm
3
部分
Cl
2
散失,未参加后续反应,导致部分锰元素以
K
2
MnO
4
形式存在,故剩余固体中
MnO
2
质量小于加热前
MnO
2
质量
【
变式
3
】
以下是俄国化学家罗蒙诺索夫曾开展的实验:
①先用天平称取质量为
m
1
的金属锡粉;
②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为
m
2
;
③打开容器,听到了空气进入容器发出的
“
嘶嘶
”
的声响,称量所得白色物质的质量为
m
3
;
④把白色物质放回原容器里
(
容器中空气的组成恢复到初始状态
)
,重新称量容器的总质量为
m
4
.
(1)
根据所学知识判断,锡的燃烧是
变化
.
化学
【
变式
3
】
以下是俄国化学家罗蒙诺索夫曾开展的实验:
①先用天平称取质量为
m
1
的金属锡粉;
②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为
m
2
;
③打开容器,听到了空气进入容器发出的
“
嘶嘶
”
的声响,称量所得白色物质的质量为
m
3
;
④把白色物质放回原容器里
(
容器中空气的组成恢复到初始状态
)
,重新称量容器的总质量为
m
4
.
(2)
罗蒙诺索夫分析数据后发现,生成白色物质的质量
m
3
=
,于是提出了
“
参加反应的物质的总质量,等于反应后产物的总质量
”
的观点
.
m
4
-m
2
+m
1
【
变式
3
】
以下是俄国化学家罗蒙诺索夫曾开展的实验:
①先用天平称取质量为
m
1
的金属锡粉;
②将这些锡粉放在密闭容器里进行完全燃烧,生成了白色固体物质,称量容器的总质量为
m
2
;③打开容器,听到了空气进入容器发出的
“
嘶嘶
”
的声响,称量所得白色物质的质量为
m
3
;④把白色物质放回原容器里
(
容器中空气的组成恢复到初始状态
)
,重新称量容器的总质量为
m
4
.
(3)
后经多位科学家的共同努力,最终确立了质量守恒定律,请从微观角度解释该定律:
________________________________________________________________
.
因为化学反应的过程是原子的重新组合过程,反应前后原子的种类、个数、质量不变,所以化学反应前后物质的总质量相等
重点五 化学方程式计算
例
5
牙膏中的摩擦剂可以增强牙膏对牙齿的摩擦作用和去污效果
.
已知某品牌牙膏中的摩擦剂是
CaCO
3
和
SiO
2
(SiO
2
不溶于水也不与稀盐酸反应
).
为了测定摩擦剂中
CaCO
3
的质量分数,通过实验测得如图
H12-9
所示数据:
(1)
生成
CO
2
质量为
g.
(2)
求摩擦剂中
CaCO
3
的质量分数
.
图
H12-
9
2.2
C
2.
[2018·
绵阳
]
人们常在可燃物建筑材料中添加阻燃剂以防止火灾,
Mg(OH)
2
是一种常见的阻燃剂,它在
380 ℃
时分解成水蒸气和耐高温的
MgO
,并吸收大量的热
.
下列说法错误的是
(
)
A.Mg(OH)
2
分解吸热能降低可燃物的着火点
B.Mg(OH)
2
分解吸热能降低可燃物的温度
C.Mg(OH)
2
分解的产物能使可燃物与氧气隔绝
D.MgCO
3
比
CaCO
3
易分解,也可作阻燃剂
A
3.
已知
FeCl
3
与
CuCl
2
对
H
2
O
2
分解都有催化作用,为测定并比较二者的催化效率,需要控制的条件包括
(
)
①实验温度 ②
H
2
O
2
的浓度
③催化剂质量 ④
FeCl
3
与
CuCl
2
的颗粒大小
A.
①②
B.
②③
C.
全部
D.
①②④
C
4.
根据化学方程式不能获得的信息是
(
)
A.
化学反应的快慢
B.
该反应中的反应物和生成物
C.
反应发生所需要的条件
D.
各反应物和生成物的质量比
A
5.
[2019·
兰州
]
工业中利用如下反应合成
SO
3
:
2SO
2
+O
2
2SO
3
.
一定条件下,在一密闭容器内投入
SO
2
、
O
2
、
SO
3
、
V
2
O
5
四种物质,在不同时刻测得各物质的质量
(
单位为克
)
如下表所示
.
下列说法不正确的是
(
)
A.
丁物质一定是催化剂
V
2
O
5
B.
参加反应的
SO
2
分子、
O
2
分子的个数比为
2
∶
1
C.
丙物质是
O
2
D.
d
=15
D
甲
乙
丙
丁
t
1
100
5
80
5
t
2
60
55
a
b
t
3
40
c
d
5
6.
为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与
10 g
赤铁矿石样品充分反应
(
杂质不参与反应
)
,并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图
H12-10
所示
.
图
H12-10
(1)
上述反应产生二氧化碳的质量为
g.
(2)
计算该赤铁矿石中氧化铁的质量分数
.
6.6
相关文档
- 新课标2020中考生物复习第九单元保2021-11-069页
- 新课标2020中考生物复习第八单元健2021-11-0644页
- 新课标2020中考生物复习第六单元生2021-11-0617页
- 2020中考生物复习方案第四单元生物2021-11-0652页
- 新课标2020中考生物复习第九单元保2021-11-0625页
- 江西专版2020中考生物复习第四单元2021-11-0617页
- 鄂尔多斯专版2020中考生物复习方案2021-11-066页
- 北京专版2020中考生物复习主题五生2021-11-066页
- 新课标2020中考生物复习第五单元生2021-11-0618页
- 新课标2020中考生物复习第三单元生2021-11-0123页