- 400.00 KB
- 2021-11-06 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
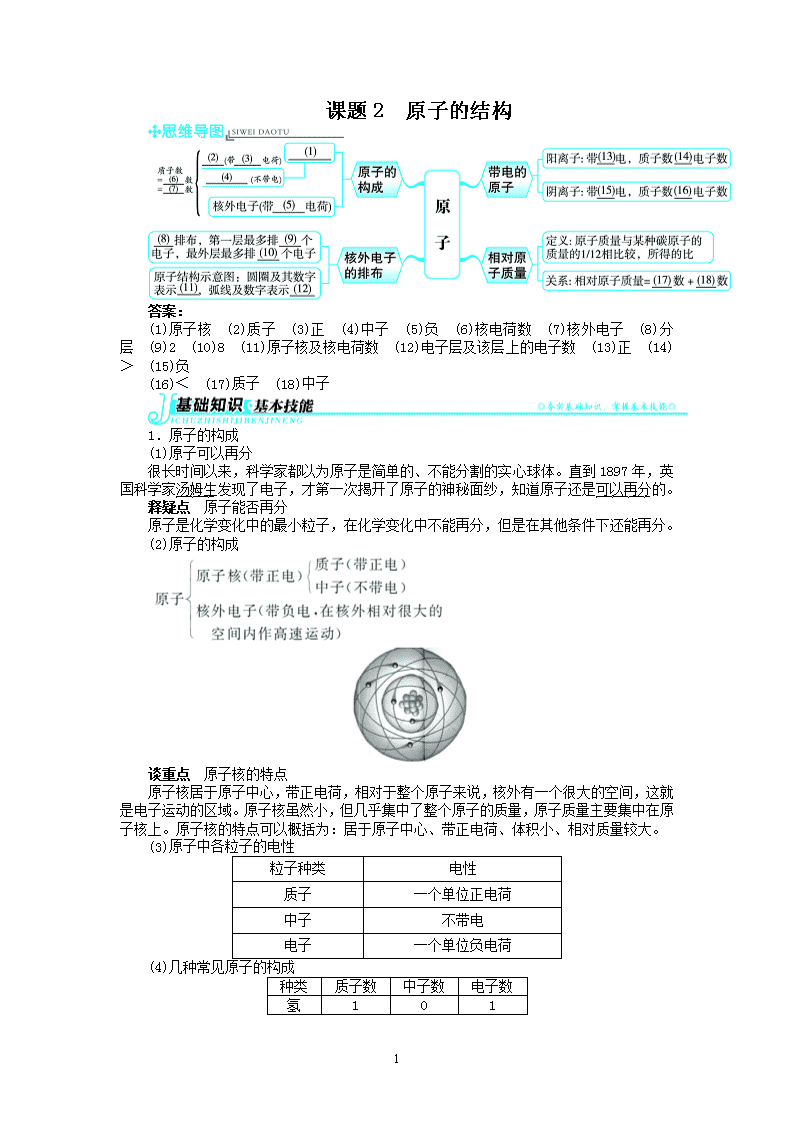
课题 2 原子的结构
答案:
(1)原子核 (2)质子 (3)正 (4)中子 (5)负 (6)核电荷数 (7)核外电子 (8)分
层 (9)2 (10)8 (11)原子核及核电荷数 (12)电子层及该层上的电子数 (13)正 (14)
> (15)负
(16)< (17)质子 (18)中子
1.原子的构成
(1)原子可以再分
很长时间以来,科学家都以为原子是简单的、不能分割的实心球体。直到 1897 年,英
国科学家汤姆生发现了电子,才第一次揭开了原子的神秘面纱,知道原子还是可以再分的。
释疑点 原子能否再分
原子是化学变化中的最小粒子,在化学变化中不能再分,但是在其他条件下还能再分。
(2)原子的构成
谈重点 原子核的特点
原子核居于原子中心,带正电荷,相对于整个原子来说,核外有一个很大的空间,这就
是电子运动的区域。原子核虽然小,但几乎集中了整个原子的质量,原子质量主要集中在原
子核上。原子核的特点可以概括为:居于原子中心、带正电荷、体积小、相对质量较大。
(3)原子中各粒子的电性
粒子种类 电性
质子 一个单位正电荷
中子 不带电
电子 一个单位负电荷
(4)几种常见原子的构成
种类 质子数 中子数 电子数
氢 1 0 1
2
碳 6 6 6
氧 8 8 8
钠 11 12 11
氯 17 18 17
辨误区 原子一定是由质子、中子、核外电子构成的吗
原子一般由质子、中子、核外电子这三种粒子构成,但某种氢原子中只有一个质子和一
个核外电子,无中子。
(5)原子中各种粒子之间的关系
①原子中,质子所带正电荷总数与核外电子所带负电荷总数相等,中子不带电,整个原
子不显电性。
②在原子中,核电荷数=质子数=核外电子数。
③不同种类的原子,核内质子数不同。
【例 1】下列关于原子的叙述,正确的是( )
A.原子是不能再分的粒子
B.一切原子的原子核都是由质子和中子构成的
C.原子核内质子数等于核外电子数
D.原子核内质子数必等于中子数
解析:
A × 原子在化学变化中不可再分
B × 原子核一般由质子和中子构成,但某种氢原子核内无中子
C √ 原子核内质子数等于核外电子数,不一定等于中子数D ×
答案:C
2.原子核外电子的排布
(1)电子层
核外电子运动不像汽车、火车一样有自己的运动路线,但也有自己的运动特点:在含有
多个电子的原子里,电子的能量并不同。能量低的电子通常在离核较近的区域内运动,能量
较高的在离核较远的区域内运动,科学家形象地将这些区域称为电子层。
释疑点 电子层真实存在吗
在原子中,电子层并不真实存在,只是科学家为了研究方便而进行的一种人为规定。
(2)核外电子的分层排布
核外电子是在不同的电子层内运动的,人们把这种现象叫做核外电子的分层排布。现在
发现的元素原子核外电子最少的有 1 层,最多的有 7 层。
①电子层数、电子能量、离核远近关系
电子层数――------------------------→一 二 三 四 五 六 七
电子 离核由近到远,能量由低到高
②核外电子的排布规律
a.第一层最多容纳 2 个电子,第二层最多容纳 8 个电子,最外层最多能容纳 8 个电子;
b.当第一层为最外层时,不超过 2 个电子;
c.电子尽先排在能量最低的内层,若内层排满有多余的电子再向外排。
(3)原子结构示意图
用原子结构示意图可以简明、方便地表示原子结构。小圈及圈内数字表示原子核和核内
质子数,弧线表示电子层,弧线上的数字表示该层的电子数。下图是钠元素的原子结构示意
图。
3
(4)原子结构与元素化学性质的关系
元素
分类
原子最外层
电子数
得失
电子
化学
性质
金属元素 一般少于 4 易失去最外层电子 活泼,易发生化学
反应非金属元素 一般多于 4 易得电子
稀有气体
元素 8(He 为 2) 不易得
失电子
稳定,极难发生化
学反应
析规律 最外层电子数决定元素的化学性质
元 素得失电子的化学性质决定于该元素原子的最外层电子
数。最外层电子数相同的原子,其化学性质相似。
【例 2】 根据给出的原子结构示意图,回答下列问题:
He Mg Ca
(1)Mg 和 Ca 的化学性质________(填“活泼”或“不活泼”)。
(2)He 的化学性质________(填“活泼”或“不活泼”)。
由此可知,最外层电子数相同时,化学性质________(填“一定”或“不一定”)相似。
解析:由原子结构示意图知,Mg 和 Ca 的最外层电子数均为 2,故二者都易失去 2 个电
子,化学性质活泼;He 虽然最外层(也是第 1 层)也是 2 个电子,但却达到了相对稳定结构,
不易 得失电子,化学性质不活泼。可见,最外层电子数相同时,元素的化学性质不一定相
似。
答案:(1)活泼 (2)不活泼 不一定
3.离子的形成
(1)离子的概念
带电荷的原子(或原子团)叫做离子。
(2)离子的分类
①阳离子:带正电荷的原子(或原子团)叫做阳离子,如 Na+ 、Ca2+、NH+
4 (铵根离子)。
②阴离子:带负电荷的原子(或原子团)叫做阴离子,如 O2-、Cl-、OH-。
(3)离子的形成
原子失去电子,带正电荷,形成阳离子(核电荷数=质子数>电子数)。
原子得到电子,带负电荷,形成阴离子(核电荷数=质子数<电子数)。
(4)离子的表示方法
①离子的表示方法
在元素符号(或原子团)的右上角标出所带的电荷及电性。标法是先写数字后写
“+”“-”号,读作“几个单位的正(负)电荷”。例如,带 2 个单位负电荷的氧离子,可
表示为“O2-”。只带 1 个单位电荷时,数字 1 省略不写,如 Na+、Cl-等;若要表示几个离
子,直接在离子符号前加上数字,如 2 个钠离子表示为“2Na+”。
②较复杂的离子(带电原子团,由两种以上元素原子组成,称为某某根离子)
离子名称 离子符号 离子所带电荷
氢氧根离子 OH- -1
硫酸根离子 SO2-
4 -2
硝酸根离子 NO-
3 -1
碳酸根离子 CO2-
3 -2
碳酸氢根离子 HCO-
3 -1
铵根离子 NH+
4 +1
③离子中数字的含义
4
(5)离子化合物的形成过程
以氯化钠的形成过程为例:因为钠原子的最外层电子数为 1,倾向 于失去 1 个电子;氯
原子的最外电子层上有 7 个电子,倾向于得到 1 个电子。当钠原子和氯原子化合时,钠原子
就会失去 1 个电子给氯原子,氯原子得到电子之后,形成最外层电子达到 8 电子的稳定结构
的 Na+和 Cl-,二者互相结合,成为 NaCl,可用下图表示:
――---------------→阴、阳离子静电作用 NaCl
【例 3—1】下列关于 Na 和 Na+的说法,不正确的是( )
A.核内质子数相同
B.核外电子数相同
C.核电荷数相同
D.相对原子质量相同
解析:Na 变成 Na+的过程中,发生改变的只是核外电子数,原子核不变,故质子数、核
电荷数没变化。原子的质量主要集中在原子核上,电子的质量很小,可以忽略不计。
答案:B
(6)物质与其构成粒子之间的关系
构成物质的粒子有分子、原子、离子,物质与其构成粒子之间的关系如下图所示 :
【例 3—2】下列关于分子、原子、离子的说法,其中正确的是( )
A.原子是最小的微粒,不可再分
B.钠原子的质子数大于钠离子的质子数
C.当二氧化碳气体变成干冰时,二氧化碳分子间不存在间隔
D.分子、原子、离子都可以直接构成物质
解析:
A × 原子在化学变化中不可再分,离开这一条件,原子可分成原子核和核外电子
B × 钠原子变为钠离子只是失去一个电子,原子核内质子数不变
5
C × 分子之间有间隔,由气态变为液态和固态只是分子间的间隔变小了
D √ 分子、原子、离子都是构成物质的粒子
答案:D
4.相对原子质量
(1)原子的实际质量
①不同原子所含的质子、中子、电子数目不同,所以每个原子的质量也不同。
粒子种类 质量
质子 1.672 6×10-27 kg
中子 1.674 9×10-27 kg
电子 质子质量的 1/1 836
②原子的质量很小,例如 1 个氧原子的质量为 2.657×10-26 kg。
(2)相对原子质量
①使用原因
由于原子的实际质 量太小,书写和使用都不方便,所以采用相对原子质量。
②概念
以一种碳原子(核内有 6 个质子和 6 个中子)的质量的 1/12 为标准,其他原子的质量跟
它相比较所得的比,作为这种原子的相对原子质量(符号为 Ar)。
③表达式
相对原子质量= 一个某原子的质量
一种碳原子质量的 1/12
其中,一种碳原子(含 6 个质子和 6 个中子的碳原子)质量的 1/12 约为 1.661×1 0-27 kg。
④举例
氧原子的相对原子质量=2.657×10-26 kg
1.661×10-27 kg
≈16
⑤相对原子质量与质子数、中子数的关系:
相对原子质量=质子数+中子数
辨误区 相对原子质量就是原子的实际质量吗
相对原子质量只是一个比值,不是原子的实际质量。相对 原子质量越大,原子的实际
质量也越大。
⑥查元素的相对原子质量
可从元素周期表中查或从相对原子质量表(附录Ⅱ)中查,也可从物理、化学手册中查。
【例 4—1】下列说法正确的是( )
A.相对原子质量和原子质量都没有单位
B.氢的相对原子质量为 1,所以氢的原子质量为 1 g
C.相对原子质量只是一个比值
D.一个碳原子的质量为 1.993×10-26 kg,一个铁原子的质量为 9.288×10-26 kg,碳原
子的相对原子质量大于铁原子的相对原子质量
解析:
A × 原子质量很小,有单位,相对原子质量是一个比值,单位为“1”C √
B × 氢的相对原子质量为 1,实际质量约为 1.67×10-27 kg,并非 1 g
D × 由相对原子质量定义知,原子质量越大,相对原子质量也越大
答案:C
【例 4—2】我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕
等几种元素的相对原子质量新值,其中他测定核电荷数为 63 的铕元素的相对原子质量的新
值为 152。则下列说法正确的是( )
A.铕元素的原子质子数为 63
B.铕元素的原子中子数为 63
C.铕元素的原子核外电子数为 152
D.铕元素的原子的质量为 152
6
解析:铕元素的原子质子数=核电荷数=核外电子数=63,中子数=相对原子质量-质
子数=152-63=89;铕元素原子的相对质量为 152,而不是实际质量。
答案:A
5.原子和离子的比较
(1)相同点
①都是构成物质的一种粒子。
②同种元素的原子和离子,核内质子数相同,核电荷数相同,相对原子质量也相同。
(2)区别
原子:电中性,质子数=电子数。
阳离子:带正电,质子数>电子数。
阴离子:带负电,质子数<电子数。
可见,判断原子、离子的依据是质子数与电子数的关系。
(3)联系
阳离子 原子 阴离子
【例 5】(综合题)现有以下 6 种微粒的结构示意图,如图所示:
A B C
D E F
(1)表示原子的是________(填序号,下同)。
(2)表示阳离子的是________。
(3)表示阴离子的是________。
解析:
原子中,质子数 =电子数=核电荷数,故 A、C、F 为原子,D、E 中质子数>电子数,
显正电,为阳离子;B 中质子数<电子数,显负电,为阴离子。
答案:(1)ACF (2)DE (3)B
6.求相对原子质量的方法
(1)已知原子的实际质量时,根据相对原子质量的表达式来求。
相对原子质量=
该元素一个原子的质量
标准碳原子的质量× 1
12
=该元素一个原子的质量
1.661×10-27 kg
例如,一个氯原子的质量是 5.885×10-26 kg,则:
氯原子的相对原子质量=5.885×10-26 kg
1.661×10-27 kg
≈35.4
(2)已知原子的质子数(核电荷数或核外电子数)和中子数时,根据相对原子质量=质子
数+中子数来求。
例如,某种钠元素原子核内有 11 个质子、12 个中子,则该钠原子的相对原子质量=11
+12=23。
【例 6—1】(基础题)作为相对原子质量标准的碳原子的质量为 m kg,某元素的一个原
子的质量为 n kg,则该元素原子的相对原子质量为( )
7
A. m
12n
B. n
12m
C.12n
m
D.12m
n
解析:根据相对原子质量的定义,知:
相对原子质量=
该元素一个原子的质量
标准碳原子的质量× 1
12
=
n kg
m kg× 1
12
=12n
m
答案:C
【例 6—2】(综合题)某原子的核电荷数为 18,中子数比电子数多 4,则该原子的相对
原子质量是( )
A.42 B.40
C.44 D.22
解析:在原子中,质子数=核电荷数=电子数。由题意知该原子的质子数为 18,中子
数为 18+4=22。相对原子质量=质子数+中子数=18+22=40。故 B 正确。
答案:B
7.正确认识粒子
(1)粒子不等同于离子。粒子的范围更大, 包括原子、分子、离子等,而离子只是粒子
的一部分。
(2 )原子生成离子时,由于最外层电子数发生了改变,所以化学性质也发生了改变。
(3)稳定结构与稀有气体。
①稳定结构是一种相对状态,具有稳定结构的原子构成的物质也可能和某些物质发生反
应。稀有气体化学性质不活泼,但在一定条件下也可以与其他物质反应。
②有稳定结构的粒子并非一定是稀有气体原子,可能是阳离子或阴离子。所以核外电子
层结构相同的粒子并不一定是同一种粒子,如粒子 和 的电子层结构相
同,由于质子数不同,仍然是两种粒子。
【例 7—1】某粒子的结构示意图为 ,则下列说法正确的是( )
A.它一定是氖原子 B.它一定是阴离子
C.它一定是阳 离子 D.以上三种都有可能
解析:根据原子和离子结构中核内质子数与核外电子数的关系可知:当 x=2+8 时,该
粒子是氖原子;当 x>2+8 时,该粒子是阳离子(如 Na+、Mg2+);当 x<2+8 时,该粒子是
阴离子(如 O2-、F-)。
答案:D
【例 7—2】已知 A、B、C 三种元素的粒子结构示意图依次如下:
A B C
(1)当 A、B 为原子结构示意图时:x=________,y=________。
(2)C 表示的是________(填“阳离子”“阴离子”或“原子”)的结构示意图,该元素
与 B 元素形成的化合物是由________(填“分子”“原子”或“离子”)构成的。
解析:原子中:质子数=电子数,阳离子中:质子数>电子数,阴离子中:质子数<电
子数。
答案:(1)10 1 (2)阴离子 离子
8
相关文档
- 九年级化学上册第一章大家都来学化2021-11-062页
- 人教版九年级化学上册《课题4 化学2021-11-0649页
- 2020九年级化学上册 第二单元 课题2021-11-066页
- 2020九年级化学上册第1、2单元综合2021-11-065页
- 2019九年级化学上册 5化学反应中的2021-11-062页
- 2020九年级化学上册第二单元我们周2021-11-064页
- 2019九年级化学上册 6CO2的性质2021-11-063页
- 九年级化学上册第三单元物质构成的2021-11-066页
- 九年级化学上册同步解析与测评上对2021-11-0611页
- 九年级化学上册第二单元我们周围的2021-11-062页