- 1.07 MB
- 2022-04-01 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第9单元溶液第一篇基础过关
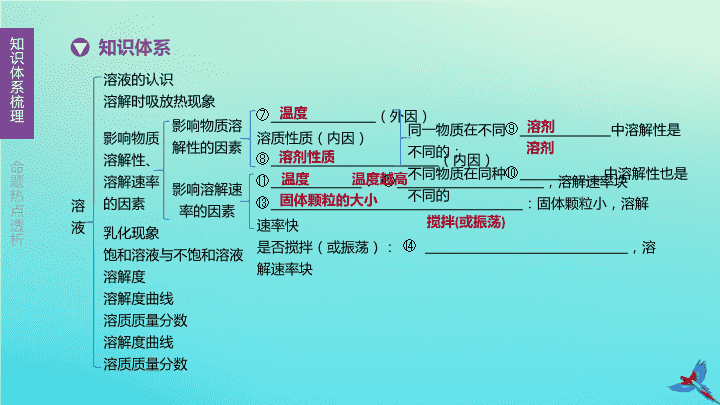
命题热点透析知识体系知识体系梳理溶液溶液的认识概念:一种或几种物质分散到另一种物质里,形成的①,②的混合物均一性:溶液中任意一部分的组成,性质完全相同稳定性:外界条件不变时,溶质不会与溶剂分离溶质:被溶解的物质,可以是气体,液体或固体溶剂:能溶解其他物质的物质(③是最常见的溶剂,酒精、煤油也是常见溶剂)吸热:物质溶解时会吸热,表现为溶液温度降低,如④等放热:物质溶解时会放热,表现为溶液温度升高,如⑤、浓硫酸等无明显现象:物质溶解时无明显吸放热,表现为温度几乎不变,如⑥等特征组成影响物质溶解性、溶解速率的因素乳化现象饱和溶液与不饱和溶液溶解度溶解时吸放热现象均一稳定水硝酸铵氢氧化钠氯化钠可用于鉴别物质
命题热点透析知识体系知识体系梳理溶液溶液的认识溶解时吸放热现象⑦(外因)溶质性质(内因)⑧(内因)⑪:⑫,溶解速率块⑬:固体颗粒小,溶解速率快是否搅拌(或振荡):⑭,溶解速率块乳化现象饱和溶液与不饱和溶液溶解度溶解度曲线溶质质量分数溶解度曲线溶质质量分数影响物质溶解性、溶解速率的因素影响物质溶解性的因素影响溶解速率的因素同一物质在不同⑨中溶解性是不同的;不同物质在同种⑩中溶解性也是不同的温度溶剂性质溶剂溶剂温度温度越高固体颗粒的大小搅拌(或振荡)
命题热点透析知识体系知识体系梳理溶液溶液的认识溶解时吸放热现象影响物质溶解性、溶解速率的因素乳化现象:植物油中加入洗涤剂后,植物油就会被分散成无数细小的滴液,而不能聚集成较大的油珠从而使油和水不再分层的现象,肥皂、洗涤剂等都具有乳化作用利用乳化原理:如用洗涤剂去除油污利用⑮原理:如用汽油去油污利用化学反应原理:如用氢氧化钠除去炉具油污饱和溶液与不饱和溶液溶解度溶解度曲线溶质质量分数乳化现象常见除油污原理及应用溶解
命题热点透析知识体系知识体系梳理溶液溶液的认识溶解时吸放热现象影响物质溶解性、溶解速率的因素乳化现象溶解度溶解度曲线溶质质量分数饱和溶液与不饱和溶液定义:在⑯下,向⑰里加入某种溶质,当溶质⑱________溶解时,所得到的溶液叫作这种溶质的饱和溶液;当溶质⑲溶解时,叫作这种溶质的不饱和溶液判断在一定温度下,一定量溶剂里,是否能继续溶解原溶质方法析出晶体后的溶液,是该温度下的⑳_________转化结晶一定温度一定量溶剂不能继续还能继续饱和溶液
命题热点透析知识体系知识体系梳理溶液溶液的认识溶解时吸放热现象影响物质溶解性、溶解速率的因素乳化现象溶解度溶解度曲线溶质质量分数饱和溶液与不饱和溶液定义判断方法溶解度随温度升高而增大:溶解度随温度升高而减小:结晶转化降低增加蒸发升高增加升高增加蒸发降低增加
命题热点透析知识体系知识体系梳理溶液溶液的认识溶解时吸放热现象影响物质溶解性、溶解速率的因素乳化现象溶解度溶解度曲线溶质质量分数饱和溶液与不饱和溶液定义判断方法转化蒸发溶剂(蒸发结晶):蒸发浓缩析出晶体,适用于溶解度受温度影响㉛___(填“大”或“小”)的物质,如从饱和NaCl溶液中得到晶体冷却热饱和溶液(降温结晶):温度降低析出晶体,适用于溶解度受温度影响㉜(填“大”或“小”)的物质,如从饱和KNO3溶液中得到晶体结晶小大
命题热点透析知识体系知识体系梳理溶液溶液的认识溶解时吸放热现象影响物质溶解性、溶解速率的因素乳化现象饱和溶液与不饱和溶液溶解度概念:在㉝下,某固态物质在㉞g溶剂里达到㉟状态时所溶解的㊱,叫作这种物质在这种溶剂里的溶解度四要素:㊲(条件)、㊳(标准)、㊴(状态)、㊵(量)影响因素固体溶解度溶解度曲线溶质质量分数气体溶解度一定温度100饱和质量一定温度100g溶剂饱和状态溶解的溶质质量
命题热点透析知识体系知识体系梳理溶液溶液的认识溶解时吸放热现象影响物质溶解性、溶解速率的因素乳化现象饱和溶液与不饱和溶液溶解度概念四要素内因:溶质和溶剂的性质多数物质溶解度随着温度的升高而明显增大,如㊶_______少数物质溶解度受温度的影响很小,如㊷________极少数物质溶解度随着温度的升高而明显增大,如㊸__________固体溶解度溶解度曲线溶质质量分数气体溶解度影响因素硝酸钾氯化钠外因:温度氢氧化钙
命题热点透析知识体系知识体系梳理溶液溶液的认识溶解时吸放热现象影响物质溶解性、溶解速率的因素乳化现象饱和溶液与不饱和溶液溶解度概念:在一定温度下,该气体的压强为101kPa时,在1体积水里溶解达到㊹____状态时的气体㊺_____内因:气体的性质外因:温度(随温度升高,溶解度㊻)和压强(随压强增大,溶解度㊼)固体溶解度溶解度曲线溶质质量分数气体溶解度影响因素饱和体积减小增大
命题热点透析知识体系知识体系梳理溶液溶液的认识溶解时吸放热现象影响物质溶解性、溶解速率的因素乳化现象饱和溶液与不饱和溶液溶解度概念:指溶解度随温度变化的曲线,即纵坐标表示溶解度,横坐标表示温度的曲线曲线上的点表示该温度下某物质的溶解度,且与点对应的溶液均为饱和溶液两条曲线相交的点表示该温度下,两物质的溶解度相等,且饱和溶液的溶质量分数相等线:表示物质的溶解度随温度的变化而变化的趋势曲线以上的点:表示该温度下溶液达到饱和,且有未溶固体曲线以下的点:表示该温度下溶液为不饱和溶液应用[详见专项(九)]溶质质量分数溶解度曲线面含义点
命题热点透析知识体系知识体系梳理溶液溶液的认识溶解时吸放热现象影响物质溶解性、溶解速率的因素乳化现象饱和溶液与不饱和溶液溶解度溶解度曲线定义:溶液中溶质的质量分数是㊽质量与㊾质量之比公式:溶液依据:溶液稀释前后,㊿质量不变稀释公式:浓溶液质量×浓溶液溶质质量分数=稀溶液质量"×稀溶液溶质质量分数一定溶质质量分数溶液的配制(详见重点梳理)溶质质量分数溶质溶液溶质
命题热点透析重点梳理一定溶质质量分数溶液的配制知识体系梳理实验仪器托盘天平(带砝码)、药匙(溶质为固体时)、①、胶头滴管、②、玻璃棒玻璃棒用于搅拌,③固体或液体的溶解速率量筒烧杯加快
命题热点透析知识体系梳理(续表)实验步骤(1)④:计算所需溶质的质量和水的体积。溶质质量=⑤质量×溶质质量分数;溶剂质量=⑥;溶剂体积=(2)⑦:用托盘天平称取一定质量的固体(3)⑧:用量筒量取一定体积的水计算溶液溶液质量-溶质质量称量量取
命题热点透析知识体系梳理(续表)实验步骤(4)⑨:将固体倒入烧杯中,将量取的水倒入烧杯中,用玻璃棒不断搅拌至固体完全溶解(5)装瓶、贴标签:将配制好的溶液装入试剂瓶中并贴上标签注意事项用托盘天平称量时要遵循“⑩”,且左右两盘上要垫上相同的称量纸,有腐蚀性或易潮解的药品应放在玻璃器皿中称量用量筒量取液体,读数时视线应与量筒内液体⑪相平选取量筒的量程要比所要量取液体体积稍大,且越接近越好(方便一次量取,且误差小)溶解左物右码凹液面的最低处
命题热点透析知识体系梳理(续表)误差分析浓度偏大浓度偏小无影响溶质偏大砝码生锈或沾有污渍天平空载时指针⑫_____(填“左”或“右”)偏溶质偏小药品中含有杂质药品和砝码位置颠倒,且使用了游码天平空载时指针⑬(填“左”或“右”)偏药品没有完全转移转移过程中有少量溶液洒出右左
命题热点透析知识体系梳理(续表)误差分析浓度偏大浓度偏小无影响溶剂偏小量取水的体积时⑭_____(填“仰”或“俯”)视读数量取的水没有完全转移溶剂偏大量取水的体积时⑮(填“仰”或“俯”)视读数烧杯内原来有少量的水转移过程中有少量溶液洒出俯仰
命题热点透析易错判断1.均一、稳定、透明的液体一定是溶液()2.75%的酒精溶液,溶质是水,溶剂是酒精()3.汽油除去油污利用了乳化原理()4.溶液的体积等于溶质体积与溶剂体积之和()5.饱和溶液中不能再溶解其他物质()6.同种溶质的饱和溶液不一定比不饱和溶液浓()7.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液()8.t℃时,100g水中溶解了20g氯化钠,所以t℃时氯化钠的溶解度为20g()知识体系梳理×××××√××
命题热点透析9.析出晶体后,溶液中溶质质量分数一定减小()10.配制溶液时,搅拌可以增大固体溶质的溶解度()知识体系梳理××
知识体系梳理命题热点透析考向一 溶液的形成(6年4考)角度1溶液的特征1.[2016·江西]下列可以作为溶质的是()A.只有固体B.只有液体C.只有气体D.固体、液体或气体D
知识体系梳理命题热点透析2.拓展[2019·潍坊]下列物质不属于溶液的是()A.生理盐水B.白醋C.医用酒精D.冰水混合物[答案]D[解析]生理盐水是氯化钠溶于水形成的均一稳定的混合物,属于溶液;白醋是乙酸溶于水形成的均一稳定的混合物,属于溶液;医用酒精是酒精溶于水形成的均一稳定的混合物,属于溶液;冰水混合物是由水一种物质组成,属于纯净物,不属于溶液。
知识体系梳理命题热点透析3.拓展[2019·郴州]下列关于溶液的说法中正确的是()A.溶液具有均一性、稳定性B.长期放置后不会分层的液体一定是溶液C.气体的溶解度随压强增大而减小D.医用酒精是75%的乙醇溶液,乙醇作溶剂[答案]A[解析]长期放置后不会分层的液体不一定是溶液,例如蒸馏水长期放置后不会分层;气体的溶解度与温度和压强有关,温度一定时,气体的溶解度随压强增大而增大,压强一定时,气体的溶解度随温度的升高而降低;医用酒精是75%的乙醇溶液,乙醇作溶质,水作溶剂。
知识体系梳理命题热点透析角度2物质溶解时的吸放热现象4.拓展在如图9-1所示装置中,将胶头滴管中的液体滴入瓶中,观察到U形管中的红墨水开始左边下降,右边上升,一段时间后,左右两边液面又保持水平。则该固体图9-1和液体的成分可能是()A.浓硫酸和水B.二氧化锰和过氧化氢溶液C.氧化钙和水D.
知识体系梳理命题热点透析[答案]C氢氧化钠和水[解析]“U形管中的红墨水开始左边下降,右边上升,一段时间后,左右两边液面又保持水平”,说明开始时瓶内压强增大,一段时间后瓶内压强又减小并恢复到原来的压强。压强增大的原因有温度升高或气体增加,压强变小的原因有温度降低或气体减少。图中装置压强变化是由温度变化引起的,即固体与液体混合后放出热量,不产生气体。
知识体系梳理命题热点透析5.拓展[2019·黄石]在蒸馏水中加入NaOH颗粒,不断搅拌,用温度传感器记录溶解过程的温度变化如图9-2所示。a、c两点观察到溶液中有固体存在,b点固体完全消失。下列说法不正确的是()图9-2A.NaOH固体溶于水是放热过程B.a、c两点时,NaOH的溶解度相同C.b点时,该溶液一定为饱和溶液D.c点时的溶剂质量等于d点时的溶剂质量
知识体系梳理命题热点透析[答案]C[解析]由图像知氢氧化钠溶于水温度升高,是放热过程;从图知a、c两点对应温度相同,则此温度下氢氧化钠在水中的溶解度相同;由图只知b点所对应温度最高,b点固体完全消失,并不能说明此时溶液是饱和溶液;据题意,在蒸馏水中加入氢氧化钠颗粒,说明水质量不变,氢氧化钠溶于水,溶剂是水,则图中c、d两点溶剂质量相同。
知识体系梳理命题热点透析角度3乳化现象6.拓展下列有关洗涤问题的说法中,不正确的是()A.汽油可溶解衣服上的油渍B.洗洁精可乳化餐具上的油污C.醋酸能洗去暖水瓶内壁上的水垢D.酒精能洗去瓷砖上的水垢[答案]D[解析]水垢的主要成分是碳酸钙,碳酸钙不能与酒精反应,也不能溶解在酒精中,故不能用酒精洗涤瓷砖上的水垢。
知识体系梳理命题热点透析角度4影响物质溶解性的因素7.[2018·江西节选]根据图9-3,回答相关问题。图9-3仪器①的名称是;X、Y分别是水和汽油中的一种,加入X、Y后,观察到a中固体消失并得到棕色溶液,b中固体不消失,则物质X是。由实验可知,物质的溶解性与有关。试管汽油溶剂的种类(或溶剂的性质)
知识体系梳理命题热点透析[解析]仪器①的名称是试管;碘易溶于汽油,难溶于水,X、Y分别是水和汽油中的一种,加入X、Y后,观察到a中固体消失并得到棕色溶液,b中固体不消失,则物质X是汽油。由实验可知,相同的溶质在不同种溶剂中溶解性不同,说明物质的溶解性与溶剂的种类(或溶剂的性质)有关。
知识体系梳理命题热点透析考向二 溶解度及溶解度曲线(6年6考)角度1饱和溶液与不饱和溶液的判断及转化8.[2018·江西]t2℃时,向盛有10g水的烧杯中加入13g固体甲,搅拌后固体完全溶解,放置一段时间后,溶液中有固体析出,甲的溶解度曲线如图9-4所示。下列说法正确的是()A.图中P点表示甲的溶解度为98gB.搅拌的目的是增大甲的溶解度C.通过升温可以将甲的不饱和溶液变为饱和溶液D.甲溶于水的过程中一定放出热量图9-4
知识体系梳理命题热点透析[答案]D[解析]描述物质的溶解度时一定要指明温度,图中P点表示t1℃时,甲的溶解度是98g;搅拌可以加快物质的溶解速率,而不能改变物质的溶解度;从图中可以看出,甲的溶解度随温度降低而减小,故可以通过降温的方法将甲的不饱和溶液变为饱和溶液;甲的溶解度随温度降低而减小,从题干中“t2℃时,向盛有10g水的烧杯中加入13g固体甲,搅拌后固体完全溶解,放置一段时间后,溶液中有固体析出”可以看出,甲溶于水的过程中一定放出热量,完全溶解后,随着热量的散失温度恢复到t2℃,则甲的溶解度减小,会析出溶质。
知识体系梳理命题热点透析9.[2019·江西]甲、乙两种固体的溶解度曲线如图9-5一所示:图9-5(1)t1℃时,溶解度大小关系为:甲(填“>”“<”或“=”)乙。(2)t2℃时,配制180g甲物质的饱和溶液,需称量甲的质量g。>80
知识体系梳理命题热点透析(3)由图二推测硝酸钾是图一中的物质。(4)图二“某一步操作”前后的溶液状态变化过程可以在图一中表示为(填序号)。A.b点→a点B.c点→a点C.b点→c点D.c点→d点甲B
知识体系梳理命题热点透析[解析](1)根据溶解度曲线可知,t1℃时,甲的溶解度大于乙。(2)t2℃时,甲的溶解度为80g,即在该温度下,100g水中溶解80g甲物质达到饱和状态,所以配制180g甲物质的饱和溶液,需称量甲的质量为80g。(3)根据图二中信息可知,在t2℃时,100g水中能完全溶解60g硝酸钾,结合溶解度曲线,该温度下甲的溶解度为80g,乙的溶解度小于60g,所以硝酸钾是图一中的甲物质。(4)根据图二信息可知,在t2℃时,100g水中能完全溶解60g硝酸钾,对应图一中c点状态,经过“某一步操作”后才恰好达到饱和状态,且溶液质量不变,故不可能为加溶质或蒸发溶剂,根据硝酸钾溶解度曲线可知,硝酸钾的溶解度随温度降低而减小,所以要使100g水中溶解60g硝酸钾达到饱和状态,可从c点状态降低温度至a点状态。
知识体系梳理命题热点透析10.拓展[2019·广西北部湾]如图9-6是两种固体的溶解度曲线。图9-6(1)40℃时,氯化钠的溶解度(填“>”“<”或“=”)硝酸钾的溶解度。(2)硝酸钾的溶解度随温度的升高而。(3)若将饱和的硝酸钾溶液从40℃降温到10℃,(填“有”或“无”)晶体析出。<增大有
知识体系梳理命题热点透析(4)20℃时,某实验小组取不同质量的硝酸钾,分别加入到100g水中,充分溶解后,所得溶液的质量与加入硝酸钾的质量对应关系如下表:根据上表数据,实验二所得的溶液为(填“饱和”或“不饱和”)溶液;20℃时,硝酸钾的溶解度为g。实验一实验二实验三实验四硝酸钾的质量/g20.025.030.035.0所得溶液的质量/g120.0125.0130.0131.6不饱和31.6
知识体系梳理命题热点透析[解析](1)由溶解度曲线可知,40℃时,氯化钠的溶解度小于硝酸钾的溶解度。(2)根据溶解度曲线可知,硝酸钾的溶解度随温度的升高而增大。(3)将饱和的硝酸钾溶液从40℃降温到10℃,硝酸钾溶解度减小,会析出晶体。(4)由表中数据可知,20℃时100g水中最多溶解31.6g硝酸钾,所以在该温度下硝酸钾的溶解度是31.6g;在100g水中加入的硝酸钾少于31.6g,所得溶液为不饱和溶液,大于或等于31.6g,所得溶液为饱和溶液,实验二只加入了25g硝酸钾,所得溶液为不饱和溶液。
知识体系梳理命题热点透析11.[2013·江西]下表是氯化钾和硝酸钾在不同温度时的溶解度。图9-7温度/℃020406080溶解度/gKCl27.634.040.045.551.1KNO313.331.663.9110169
知识体系梳理命题热点透析(1)从表中数据可以看出影响物质溶解度的因素之一是。(2)根据数据表,在图9-7中绘制硝酸钾的溶解度曲线。(3)从溶解度曲线上查出:45℃时,氯化钾的溶解度为g。温度(或溶质的种类)41.0±1
知识体系梳理命题热点透析(4)据图分析,要除去硝酸钾中混有的少量氯化钾,可采用的结晶方法是。降温结晶(或冷却热饱和溶液)[解析]由于硝酸钾的溶解度受温度影响变化较大,可采用降温结晶的方法除去硝酸钾中的氯化钾。
知识体系梳理命题热点透析12.拓展[2019·长春]根据图9-8中的硝酸钾和氯化钠的溶解度曲线,回答下列问题。图9-8(1)10℃时,将15g硝酸钾加入到100g水中,充分溶解后,得到硝酸钾的(填“饱和”或“不饱和”)溶液。不饱和
知识体系梳理命题热点透析(2)30℃时,硝酸钾饱和溶液和氯化钠饱和溶液各100g分别蒸发掉10g水,恢复到30℃时,饱和溶液析出的晶体较多。(3)氯化钠溶液中含有少量硝酸钾,提纯氯化钠,采用的方法是(填“蒸发结晶”或“降温结晶”)。KNO3蒸发结晶[解析](1)10℃时,硝酸钾的溶解度大于15g,将15g硝酸钾加入到100g水中,充分溶解后,得到硝酸钾的不饱和溶液;(2)30℃时硝酸钾的溶解度大于氯化钠,硝酸钾饱和溶液和氯化钠饱和溶液各100g分别蒸发掉10g水,恢复到30℃时,硝酸钾析出的晶体较多;(3)由于氯化钠的溶解度受温度影响变化较小,硝酸钾的溶解度受温度影响变化较大,故用蒸发结晶的方法提纯氯化钠。
知识体系梳理命题热点透析13.[2014·江西]图9-9是X、Y、Z三种物质的溶解度曲线。将t2℃时三种物质的饱和溶液降温至t1℃,溶液中溶质质量分数大小关系正确的是()图9-9A.X>Y>ZB.Y>Z>XC.Z>Y>XD.X=Y>Z
知识体系梳理命题热点透析[答案]B[解析]将t2℃时三种物质的饱和溶液降温至t1℃,X、Y溶液仍是饱和溶液,比较饱和溶液中溶质质量分数只需比较溶解度的大小即可,溶解度越大,溶质质量分数也越大。Z溶液虽然变成不饱和溶液,但Z溶液降温后溶质质量分数没有发生改变,比较t1℃时X、Y的溶解度和t2℃时Z的溶解度大小,可知溶质质量分数大小关系是Y>Z>X。
知识体系梳理命题热点透析14.[2016·江西]图9-10是甲、乙、丙三种物质的溶解度曲线,下列说法正确的是()图9-10A.P点表示甲、丙两种物质的饱和溶液质量相等B.t1℃时,乙物质的饱和溶液升温至t2℃时仍是饱和溶液C.t1℃时,甲物质的饱和溶液中溶质和溶剂的质量比为1∶4D.将三种物质的溶液从t2℃降温至t1℃,溶质质量分数最小的一定是丙物质
知识体系梳理命题热点透析[答案]C[解析]P点表示t1℃时,甲、丙两种物质的溶解度相等;乙物质的溶解度随温度的升高而增大,所以将t1℃时乙物质的饱和溶液升温至t2℃时会变成不饱和溶液;三种物质的溶液状态不能确定,所以将三种物质的溶液从t2℃降温至t1℃,溶质质量分数的大小不能确定。
知识体系梳理命题热点透析15.[2017·江西]甲、乙两种物质的溶解度曲线如图9-11所示,下列说法正确的是()图9-11A.将甲、乙的饱和溶液从t2℃分别降温到t1℃,析出晶体的质量甲一定大于乙B.t1℃时甲、乙的饱和溶液中溶质质量分数相等C.t2℃时将40g甲溶于100g水中,形成饱和溶液D.将M点的甲溶液变成饱和溶液常采取的方法是
知识体系梳理命题热点透析[答案]B加入甲物质(合理即可)[解析]从t2℃降温到t1℃时,析出晶体的多少既与溶液的质量有关,也与溶解度有关;t1℃时甲、乙两种物质的溶解度相等,所以该温度时两种物质的饱和溶液中溶质质量分数相等;t2℃时甲的溶解度为50g,将50g甲溶于100g水中才能形成饱和溶液;将M点的甲溶液变成饱和溶液常采取的方法有增加溶质或蒸发溶剂等。
知识体系梳理命题热点透析16.[2015·江西]图9-12是两种物质的溶解度曲线,下列说法正确的是()图9-12A.甲的溶解度大于乙的溶解度B.t1℃时等质量甲、乙两种物质的饱和溶液中溶质质量相等C.t2℃时等质量的甲、乙两物质的饱和溶液降温至t1℃时,两溶液中溶质质量分数相等D.氧气的溶解度随温度变化的规律与图中(填“甲”或“乙”)相似
知识体系梳理命题热点透析[答案]B乙[解析]由图可知,当温度大于t1℃时,甲物质的溶解度大于乙物质的溶解度,当温度小于t1℃时,甲物质的溶解度小于乙物质的溶解度,若不指明温度,无法比较溶解度的大小;t2℃时甲饱和溶液的溶质质量分数大于乙饱和溶液的溶质质量分数,当降温至t1℃时,甲中有溶质析出,溶质质量分数减小,而乙溶液由饱和变为不饱和,溶质质量分数不变,但此时甲溶液的溶质质量分数仍大于乙溶液的溶质质量分数;气体的溶解度随温度的升高而减小,所以氧气的溶解度随温度变化与乙相似。
知识体系梳理命题热点透析17.拓展[2019·贵阳节选]溶液在日常生活、工业生产和科学研究中具有广泛用途。图9-13(1)某KNO3固体(混有少量NaCl),要用它配制营养液,需在配制前进行提纯(图9-13甲为溶解度曲线)。60℃时,KNO3的溶解度为g,将该固体溶于水配制为接近饱和的溶液,可采用降温结晶的方法提纯KNO3,其理由是。110硝酸钾溶解度受温度的影响大,随温度降低其溶解度急剧减小,而氯化钠的溶解度受温度影响较小,所以降温时硝酸钾晶体能析出
知识体系梳理命题热点透析(2)探究温度对溶解度的影响,如图乙所示。固体X是NH4NO3或NaOH,固体Y是KNO3或Ca(OH)2,烧杯中盛放20℃Y的饱和溶液(有少量Y的固体剩余)。往试管中滴加适量水,烧杯中固体逐渐消失,写出X与Y可能的组合__________。NH4NO3、Ca(OH)2;NaOH、KNO3
知识体系梳理命题热点透析[解析](1)由硝酸钾的溶解度曲线可知,60℃时,硝酸钾的溶解度是110g;硝酸钾固体中含有少量氯化钠,提纯硝酸钾的方法是降温结晶,因为硝酸钾的溶解度受温度影响大,降温时硝酸钾的溶解度急剧减小,使硝酸钾结晶析出,而氯化钠的溶解度受温度影响较小,降温时析出晶体很少,过滤即可提纯硝酸钾;(3)硝酸铵固体溶于水时吸热,溶液温度降低,此时烧杯Y固体逐渐消失,说明Y的溶解度随温度降低而增大,氢氧化钙的溶解度随温度降低而增大,所以当X是硝酸铵时,Y是氢氧化钙;氢氧化钠溶于水时放热,溶液温度升高,此时烧杯中的Y逐渐消失,说明Y的溶解度随温度升高而增大,硝酸钾的溶解度随温度升高而增大,所以当X是氢氧化钠时,Y为硝酸钾。
知识体系梳理命题热点透析18.拓展[2019·贵港]已知甲物质的溶解度与温度的关系如下表所示:按下图步骤进行操作:图9-14温度/℃10203040溶解度/g10.018.036.056.0
知识体系梳理命题热点透析(1)甲属于(填“易”或“可”)溶性物质,它的溶解度随温度的升高而。(2)在A~E的溶液中,属于不饱和溶液的是(填序号,下同),与B溶液的溶质质量分数相同的是。(3)要使E中未溶的甲物质全部溶解,至少需要加入30℃的水g。易增大CDA50
知识体系梳理命题热点透析[解析](1)从表中的数据可知,20℃时,该物质的溶解度为18g>10g,故为易溶性物质,该物质的溶解度随温度的升高而增大;(2)20℃时,该物质的溶解度为18g,100g的水中加入18g该物质,溶液恰好饱和,再继续加入18g溶质,溶质不再溶解,故A、B溶液为饱和溶液,且溶质质量分数相等;升温到40℃时,该物质的溶解度为56g,则C溶液不饱和,再加入18g溶质,此时溶质共有54g<56g,故D为不饱和溶液,降温到30℃,该物质的溶解度为36g,E溶液饱和,剩余18g溶质,要将其完全溶解,还需要加入50g水。
知识体系梳理命题热点透析考向三 一定溶质质量分数溶液的配制(6年3考)19.[2017·江西]图9-15是进行“一定溶质质量分数的氯化钠溶液的配制”实验活动常出现以下错误操作,其中不影响所配溶液浓度的是()图9-15
知识体系梳理命题热点透析[答案]D[解析]用托盘天平称量氯化钠时,将氯化钠放在右盘,并用到游码,会使称得氯化钠质量偏小,溶液浓度偏小;氯化钠撒出,会使溶液中的溶质减少,溶液浓度偏小;用量筒量取蒸馏水时,俯视读数,量取水偏少,溶液浓度偏大;在转移配好的氯化钠溶液时,溅出部分溶液,由于溶液具有均一性,故对所配溶液的浓度无影响。
知识体系梳理命题热点透析20.[2015·江西]配制50g质量分数为10%的氢氧化钠溶液,下列失误会导致所配溶液溶质质量分数偏大的是()A.装瓶时,有溶液洒出B.将量筒中的水倒入烧杯时有水溅出C.溶解时未用玻璃棒搅拌D.[答案]B量取水时俯视读数(或称量错误导致所称氢氧化钠的质量偏大等)[解析]将量筒中的水倒入烧杯时有水溅出,会导致溶剂的质量减小,使所配溶液的溶质质量分数偏大。
知识体系梳理命题热点透析21.拓展[2019·郴州]配制一定溶质质量分数的氯化钠溶液的过程如图9-16所示。图9-16(1)写出图中标号a仪器的名称:。(2)配制50g质量分数为15%的氯化钠溶液,所需氯化钠和水的质量分别为:氯化钠g,水g。(3)称量氯化钠时,氯化钠应放在托盘天平的(填“左”或“右”)盘。量筒7.542.5左
知识体系梳理命题热点透析(4)溶解过程中玻璃棒的作用是。(5)对配制的溶液进行检测发现溶质质量分数偏小,其原因可能有(填序号)。A.称量时,药品与砝码放反了B.量取水的体积时,仰视读数C.装瓶时,有少量溶液洒出(6)把50g质量分数为15%的氯化钠溶液稀释成5%的氯化钠溶液,需要水的质量是g。搅拌,加速溶解AB100
知识体系梳理命题热点透析
知识体系梳理命题热点透析考向四 溶质质量分数与化学方程式相结合的(6年3考)角度1有关溶质质量分数变化的图像题22.拓展一定温度下,往一定质量的水中加入接近饱和的氯化钠溶液,图9-17所示的图像不能正确反映相关量之间关系的是()图9-17
知识体系梳理命题热点透析[答案]D[解析]往水中加入氯化钠溶液,溶液的质量随氯化钠溶液的加入不断增加,D不正确。
知识体系梳理命题热点透析角度2与化学方程式相结合的计算23.[2013·江西]某厂排放的废水中含有碳酸钠,易造成环境污染。化学兴趣小组为该厂设计废水处理和利用的方案。进行了如下实验:取过滤后的水样200g,逐滴加入稀盐酸至恰好不再产生气体为止,反应过程中生成气体与所加稀盐酸的质量关系如图9-18所示。请回答下列问题(不考虑水样中杂质的影响)。图9-18(1)反应生成CO2气体的质量是g。4.4
知识体系梳理命题热点透析(2)反应后生成氯化钠的质量是多少?(写出计算过程)
知识体系梳理命题热点透析(3)农业上常用10%~20%的氯化钠溶液来选种。请通过列式计算判断:上述实验反应后所得溶液能否直接用于农业上选种。
知识体系梳理命题热点透析24.拓展[2019·攀枝花]电解法是工业上制铜的主要方法,控制一定条件,电解硫酸铜溶液,析出的铜附着在阴极板上,化学方程式为2CuSO4+2H2O2Cu↓+O2↑+2H2SO4。取一定质量的硫酸铜溶液,在实验室中,模拟工业条件进行电解,当硫酸铜恰好完全反应时,得到488.0g溶液和9.6g铜(注:不考虑气体在溶液中的溶解)。回答下列问题。(1)原硫酸铜溶液中溶质的质量分数是多少?(写出解题过程)
知识体系梳理命题热点透析
知识体系梳理命题热点透析(2)向电解后得到的488.0g溶液中加入一定量的某物质,充分反应后,所得溶液的质量、溶质质量分数均与原硫酸铜溶液相同,则这种物质可能是下列物质中的(填序号)。A.CuB.CuOC.Cu(OH)2D.CuCO3BD[解析](2)由上述分析可知,铜不与稀硫酸发生反应;氧化铜能与稀硫酸发生反应且增加的铜、氧元素质量比与电解硫酸铜溶液生成铜和氧气的质量比相同;氢氧化铜能与稀硫酸发生反应生成硫酸铜和水,但增加的铜、氧元素质量比与电解硫酸铜溶液生成铜、氧气的质量比不同;碳酸铜能与稀硫酸发生反应生成硫酸铜、水和二氧化碳气体,生成的二氧化碳气体逸出,纯增加的铜、氧元素质量比与电解硫酸铜溶液生成铜、氧气的质量比相同。