- 1.34 MB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第十单元 酸 和 碱
第
1
课时 常见的酸和碱
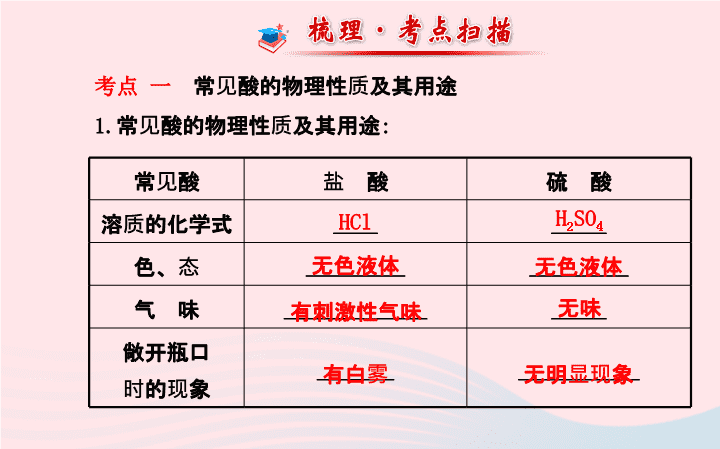
考点 一
常见酸的物理性质及其用途
1.
常见酸的物理性质及其用途
:
常见酸
盐 酸
硫 酸
溶质的化学式
____
_____
色、态
_________
_________
气 味
_____________
_____
敞开瓶口
时的现象
_______
___________
HCl
H
2
SO
4
无色液体
无色液体
有刺激性气味
无味
有白雾
无明显现象
常见酸
盐 酸
硫 酸
挥发性
_______
_______
吸水性
___
___
用途
金属除锈、制造药物、胃液中的盐酸帮助消化等
用作化工原料、精炼石油、金属除锈、冶炼金属、做干燥剂等
易挥发
难挥发
无
有
2.
浓硫酸的稀释
(
如图所示
):
(1)
操作
:
一定要把
_______
加入到
_____,
以防止
___________
__________________________________________
。
(2)
玻璃棒的作用
:
搅拌
,
使
_____________
。
浓硫酸
水中
浓硫酸溶于
水时放出大量的热使水沸腾
,
造成硫酸液滴飞溅
热量及时散失
考点 二
酸的化学性质
1.
酸的化学性质
:
(1)
与酸碱指示剂反应
:
使紫色石蕊溶液
_______,
使无色酚酞
溶液
_______
。
(2)
与某些金属反应
,
例如
:
铁和盐酸
:(
写化学方程式
,
下同
)_____________________
铝和稀硫酸
:________________________________
(3)
与某些金属氧化物反应
,
例如
:
氧化铜和盐酸
:_____________________
氧化铁和硫酸
:____________________________
变红色
不变色
Fe+2HCl====FeCl
2
+H
2
↑
2Al+3H
2
SO
4
(
稀
)====Al
2
(SO
4
)
3
+3H
2
↑
CuO+2HCl====CuCl
2
+H
2
O
Fe
2
O
3
+3H
2
SO
4
====Fe
2
(SO
4
)
3
+3H
2
O
(4)
与碱反应
,
例如
:
盐酸和氢氧化铜
:__________________________
硫酸和氢氧化钡
:____________________________
(5)
与某些盐反应
,
例如
:
氯化钡和硫酸
:__________________________
硝酸银和盐酸
:________________________
2HCl+Cu(OH)
2
====CuCl
2
+2H
2
O
H
2
SO
4
+Ba(OH)
2
====BaSO
4
↓+2H
2
O
BaCl
2
+H
2
SO
4
====BaSO
4
↓+2HCl
AgNO
3
+HCl====AgCl↓+HNO
3
2.
酸性质相似的原因
:
不同的酸溶液具有相似的化学性质
,
其
原因是不同的酸溶液中都有共同的阳离子
_______
。
氢离子
考点 三
常见的碱
1.
常见碱的物理性质和主要用途
:
氢氧化钠
氢氧化钙
俗名
___________________
_______________
物理性质
色、态
_________
_______________
溶解性
_____
溶于水
,
并放出
大量的热
___
溶于水
,
溶解度随
温度升高而
_____
吸水性
易吸收水分而
_____
腐蚀性
___________
_____________
烧碱、火碱、苛性钠
熟石灰、消石灰
白色固体
极易
微
降低
潮解
有强腐蚀性
有较强腐蚀性
白色粉末状固体
氢氧化钠
氢氧化钙
用途
(1)
作气体干燥剂
(2)
作化工原料
(3)
去除油污
(1)
作建筑材料
(2)
保护树木
,
防止冻伤
和害虫生卵
(3)
农业上用于
配制波尔多液
(4)
改良酸性土壤
2.Ca(OH)
2
的制取
:
(1)
第一步
:
煅烧石灰石
(
写化学方程式
,
下同
):
_____________________
。
(2)
第二步
:
生石灰和水反应
:__________________
。
高温
====
CaCO
3
CaO+CO
2
↑
CaO+H
2
O====Ca(OH)
2
【
思考感悟
】
现有三种气体
H
2
、
CO
2
、
O
2
需要干燥
,
是否都可选用
NaOH
固体作干燥剂
,
为什么
?
提示
:
选用干燥剂时
,
所选用的物质不仅具有吸水性
,
还不能与被干燥的气体发生化学反应
,NaOH
和
CO
2
能发生化学反应
,
因此不能用
NaOH
固体来干燥
CO
2
。
考点 四
碱的化学性质
1.
能和酸碱指示剂反应
:
使紫色石蕊溶液变
_____,
使无色酚酞
溶液变
_____
。
2.
能和某些非金属氧化物反应
:
例如
:
澄清石灰水中通入二氧化碳
:(
填化学方程式
,
下同
)
_________________________
。
氢氧化钠固体暴露在空气中
:
______________________
。
蓝色
红色
CO
2
+Ca(OH)
2
====CaCO
3
↓+H
2
O
CO
2
+2NaOH====Na
2
CO
3
+H
2
O
3.
能和酸发生中和反应
:
例如
:
氢氧化钠与盐酸反应
:
____________________
。
4.
能和部分盐反应
(
只有可溶性碱和可溶性盐的溶液才能反
应
):
例如
:
NaOH
溶液与
CuSO
4
溶液
:
_______________________________
。
氢氧化钙溶液与碳酸钠溶液
_______________________________
。
NaOH+HCl====NaCl+H
2
O
CuSO
4
+2NaOH====Cu(OH)
2
↓+Na
2
SO
4
Na
2
CO
3
+Ca(OH)
2
====2NaOH+CaCO
3
↓
【
思考感悟
】
实验室常用澄清的石灰水检验
CO
2
气体
,
常用氢氧化钠溶液来吸收
CO
2
,
你知道其中的原因吗
?
提示
:
用澄清的石灰水检验
CO
2
,
是因其与
CO
2
反应有浑浊现象
,
而氢氧化钠溶液虽与
CO
2
反应但无明显现象
,
故一般不用氢氧化钠溶液来检验
CO
2
,
实验室常用氢氧化钠溶液
,
不用氢氧化钙溶液吸收
CO
2
的原因是氢氧化钙微溶于水
,
只能吸收少量二氧化碳而氢氧化钠易溶于水
,
利于吸收较多的二氧化碳。
【
易错微博
】
小博士答学生问
问题
1
“在水溶液中能解离出氢离子的化合物都是酸
,”
这种认识是否正确
,
为什么
?
答
:
不正确。在水溶液中能解离出氢离子的化合物不一定是酸
,
也可能是盐
,
如硫酸氢钠。
问题
2
“将二氧化碳气体通入紫色石蕊溶液变红。说明二氧化碳是一种酸。”
,
这种说法是否正确
,
为什么
?
答
:
不正确。二氧化碳本身不具有酸性
,
二氧化碳能使紫色石蕊溶液变红的原因是二氧化碳与水反应生成碳酸
,
碳酸能使紫色石蕊溶液变红。
问题
3
碱与非金属氧化物作用生成盐和水的反应属于复分解反应吗
?
答
:
不属于。碱与非金属氧化物的反应虽然是两种化合物反应生成另外两种化合物
,
但由于两种反应物不是通过离子间的相互交换而生成另外两种化合物
,
所以不属于复分解反应。
要点 一
正确认识和理解酸的化学性质的通性
1.
酸的定义
:
在水溶液中解离出的阳离子全部都是氢离子
(H
+
)
的化合物。
2.
酸溶液有通性的原因
:
酸在溶液中能够解离出共同的阳离子
——H
+
。
3.
酸的通性
:
通 性
一般规律
反应类型
(1)
与酸碱指示剂反应
使紫色石蕊溶液变红
,
使无色酚酞溶液不变色
(2)
与活泼金属反应
酸
+
金属→盐
+
氢气
置换反应
(3)
与金属氧化物反应
酸
+
金属氧化物→盐
+
水
复分解反应
(4)
与碱发生中和反应
酸
+
碱→盐
+
水
复分解反应
(5)
与某些盐反应
酸
+
盐→另一种盐
+
另一种酸
复分解反应
【
特别提醒
】
(1)
氧化性酸与活泼金属反应不产生氢气
,
如浓硫酸、浓硝酸。
(2)
与酸反应的金属在金属活动性顺序表中必须位于氢前面。
角度
1
从物质转化的角度考查酸的性质
【
典例
1】
(2012
·
新疆中考
)
下列各组变化中
,
只有加入酸才能一步实现的是
(
)
A.Zn→ZnSO
4
B.CuO→CuCl
2
C.CaCO
3
→CO
2
D.BaCl
2
→BaSO
4
【
我的答案
】
选
B
。本题通过物质间的转化考查酸的性质。由锌转化为硫酸锌
,
属于金属转化为盐
,
可以是锌与稀硫酸反应
,
也可以是在金属活动性顺序中排在锌后面的可溶性硫酸盐与锌反应
,
故
A
不唯一
;
氧化铜转化为氯化铜
,
属于金属氧化物转化为盐
,
可以用氧化铜与稀盐酸反应生成
,
且只能与酸反应生成
,
故
B
符合题意
;
碳酸钙到二氧化碳的转化可以用碳酸钙与盐酸反应
,
也可以将碳酸钙高温分解生成二氧化碳
,
故
C
不符合题意
;
氯化钡转化为硫酸钡
,
可以用氯化钡与硫酸反应
,
也可以用氯化钡与可溶性硫酸盐反应生成硫酸钡沉淀
,
故
D
不符合题意。
角度
2
结合反应现象考查酸的性质
【
典例
2】
(2013
·
湛江中考
)
化学使世界变得绚丽多彩
,
下图是物质之间发生化学反应的颜色变化。
(1)
请你在编号②、③处各填入一种物质。
②是
,③
是
。
(2)
根据上图可以总结出稀硫酸的五个化学性质。
请你写出编号①稀硫酸的化学性质
_____________________
。
(3)
若编号④的物质是盐
,
请你写出符合编号④的一个化学反应方程式
_________________________________________
,
反应类型是
。
【
我的收获
】
本题考查酸的化学性质。①硫酸使紫色石蕊试液变红
;②
硫酸与铁反应生成硫酸亚铁
(
浅绿色
);③
硫酸与氧化铜反应生成硫酸铜蓝色溶液
;④
硫酸与氢氧化钡或氯化钡反应生成硫酸钡白色沉淀。
答案
:
(1)
铁 氧化铜
(2)
酸使紫色石蕊试液变红
(3)H
2
SO
4
+BaCl
2
====BaSO
4
↓+2HCl
复分解反应
要点 二
正确认识碱及碱的通性
1.
碱的概念
:
在水溶液中解离出的阴离子全部是
OH
-
的化合物。
2.
碱的通性
:
通 性
一般规律
反应类型
(1)
与酸碱指示剂反应
使紫色石蕊溶液变蓝色
,
使无色酚酞溶液变红色
(2)
与非金属氧化物反应
碱
+
非金属氧化物→
盐
+
水
(3)
与酸发生中和反应
酸
+
碱→盐
+
水
复分解反应
(4)
与某些盐反应
碱
+
盐→另一种盐
+
另一种碱
复分解反应
【
特别提醒
】
盛放碱溶液的试剂瓶一般用橡皮塞
,
而不用玻璃塞
,
目的是防止玻璃中的二氧化硅与碱溶液反应生成可溶性物质
,
使瓶塞与瓶口黏在一起。
【
典例
】
(2012·
铜仁中考
)
某化学活动小组以“酸碱盐的性质”为主题进行探究性学习
,
请你作为该小组成员一起来解决下列问题
:
(1)
小红同学从某一欠收农田里取回一份土壤样品
,
如果检测结果呈酸性
,
从经济和可行性方面考虑
,
那么要改良此土壤的酸性
,
应向农田里施加
(
填化学式
)
。
(2)
小红同学用下图总结了
NaOH
的四条化学性质
(
即
NaOH
与四类物质能够发生化学反应
)
。
Ⅰ
.
为了验证反应①
,
小红将无色酚酞溶液滴入
NaOH
溶液中
,
溶
液由无色变成
。
Ⅱ.
依据反应④说明
NaOH
必须密封保存
,
否则在空气中要变质
,
其化学反应方程式为
________________________________
__________________________________________________
。
Ⅲ.
为了验证反应③能够发生
,
你选择的物质是
。
a.Na
2
CO
3
b.HCl
c.FeCl
3
d.Ba(NO
3
)
2
(3)
请你设计一个实验除去
FeCl
2
溶液中少量的
CuCl
2
,
写出主要操作步骤和化学方程式
:
实验主要操作步骤
:____________
、
,
化学方程式
:
。
【
我的收获
】
本题考查酸、碱、盐的性质及利用性质除去物质中混有的杂质
,
是常见习题
,
解答本题时注意在除杂时不要引入新的杂质。
(1)
在农业上
,
用熟石灰
[Ca(OH)
2
]
改良土壤的酸性
;
(2)
氢氧化钠溶液呈碱性
,
能使无色酚酞变红
;
暴露在空气中的氢氧化钠易与空气中的
CO
2
反应生成
Na
2
CO
3
而变质
;
氢氧化钠还能与某些盐
(
如
FeCl
3
等
)
反应生成相应的难溶性碱
;
(3)Fe
比
Cu
活泼
,
加入过量的铁
,Fe
与
CuCl
2
反应
,
生成
Cu
和
FeCl
2
,
过滤即可除去
CuCl
2
。
答案
:
(1)Ca(OH)
2
(
或
CaO)
(2)Ⅰ.
红色
Ⅱ.CO
2
+2NaOH====Na
2
CO
3
+H
2
O
Ⅲ.c
(3)
取溶液于试管中加入过量铁粉 过滤
CuCl
2
+Fe====FeCl
2
+Cu
相关文档
- 九年级化学常见的酸和碱课件新课标2021-11-1048页
- 九年级化学(人教版下册)第10单元课题2021-11-1012页
- 人教版九年级化学下册101常见的酸2021-11-1061页
- 人教版化学九下《常见的酸和碱(四)》2021-11-102页
- 人教版九年级全册优秀教案第10单元2021-11-107页
- 人教版九年级下册导学案课题2酸和2021-11-104页
- 【精品课件】人教版九年级化学下册2021-11-1027页
- 第7单元常见的酸和碱单元测试卷2021-11-1011页
- 人教版化学九下《常见的酸和碱》同2021-11-102页
- 人教版九年级化学下册课件101常见2021-11-1061页