- 1.74 MB
- 2021-11-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
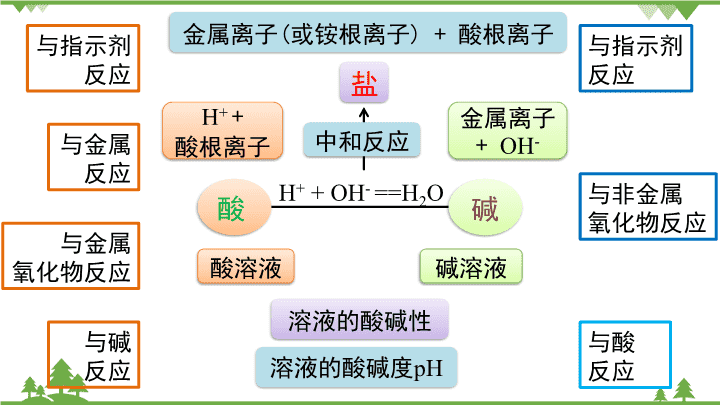
与酸
反应
与碱
反应
与金属
氧化物反应
与金属
反应
与指示剂
反应
与指示剂
反应
与非金属
氧化物反应
H+ +
酸根离子
金属离子
+ OH-
H+ + OH- ==H2O
溶液的酸碱性
酸溶液 碱溶液
溶液的酸碱度pH
酸 碱
中和反应
盐
金属离子(或铵根离子) + 酸根离子
口诀:紫石蕊,遇酸红,遇碱蓝;无酚酞,遇酸无,遇碱红
注意
考点一 酸碱指示剂
酸碱指示剂 酸性溶液 碱性溶液
紫色石蕊溶液 变为____色 变为____色
无色酚酞溶液 ______色 变为____色无
蓝
红
红
指示剂遇到酸性溶液或碱性溶液时,变色的是指示剂,
而不是酸性溶液或碱性溶液。
碱
溶
液
碱
性
溶
液
酸
溶
液
酸
性
溶
液
考点二 常见酸的性质
(1)浓盐酸具有_______,在空气中能形成______,有腐蚀性。
(2)浓硫酸易溶于水,具有______性、_____性(脱水性)。
1.浓盐酸、浓硫酸的性质
白雾
吸水 腐蚀
挥发性
注
意
①稀释浓硫酸:酸入水、沿器壁、缓缓倒、不断搅。
②由于浓硫酸具有吸水性,故在实验室常用作干燥剂。
④如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量的
水冲洗,然后再涂上3%~5%的碳酸氢钠溶液。
③敞口放置,浓盐酸因挥发性而使其质量减少;浓硫酸因
吸水性而使其质量增加,所以它们都要密封保存。
【练习1】(湖南郴州中考)分别将一小瓶浓盐酸、
浓硫酸露置在空气中一段时间后,发生的共同变化
是( )
A.溶液的质量减小 B.溶液的浓度减小
C.溶质的质量减小 D.溶剂的质量增大
B
2.稀盐酸、稀硫酸的化学性质
由于盐酸、稀硫酸在水溶液中都能解离出______,所以具有
相似的化学性质。
H+
(1)酸能与指示剂反应
酸能使紫色石蕊溶液变__色,使无色酚酞溶液____。 红 不变色
(2)酸能与多种活泼金属反应,生成盐和氢气(氢前可换氢)
与稀盐酸反应 与稀硫酸反应
镁
锌
铁
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Mg+H2SO4=MgSO4+H2↑
Zn+H2SO4=ZnSO4+H2↑
Fe+2HCl=FeCl2+H2↑ Fe+H2SO4=FeSO4+H2↑
(3)酸能与某些金属氧化物反应,生成盐和水
现象 化学方程式
铁锈+
盐酸
铁锈+
稀硫酸
氧化铜+
盐酸
氧化铜+
稀硫酸
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
CuO+2HCl=CuCl2+H2O
CuO+H2SO4=CuSO4+H2O
红棕色固体逐渐
消失,溶液由无
色逐渐变成黄色。
黑色固体逐渐消
失,溶液由无色
逐渐变成蓝色。
(4)酸和碱发生中和反应,生成盐和水
NaOH + HCl = NaCl + H2O
Ca(OH)2+ 2HCl = CaCl2 + 2H2O
2NaOH+H2SO4 = Na2SO4 + 2H2O
小
结
稀盐酸、稀硫酸的化学性质
•1 跟指示剂的反应
•2 跟金属的反应
•3 跟金属氧化物的反应
•4 跟碱的反应
酸能使石蕊溶液变
红色,使酚酞溶液
不变色。金属+酸==盐+氢气↑
Zn+H2SO4=ZnSO4+H2↑Fe2O3+6HCl= 2FeCl3+3H2O
金属氧化物+酸==盐+水
NaOH+HCl= NaCl+H2O
碱+酸==盐+水
【练习2】(海南中考)向氧化铜和铁粉的混合物中
加入一定量稀硫酸,充分反应后过滤,向滤渣 中再
滴入稀硫酸,有气泡产生,则下列判断正确的是
( )
A.滤渣中可能含Cu B.滤渣中只含Fe
C.滤液中不含CuSO4 D.滤液中不一定含FeSO4
C
考点三 常见碱的性质
氢氧化钠:白色固体,______溶于水并放出大量的热;易吸收
水分而____,有强烈的腐蚀性。俗称火碱、烧碱、苛性钠。
氢氧化钙:白色粉末状固体,______溶于水,有腐蚀性。
极易
潮解
微
注意
①氢氧化钠固体不仅吸水潮解,而且还能与空气中的二氧化碳
反应,使氢氧化钠转变为碳酸钠而变质,所以氢氧化钠必须密
封保存。氢氧化钙也要密封保存。
1.氢氧化钠、氢氧化钙的物理性质
②氢氧化钙可用生石灰与水反应制得,此反应能放出大量的热,
反应的化学方程式是CaO+H2O===__________。Ca(OH)2
③如果不慎将碱液沾到皮肤上,要用大量水冲洗,再涂上硼酸
溶液。
④氧化钙、氢氧化钙、碳酸钙的俗称及相互转化:
碳酸钙(CaCO3)是大理石
或石灰石等主要成分。
氧化钙(CaO)俗称:生石灰。
氢氧化钙[Ca(OH)2]俗称:熟石灰、消石灰。
2.氢氧化钠、氢氧化钙的化学性质
由于氢氧化钠、氢氧化钙在水溶液中都能解离出______,所以
具有相似的化学性质。
OH-
(1)碱溶液能与指示剂反应
碱溶液能使紫色石蕊溶液变___,使无色酚酞溶液变___。 蓝色 红色
(2)碱溶液能与某些非金属氧化物反应,生成盐和水。
化学方程式
石灰水+CO2
NaOH溶液+CO2
NaOH溶液+SO3
Ca(OH)2 + CO2 = CaCO3 + 2H2O
2NaOH + CO2 = Na2CO3 + H2O
2NaOH + SO3 = Na2SO4 + H2O
(3)碱和酸发生中和反应,生成盐和水。
小
结
氢氧化钠、氢氧化钙的化学性质
•1 跟指示剂的反应
•2 跟非金属氧化物的反应
•3 跟酸的反应
碱溶液能使石蕊溶
液变蓝色,使酚酞
溶液变红色。
碱溶液+非金属氧化物==盐+水
2NaOH+CO2 =Na2CO3 + H2O
碱+酸==盐+水
NaOH+HCl= NaCl+H2O
【练习3】(重庆中考)氢氧化钠溶液和氨水都能使
酚酞溶液变红,其原因是二者的溶液中均含有 一种
相同的粒子是( )
A.H+ B.OH- C.H2O D.H
【练习4】(湖北恩施州中考)下列关于氢氧化钠的
描述中错误的是( )
A.可用于改良酸性土壤
B.易溶于水,溶解时放出大量的热
C.能去除油污,可作炉具清洁剂
D.对皮肤有强烈的腐蚀作用
B
A
考点四 常见酸和碱的用途
用 途
盐酸 化工产品。可用于除锈、制造药物等;人体胃
液中含有盐酸,可帮助消化
硫酸 化工原料。用于生产化肥、农药、火药;除锈;
精炼石油等,浓硫酸有吸水性,常用做干燥剂
氢氧化钠 重要化工原料,用于制造肥皂,以及石油、造
纸、纺织、印染等工业
氢氧化钙 常用作建筑材料,农业上可用于配制农药波尔
多液。熟石灰用于改良酸性土壤
考点五 酸碱中和反应
酸和碱作用生成______和______的反应,叫作中和反应。反应
的实质是酸中解离出的H+与碱中解离出的OH-反应生成水分子
H++OH-===H2O
盐 水
注
意
①不少中和反应没有明显的实验现象(如NaOH溶液与稀
盐酸的反应),常需借助指示剂来判断反应的发生。如在
碱溶液中先加入无色酚酞溶液,使溶液显红色,然后边
滴加酸边振荡,当溶液由红色刚好变为无色时,酸碱恰
好完全反应。
②发生中和反应时,会放出热量。
③中和反应属于将要学到的基本反应类型中的复分解反应。
1.中和反应
(1)调节土壤的酸碱性
根据土壤情况,可以利用中和反应,在土壤中加入酸性或碱性
物质,调节土壤的酸碱性,以利于农作物生长。例如,用
_________改良酸性土壤。熟石灰
2.中和反应的应用
(2)处理工业废水
生产过程中的污水,需进行一系列的处理。如硫酸厂的污水中
含有硫酸等杂质,可以用熟石灰进行中和处理。
(3)用于医疗
服用某些含有碱性物质[如Mg(OH)2]的药物以治疗胃酸过多;
人们被蚊虫叮咬后肿起大包且痛痒,可以涂一些氨水、牙膏等
碱性物质中和蚊虫分泌的蚁酸。
【练习5】(山东临沂中考)向NaOH溶液中滴入HC1溶
液至恰好完全反应。
(1)右图表示该反应前后
溶液中存在的主要离子,
在右面横线上写出每种图
形表示的离子(填离子符
号)。
(2)反应的化学方程式是_________________________
(3)下列物质中只有一种能与KOH溶液发生上述类似反
应,应是_____(填序号)。
①HNO3 ②CuSO4 ③CaCl2
①
Na+
OH-
NaOH + HC1== NaC1+ H2O
【练习6】(湖南益阳中考)某校化学小组在利用硫酸和
氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液
pH的变化如图所示。下列说法正确的是( )
A.a点所示溶液呈酸性
B.向b点所示溶液中滴加石蕊
溶液,溶液呈紫色
C.该实验是将NaOH溶液逐滴
滴入稀硫酸中
D.c点所示溶液中,含有的溶质是Na2SO4和 NaOH
B
考点六 溶液酸碱度的测定及应用
1.溶液的酸碱度可用pH表示
(1)pH<7,溶液显____性,pH越____,酸性越强;
(2)pH=7,溶液显____性;
(3)pH>7,溶液显____性,pH越____,碱性越强。
酸 小
中
碱 大
2.pH与溶液酸碱性的关系
3.pH的测定方法:在_________________上放一小片pH试纸,
用干燥洁净的_________蘸取待测液,滴到pH试纸上,把试纸
显示的颜色与____________比较,读出pH(正整数)。
白瓷板(或玻璃片)
玻璃棒
标准比色卡
注
意
①用pH试纸测溶液的pH时,pH试纸不能用水润湿,否则会
起到稀释待测溶液的作用,使结果不准确。
②不能将pH试纸直接放入待测溶液中,会污染试剂。
4.溶液酸碱度的重要意义
(1)化工生产中许多反应必须控制在一定pH范围内。
(2)农作物适宜在pH为____或接近____的土壤中生长。
(3)测定雨水的pH(酸雨的pH小于_____),可以了解空气的污
染情况。
(4)测定人体内或排出的液体的pH,可以了解人体的健康状况。
7 7
5.6
【练习7】(四川广安中考)一些食物的近似pH如下:
下列说法正确的是( )
A. 鸡蛋清和牛奶显碱性
B. 要补充维生素可以多吃鸡蛋清
C. 苹果汁的酸性比葡萄汁弱
D. 胃酸过多的人应少饮葡萄汁和苹果汁
D
易错点归纳
1.误认为酸性溶液就是酸溶液,碱性溶液就是碱溶液。另外酸性
溶液和碱性溶液都能导电。
2.滴入酚酞溶液显无色,误认为就是中性溶液。
3.把酸碱指示剂在酸碱溶液中的变色,误认为是酸碱溶液的变色。
4.中和反应一定生成盐和水,但有盐和水生成的反应不一定是中
和反应。
5.测溶液的酸碱度时,pH试纸不能用水润湿、不能直接插入待测
液中,测得的pH只能为正整数,不能为小数。
化学方程式网络构建
1.常见酸(HCl、H2SO4)的反应
①______________________________
②______________________________
③______________________________
④______________________________
⑤______________________________
⑥______________________________
⑦______________________________
请写出
稀硫酸
与各物质
反应的
化学方程式
与盐酸的的反应
2.常见碱[NaOH、Ca(OH)2]的反应
①______________________________
______________________________
②______________________________
______________________________
③______________________________
______________________________
2NaOH + CO2 === Na2CO3 + H2O
Ca(OH)2 + CO2 === CaCO3 ↓+ H2O
HCl + NaOH === NaCl + H2O
2HCl + Ca(OH)2 === CaCl2+ 2H2O
2NaOH + H2SO4 === Na2SO4 + 2H2O
Ca(OH)2 + H2SO4 === CaSO4 + 2H2O
相关文档
- 2018人教版九年级语文下册《公输》2021-11-103页
- 部编版最新九年级下册道德与法治知2021-11-1036页
- 新人教版九年级化学上册全册精品教2021-11-1092页
- 初中化学九年级上册第四单元自然界2021-11-104页
- 江苏省九年级上册期中数学试卷2021-11-106页
- 人教部编版九年级下册语文课堂教学2021-11-1015页
- 2018济南九年级学考语文语言综合运2021-11-1012页
- 九年级化学上册同步解析与测评下一2021-11-1011页
- 中考化学试题及答案+综合计算题+中2021-11-1019页
- 江苏省苏州市2013年中考化学试题(wo2021-11-1020页