- 643.64 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
专项(九) 氢氧化钠、氢氧化钙与二氧化碳反应
角度1 氢氧化钠与二氧化碳是否反应
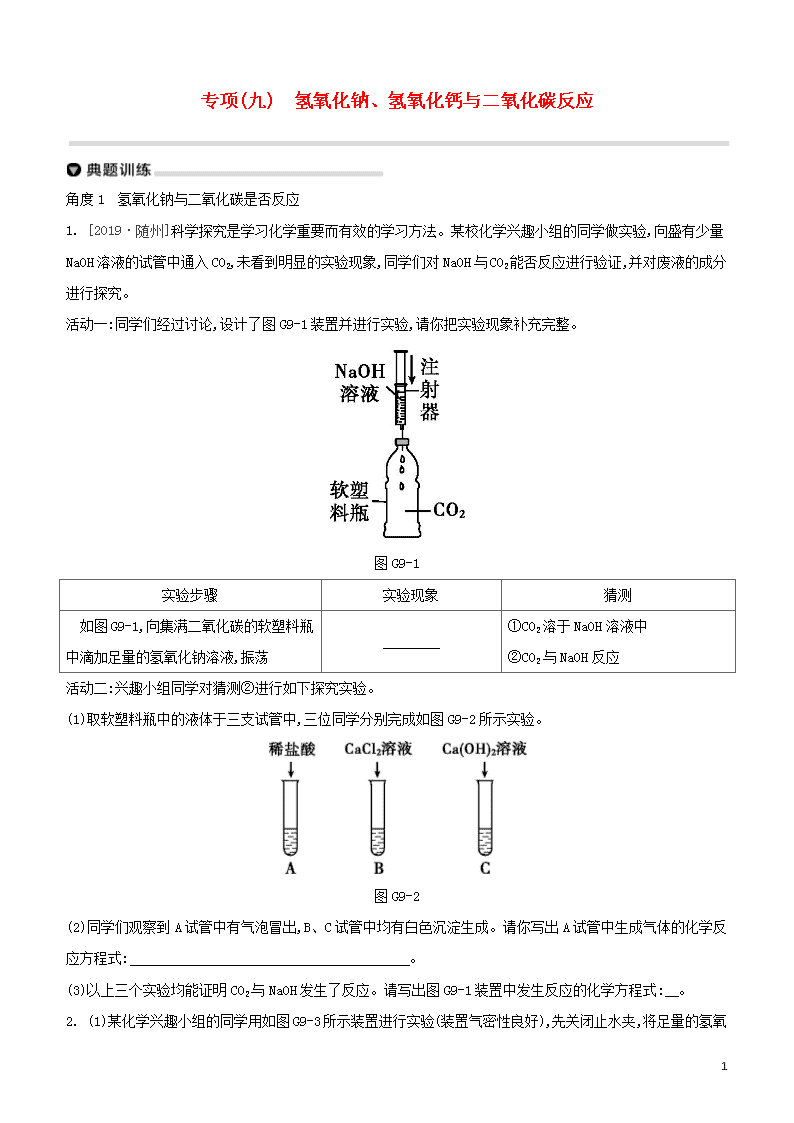
1. [2019·随州]科学探究是学习化学重要而有效的学习方法。某校化学兴趣小组的同学做实验,向盛有少量NaOH溶液的试管中通入CO2,未看到明显的实验现象,同学们对NaOH与CO2能否反应进行验证,并对废液的成分进行探究。
活动一:同学们经过讨论,设计了图G9-1装置并进行实验,请你把实验现象补充完整。
图G9-1
实验步骤
实验现象
猜测
如图G9-1,向集满二氧化碳的软塑料瓶中滴加足量的氢氧化钠溶液,振荡
①CO2溶于NaOH溶液中
②CO2与NaOH反应
活动二:兴趣小组同学对猜测②进行如下探究实验。
(1)取软塑料瓶中的液体于三支试管中,三位同学分别完成如图G9-2所示实验。
图G9-2
(2)同学们观察到A试管中有气泡冒出,B、C试管中均有白色沉淀生成。请你写出A试管中生成气体的化学反应方程式: 。
(3)以上三个实验均能证明CO2与NaOH发生了反应。请写出图G9-1装置中发生反应的化学方程式: 。
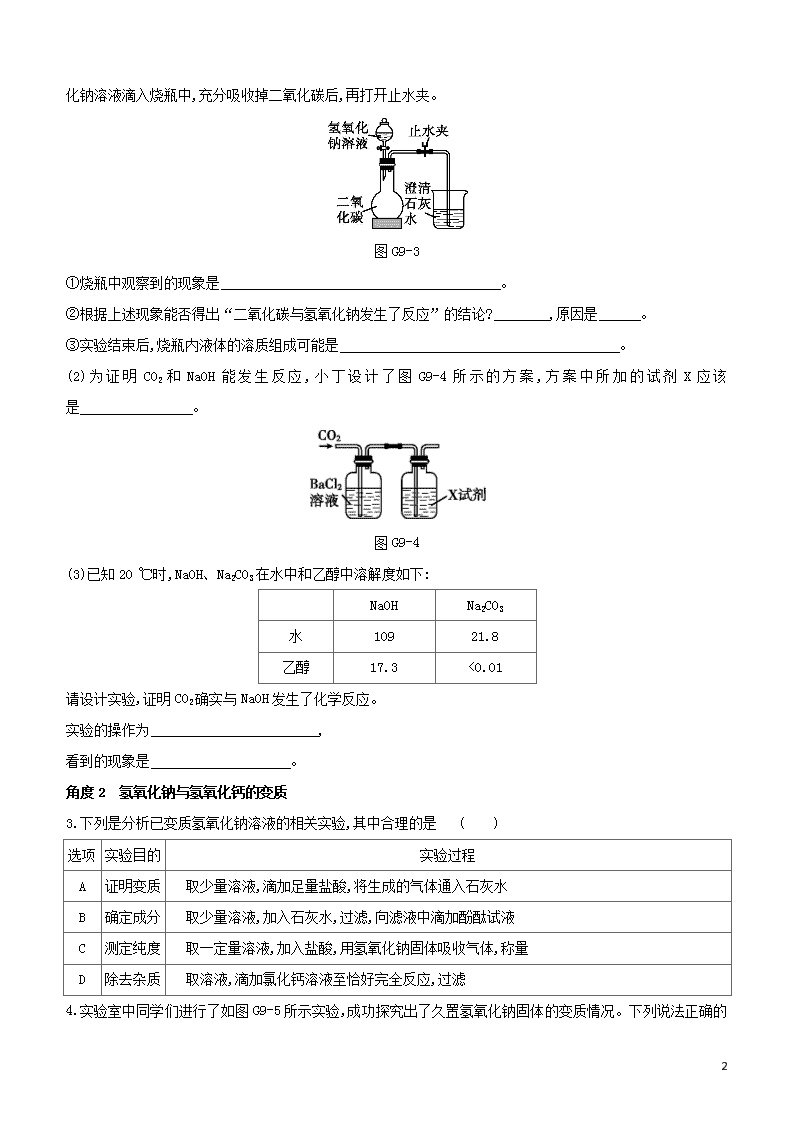
2. (1)某化学兴趣小组的同学用如图G9-3所示装置进行实验(装置气密性良好),先关闭止水夹,将足量的氢氧
8
化钠溶液滴入烧瓶中,充分吸收掉二氧化碳后,再打开止水夹。
图G9-3
①烧瓶中观察到的现象是 。
②根据上述现象能否得出“二氧化碳与氢氧化钠发生了反应”的结论? ,原因是 。
③实验结束后,烧瓶内液体的溶质组成可能是 。
(2)为证明CO2和NaOH能发生反应,小丁设计了图G9-4所示的方案,方案中所加的试剂X应该是 。
图G9-4
(3)已知20 ℃时,NaOH、Na2CO3在水中和乙醇中溶解度如下:
NaOH
Na2CO3
水
109
21.8
乙醇
17.3
<0.01
请设计实验,证明CO2确实与NaOH发生了化学反应。
实验的操作为 ,
看到的现象是 。
角度2 氢氧化钠与氢氧化钙的变质
3.下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是 ( )
选项
实验目的
实验过程
A
证明变质
取少量溶液,滴加足量盐酸,将生成的气体通入石灰水
B
确定成分
取少量溶液,加入石灰水,过滤,向滤液中滴加酚酞试液
C
测定纯度
取一定量溶液,加入盐酸,用氢氧化钠固体吸收气体,称量
D
除去杂质
取溶液,滴加氯化钙溶液至恰好完全反应,过滤
4.实验室中同学们进行了如图G9-5所示实验,成功探究出了久置氢氧化钠固体的变质情况。下列说法正确的
8
是 ( )
图G9-5
A.甲溶液可以选择稀盐酸或CaCl2溶液(查阅资料得知:CaCl2溶液显中性)
B.若Ⅱ、Ⅲ均有明显现象,则说明样品部分变质
C.D物质可能是气体,也可能是沉淀
D.溶液B中的溶质一定只含有NaOH和甲
5.某化学学习小组的同学对一瓶敞口放置的氢氧化钙固体的化学成分产生了兴趣,他们根据自己所学知识进行如下探究:
提出问题该瓶药品的化学成分是什么?
查阅资料(1)氢氧化钙能与空气中的二氧化碳反应而变质。
(2)氢氧化钙的溶解度曲线如图G9-6所示。
图G9-6
猜想假设猜想一:Ca(OH)2;猜想二: ;猜想三:CaCO3。
实验验证
实验操作
实验现象
实验结论
(1)取1 g样品放入盛有50 g水的烧杯中,充分搅拌后,静置
烧杯底部有较多固体未溶解
样品中含有CaCO3
(2)取实验(1)中上层清液少许于试管中,再向试管中滴加2~3滴无色酚酞试液
样品中含有Ca(OH)2
得出结论甲同学认为猜想二正确。
反思交流(1)乙同学认为甲同学的结论不合理,他认为猜想 也可能正确,原因是 。
(2)丙同学认为要想验证猜想二正确,还需做如下实验:取实验(1)中未溶解固体于试管中,向试管中滴加适量稀盐酸,如有 ,则猜想二正确。
拓展提升要想验证反应后物质的成分,除需验证有生成物以外,还应考虑反应物是否 。
6.[2019·南充]小军同学在实验室帮老师整理药品时发现NaOH溶液试剂瓶口有一些白色固体,于是产生好奇
8
心:这白色固体是什么?他为此进行了如下探究。
查阅资料①NaOH在空气中变质不会生成NaHCO3;②CO2不溶解于饱和NaHCO3溶液中,也不与NaHCO3反应;③Fe(OH)3呈红褐色,难溶于水;BaCl2溶液呈中性。
提出猜想猜想一:是NaOH;猜想二:是Na2CO3;
猜想三: 。
实验探究小军进行了下列实验探究。
实验操作
实验现象
实验结论
①取少量白色固体于试管中,加水溶解,再加入足量BaCl2溶液
猜想二正确
②过滤,在滤液中加入FeCl3溶液
无红褐色沉淀生成
问题分析实验操作①中加入足量BaCl2溶液的作用是 ,实验操作②还有其他实验方案吗?如有,请写出一种实验方案(必须指明试剂和现象) 。
为了提高实验结论的准确性,小军又设计了如图G9-7所示的实验对该白色固体的性质进行进一步探究:
图G9-7
实验现象A中有大量气泡产生,C中实验现象是 。
实验结论白色固体是Na2CO3。
分析与反思小军在与老师进行交流后得知,自己所设计的实验存在一定的缺陷,他对自己实验中存在的问题进行了反思:装置B中也能产生CO2。写出装置B中产生CO2的化学反应方程式: 。
7.[2019·淮安]化学兴趣小组的同学们在老师的带领下走进实验室,开展实验活动。
(1)实验室依次编号为1、2、3、4的药品柜中,分别存放常见的酸、碱、盐和酸碱指示剂。小刚欲使用熟石灰,他需从 号柜中取出。
(2)小涵发现盛放Na2CO3与NaCl两种溶液的试剂瓶标签脱落,为鉴别两种溶液,分别取样于试管中,加入无色酚酞试液,若为Na2CO3,则观察到溶液变为 色。
8
(3)小文从柜中取出标有“10%NaOH溶液”的试剂瓶,取少量样品加入试管中,向其中滴入稀盐酸,发现产生气泡,判断该NaOH溶液中有Na2CO3。用化学方程式表示NaOH溶液变质的原因: 。
小文同学对变质的NaOH溶液进行如下一系列实验,实现药品再利用。
Ⅰ.测定NaOH溶液中Na2CO3的质量分数
实验操作取40.0 g 10%的NaOH溶液样品进行如图G9-8所示的实验。
图G9-8
数据处理
①所取用盐酸(溶质质量分数7.3%)的质量理论上不少于 g。
②图中,反应前后天平示数相差1.1 g,计算NaOH溶液中Na2CO3的质量分数。(写出计算过程,结果精确到0.1%)
Ⅱ.变质的NaOH溶液再利用
小文将剩余NaOH溶液倒入烧杯中,加入经计算所需的熟石灰粉末,充分搅拌、静置、过滤,得到NaOH溶液和滤渣,充分搅拌的主要目的是 。
(4)实验结束后,同学们将实验产生的废液和废渣倒入指定的烧杯中,得到无色溶液和白色沉淀,溶液中除一定存在的溶质外,可能存在的溶质是 。
同学们再次实验,确认成分后,对废液回收利用,绿色排放。
8
【参考答案】
典题训练
角度1
1.活动一:软塑料瓶变瘪
活动二:(2)Na2CO3+2HCl2NaCl+CO2↑+H2O (3)CO2+2NaOHNa2CO3+H2O
[解析]活动一:二氧化碳溶于水或与氢氧化钠溶液发生反应,都会使软塑料瓶中的二氧化碳气体体积减少,压强减小,在大气压作用下软塑料瓶变瘪。活动二:(2)试管A中发生的反应是碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,反应的化学方程式为Na2CO3+2HCl2NaCl+CO2↑+H2O。(3)以上三个实验都能证明二氧化碳和氢氧化钠溶液反应生成了碳酸钠,因此,甲装置中发生反应的化学方程式为CO2+2NaOHNa2CO3+H2O。
2.(1)①澄清石灰水倒吸入烧瓶,烧瓶中溶液变浑浊
②不能 二氧化碳溶于水也会使烧瓶中压强变小,使石灰水倒吸入烧瓶,且二氧化碳也能使石灰水变浑浊
③氢氧化钠或氢氧化钠和碳酸钠或氢氧化钠和氢氧化钙
(2)BaCl2和NaOH溶液
(3)向氢氧化钠的乙醇溶液中通入二氧化碳
有白色沉淀生成
[解析](1)①将氢氧化钠溶液滴入二氧化碳中,氢氧化钠与二氧化碳反应,消耗了二氧化碳而使烧瓶中压强变小,澄清石灰水进入烧瓶,氢氧化钙溶液可与二氧化碳或碳酸钠反应生成碳酸钙沉淀,所以烧瓶中的溶液变浑浊。②仅凭①中的现象不足以说明氢氧化钠和二氧化碳发生了反应,因为氢氧化钠溶液中的溶剂为水,二氧化碳溶于水也会使烧瓶中压强变小,且二氧化碳也能使澄清石灰水变浑浊,而产生①中现象。③根据二氧化碳、氢氧化钠和氢氧化钙的化学性质,以及加入的氢氧化钠溶液是足量的,可以判断在该溶液中溶质一定有氢氧化钠,可能存在的溶质为碳酸钠、氢氧化钙中的一种,注意碳酸钠和氢氧化钙不可能同时存在,因为碳酸钠可以和氢氧化钙发生反应生成碳酸钙和氢氧化钠。(3)因为20 ℃时,氢氧化钠在乙醇中溶解度为17.3 g,碳酸钠在乙醇中的溶解度小于0.01 g,所以在乙醇中生成的碳酸钠不能溶于乙醇中,实验操作为向氢氧化钠的乙醇溶液中通入二氧化碳,看到的现象是有白色沉淀生成。
角度2
3.A [解析]B选项中滴加酚酞试液后,滤液一定会变红,无法确定溶质的成分;C选项中产生气体容易带出溶液中的水蒸气,所以会导致测定结果偏大;D选项中加氯化钙溶液会引入新杂质氯化钠。
4.B [解析]因为氢氧化钠、碳酸钠均能与稀盐酸反应生成氯化钠,溶液B为氯化钠和盐酸的混合溶液,滴加酚酞试液不变色,无法确定溶液中是否含有氢氧化钠;甲溶液可以选用氯化钙溶液,若Ⅱ、Ⅲ均有明显现象(现象分别是产生白色沉淀、酚酞试液变红色),说明样品中含有碳酸钠、氢氧化钠,则说明样品部分变质;由A选项的分析可知,D物质是沉淀;溶液B中的溶质一定还含有碳酸钠与甲反应生成的可溶性物质。
8
5.猜想假设Ca(OH)2、CaCO3
实验验证酚酞试液变红色
反思交流(1)一 氢氧化钙微溶于水,未溶解的固体可能是氢氧化钙 (2)气泡产生
拓展提升过量
[解析]猜想假设根据变质程度不难判断部分变质的样品中含有Ca(OH)2、CaCO3。实验验证氢氧化钙溶液显碱性,能使无色酚酞试液变红色。反思交流(1)根据题中信息,氢氧化钙是微溶于水的化合物,烧杯底部较多未溶解的固体也可能是没有溶解完的氢氧化钙。(2)要证明是否存在碳酸钙,可以利用碳酸盐与稀盐酸反应产生气体的性质进行实验。拓展提升要想验证反应后物质的成分,除需验证有生成物以外,还应考虑反应物是否过量。
6.提出猜想是NaOH和Na2CO3
实验探究有白色沉淀生成
问题分析检验并除去Na2CO3,防止对氢氧化钠的检验造成干扰 过滤,在滤液中滴加酚酞试液,溶液不变红(或取上层清液滴入CuCl2溶液,无蓝色沉淀生成,合理即可)
实验现象澄清石灰水变浑浊
分析与反思NaHCO3+HClNaCl+H2O+CO2↑
[解析]提出猜想氢氧化钠和二氧化碳反应生成碳酸钠和水。猜想一:如果氢氧化钠没有变质,则白色固体是NaOH;猜想二:如果氢氧化钠全部变质,则白色固体是Na2CO3;猜想三:如果氢氧化钠部分变质,则白色固体是NaOH和Na2CO3。实验探究根据实验结论猜想二正确,说明白色固体是碳酸钠,则实验操作①中,氯化钡和碳酸钠反应生成碳酸钡白色沉淀和氯化钠,所以实验现象为有白色沉淀产生。问题分析实验操作①中,氯化钡和碳酸钠反应生成碳酸钡白色沉淀和氯化钠,加入足量BaCl2溶液的作用是检验并除去碳酸钠,防止对氢氧化钠的检验造成影响。实验操作②证明氢氧化钠的存在,可根据氢氧化钠的碱性设计实验方案:过滤,往滤液中滴加酚酞试液(或氯化铜溶液或紫色石蕊试液),实验现象是溶液不变红(或无蓝色沉淀产生或溶液不变蓝,合理即可)。实验现象为了提高实验结论的准确性,小军又设计了如图所示的实验,从实验装置图分析可知,装置A中碳酸钠和盐酸反应,生成氯化钠、水和二氧化碳,现象是有大量气泡产生,二氧化碳进入装置B中,根据资料可知CO2不溶解于饱和NaHCO3溶液中,也不与NaHCO3反应,则二氧化碳进入装置C中,使澄清石灰水变浑浊。
分析与反思浓盐酸具有挥发性,挥发出的氯化氢气体进入装置B中,与碳酸氢钠溶液反应生成氯化钠、水和二氧化碳,所以装置B中也能产生CO2,化学反应方程式为NaHCO3+HClNaCl+H2O+CO2↑。
7.(1)2 (2)红
(3)2NaOH+CO2Na2CO3+H2O
Ⅰ.①50.0
②解:设NaOH溶液中Na2CO3的质量为x。
Na2CO3+2HCl2NaCl+H2O+CO2↑
8
106 44
x 1.1 g
10644=x1.1g
x=2.65 g
NaOH溶液中Na2CO3的质量分数为2.65g40g×100%≈6.6%。
答:NaOH溶液中Na2CO3的质量分数为6.6%。
Ⅱ.让溶液中的碳酸钠与熟石灰充分反应,完全除去
(4)CaCl2
[解析](1)氢氧化钙俗称熟石灰、消石灰,是由金属离子和氢氧根离子构成的,故属于碱。(2)Na2CO3的水溶性呈碱性,故能使无色酚酞变成红色。(3)空气中的二氧化碳能与氢氧化钠反应生成碳酸钠和水,反应的化学方程式为2NaOH+CO2Na2CO3+H2O。
Ⅰ.数据处理①假设40.0 g 10%的NaOH溶液没有变质,设完全反应需要盐酸的质量为a。
NaOH ~ HCl
40 36.5
40 g×10%a×7.3%
4036.5=40g×10%a×7.3%
a=50 g
Ⅱ.熟石灰氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,为使反应完全,需将反应物充分搅拌。(4)根据得到无色溶液和白色沉淀分析可知,溶液中可能存在的溶质是氯化钙。
8
相关文档
- 徐州专版2020中考化学复习方案第72021-11-116页
- 徐州专版2020中考化学复习方案第72021-11-1061页
- 徐州专版2020中考化学复习方案第72021-11-067页
- 徐州专版2020中考化学复习方案第72021-11-065页
- 徐州专版2020中考化学复习方案第72021-11-067页
- 徐州专版2020中考化学复习方案第72021-11-068页
- 徐州专版2020中考化学复习方案第72021-11-068页
- 徐州专版2020中考化学复习方案第72021-11-068页
- 中考化学模拟题专练应用广泛的酸碱2021-05-1032页
- 中考化学一轮复习 应用广泛的酸碱2021-05-109页