- 848.90 KB
- 2021-11-11 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时训练(一) 我们周围的空气
|夯实基础|
1.[2019·岳阳]空气是一种宝贵的自然资源。下列有关空气的说法正确的是 ( )
A.氮气约占空气体积的21%
B.氧气能助燃,可以作燃料
C.稀有气体化学性质不活泼,不与任何物质发生反应
D.空气中二氧化碳含量过高会加剧温室效应
2.[2019·广州]空气是一种宝贵的资源。下列生产生活中用到的气体不是来自空气的是 ( )
A.作为燃料电池燃料的H2 B.用于生产氮肥的N2
C.用于医疗急救的O2 D.用于飞艇的He
3.[2019·山西]中国对大深度载人潜水器“蛟龙号”的研制取得了世界瞩目的成绩,实现了我国挺进深蓝的宏伟目标。乘蛟龙号下潜的科研人员,他们的呼吸环境必须注意调节的是 ( )
A.O2和H2O的含量 B.O2和N2的含量
C.O2和H2的含量 D.O2和CO2的含量
4.[2019·天津]下列对实验现象的描述不正确的是( )
A.镁条在空气中燃烧,发出耀眼白光
B.硫在氧气中燃烧,发出蓝紫色火焰
C.蜡烛在空气中燃烧,生成二氧化碳和水
D.氢气在空气中燃烧,产生淡蓝色火焰
5.[2019·宜昌]如图Z1-1是硫在空气和氧气中燃烧的实验。下列说法不正确的是 ( )
图Z1-1
A.氧气含量越多硫燃烧越剧烈
B.硫在氧气中燃烧发出蓝紫色火焰
C.瓶底的水可以吸收生成的有害气体
D.硫在空气和氧气中燃烧的生成物不同
6.[2019·福建节选]某兴趣小组开展“测定密闭容器中某种气体的体积分数”的探究实验。
6
实验1按图Z1-2甲所示装置,用红磷燃烧的方法测定空气中氧气的体积分数。
实验2按图乙所示装置,在集气瓶内壁用水均匀涂附铁粉除氧剂(其中辅助成分不干扰实验),利用铁锈蚀原理测定空气中氧气的体积分数。
图Z1-2
(1)实验1中,红磷燃烧的主要现象是 。红磷熄灭后,集气瓶冷却至室温,打开K,水能倒吸入集气瓶的原因是 。
(2)为提高实验的准确性,以上两个实验都需要注意的事项是 (写一点)。
(3)实验过程中,连接数字传感器,测得实验1、实验2中氧气的体积分数随时间变化的关系分别如图Z1-3丙、图丁所示。依据图丙、图丁所示信息, (填“实验1”或“实验2”)的测定方法更准确,判断依据是 。
图Z1-3
(4)结合你的学习经验,若要寻找红磷或铁粉除氧剂的替代物,用图甲或图乙装置测定空气中氧气的体积分数,该替代物应满足的条件是 (写两点)。
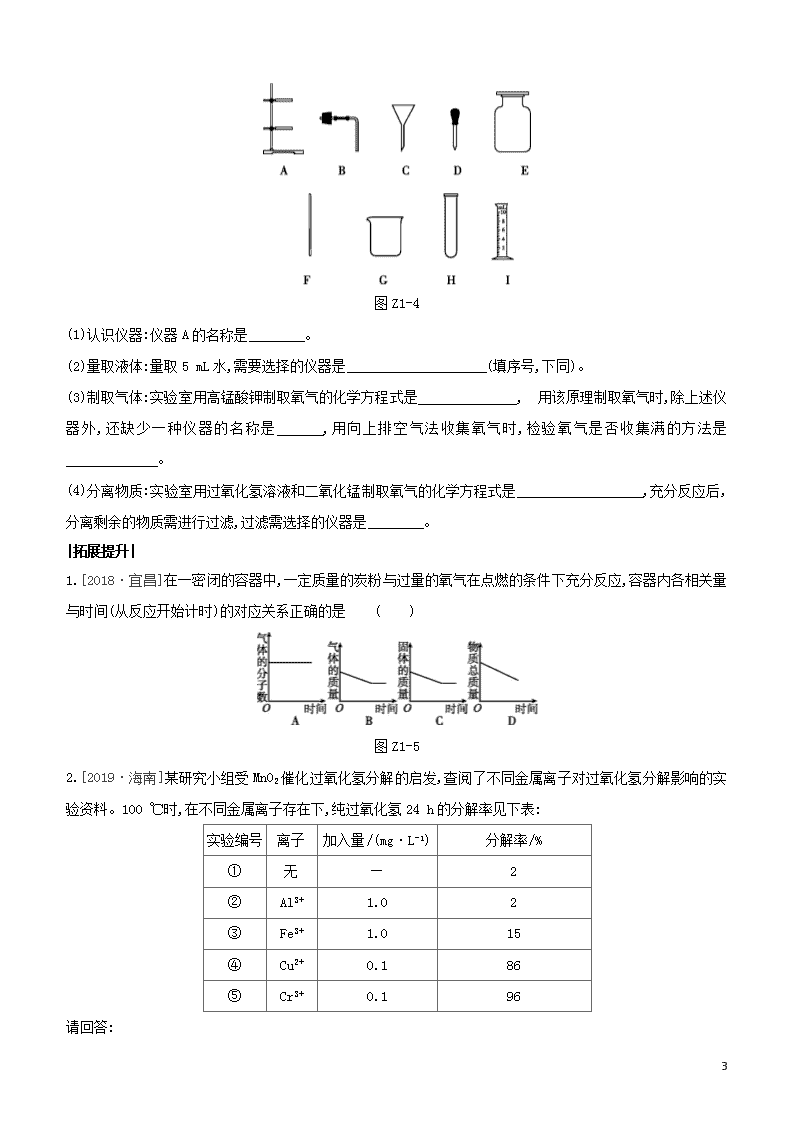
7.[2019·宜昌]下列是实验室常用仪器,据图Z1-4回答问题。
6
图Z1-4
(1)认识仪器:仪器A的名称是 。
(2)量取液体:量取5 mL水,需要选择的仪器是 (填序号,下同)。
(3)制取气体:实验室用高锰酸钾制取氧气的化学方程式是 , 用该原理制取氧气时,除上述仪器外,还缺少一种仪器的名称是 ,用向上排空气法收集氧气时,检验氧气是否收集满的方法是 。
(4)分离物质:实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式是 ,充分反应后,分离剩余的物质需进行过滤,过滤需选择的仪器是 。
|拓展提升|
1.[2018·宜昌]在一密闭的容器中,一定质量的炭粉与过量的氧气在点燃的条件下充分反应,容器内各相关量与时间(从反应开始计时)的对应关系正确的是 ( )
图Z1-5
2.[2019·海南]某研究小组受MnO2催化过氧化氢分解的启发,查阅了不同金属离子对过氧化氢分解影响的实验资料。100 ℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表:
实验编号
离子
加入量/(mg·L-1)
分解率/%
①
无
—
2
②
Al3+
1.0
2
③
Fe3+
1.0
15
④
Cu2+
0.1
86
⑤
Cr3+
0.1
96
请回答:
6
(1)MnO2催化过氧化氢分解的化学方程式为 。
(2)实验①的目的是 。
(3)实际生产中,贮运浓度较高的过氧化氢时,使用铝罐(槽)而不使用不锈钢罐(槽),其原因是 。
3.[2019·苏州节选]实验室常用高锰酸钾制取氧气,可能用到的装置如图Z1-6所示。
图Z1-6
(1)本实验可选用的发生和收集装置为 (填序号)。
(2)①写出高锰酸钾分解制氧气的化学方程式: 。
②上述反应的理论产氧率为 [产氧率=m(氧气)m(高锰酸钾)×100%,结果精确到0.1%]。
③取一定量的高锰酸钾固体,充分加热,发现实际产氧率远高于上述数值,则可能的原因有
(测定过程中产生的误差可忽略)。
(3)某同学进行该实验并用排水法收集O2。下列操作正确的是 (填序号)。
a.未检查装置气密性即向大试管中加入高锰酸钾固体
b.当导管口有连续气泡均匀冒出时,开始收集氧气
c.集气瓶中氧气收集满后,先用玻璃片盖住集气瓶口,再将其移出水面
d.气体收集完毕后,先熄灭酒精灯,再将导管移出水面
6
【参考答案】
夯实基础
1.D [解析]氮气约占空气体积的78 %;氧气能助燃,不具有可燃性,不能作燃料;稀有气体化学性质很不活泼,不易与其他物质发生反应;空气中二氧化碳含量过高会加剧温室效应,是因为导致温室效应的主要气体是二氧化碳。
2.A
3.D [解析]空气中不含氢气,氮气含量远大于氧气,水在常温下呈液态,所以不需要调节H2O、N2、H2的含量。因为在密闭空间内,氧气供给呼吸,人体呼吸会产生二氧化碳气体,二氧化碳不能供给呼吸,且含量偏高会影响人体正常呼吸,乘蛟龙号下潜的科研人员,他们的呼吸环境必须注意调节的是O2和CO2的含量。
4.C [解析]蜡烛在空气中燃烧,生成二氧化碳和水是实验结论,不是实验现象。
5.D [解析]硫在氧气中比在空气中燃烧剧烈,说明氧气含量越多硫燃烧越剧烈;硫在氧气中燃烧发出蓝紫色火焰;二氧化硫能污染空气,该实验瓶底的水可以吸收生成的有害气体二氧化硫;硫在氧气和空气中燃烧都生成二氧化硫气体。
6.(1)产生大量白烟(或发出黄色火焰或放热等合理答案) 氧气被消耗,集气瓶内气体压强小于大气压
(2)装置的气密性良好(或红磷和铁粉除氧剂足量等其他合理答案)
(3)实验2 反应后,实验1集气瓶中剩余氧气的体积分数为8.6%,而实验2集气瓶中氧气几乎耗尽
(4)能够和氧气反应;生成物不影响测定结果(或其他合理答案)
[解析](1)实验1中红磷燃烧产生大量白烟;待集气瓶冷却后,打开K,由于氧气被消耗,集气瓶内气体压强小于大气压,导致水倒吸入集气瓶。(2)实验1和实验2都应注意装置的气密性良好,反应物应足量等事项,从而提高实验的准确性。(3)分析图丙和图丁信息可知,实验2的测定方法更准确,因为实验1中集气瓶剩余氧气的体积分数约为8.6%,而实验2集气瓶中氧气几乎耗尽。(4)通过上述实验可知,若要寻找红磷或铁粉除氧剂的替代物,该物质应能和氧气反应,且生成物不能为气体,不影响测定结果。
7.(1)铁架台
(2)DI(或DIG或DIH)
(3)2KMnO4K2MnO4+MnO2+O2↑
酒精灯 将带火星的木条放在集气瓶口,木条复燃,则氧气集满
(4)2H2O22H2O+O2↑ ACFG
[解析](3)高锰酸钾在加热条件下,分解生成锰酸钾、二氧化锰和氧气;该反应是固体在加热条件下进行,所以还缺少的仪器是酒精灯;如果用向上排空气法收集氧气,检验氧气收集满的操作是将带火星的木条放在集气瓶口,木条复燃,证明已满。(4)过氧化氢在二氧化锰催化作用下分解生成水和氧气;反应后将水和二氧化锰分离
6
需要进行过滤,过滤所需要的仪器有带铁圈的铁架台、漏斗、烧杯、玻璃棒。
拓展提升
1.A [解析]在一密闭的容器中,炭粉在过量的氧气中燃烧生成二氧化碳气体,1个氧分子参加反应生成1个二氧化碳分子,则气体的分子数不变。炭粉在过量的氧气中燃烧生成二氧化碳气体,由质量守恒定律可知,气体的质量增加,完全反应后气体质量不再发生改变。炭粉在过量的氧气中燃烧生成二氧化碳气体,最终炭粉完全反应,固体的质量逐渐减少,最终减少至0。根据质量守恒定律,化学反应前后物质的总质量不变。
2.(1)2H2O22H2O+O2↑
(2)作为对照实验
(3)铝离子不影响过氧化氢的分解,而不锈钢中含有铁、铬等,铁离子和铬离子能够加快过氧化氢的分解
[解析](1)MnO2催化过氧化氢分解生成水和氧气。(2)实验①的目的是作为对照实验,通过对比可知,铝离子不影响过氧化氢的分解速率。(3)实际生产中,贮运浓度较高的过氧化氢时,使用铝罐(槽)而不使用不锈钢罐(槽),其原因是:铝离子不会影响过氧化氢的分解,而不锈钢中含有铁、铬等,铁离子和铬离子能够加快过氧化氢的分解。
3.(1)AE
(2)①2KMnO4K2MnO4+MnO2+O2↑
②10.1%
③K2MnO4或MnO2在加热条件下分解产生氧气
(3)bc
[解析](1)加热高锰酸钾制取氧气,发生装置选择固体加热型的装置A,收集气体可用排水法和向上排空气法,但装置C中导管没有伸到集气瓶底部,故选择装置E。(2)②根据化学方程式可知,每316份质量的高锰酸钾可分解生成32份质量的氧气,所以上述反应的理论产氧率为32316×100%≈10.1%。③取一定量的高锰酸钾固体,充分加热,发现实际产氧率远高于上述数值,则可能的原因为K2MnO4或MnO2在加热条件下也分解产生氧气。(3)制取气体的实验,装药品前要先检查装置气密;当导管口有连续气泡均匀冒出时,开始收集氧气;集气瓶中氧气收集满后,先用玻璃片盖住集气瓶口,再将其移出水面;气体收集完毕后,应先将导管移出水面,再熄灭酒精灯,防止水被倒吸入试管,导致试管炸裂。
6
相关文档
- 包头专版2020中考化学复习方案主题2021-11-1113页
- 北京专版2020中考化学复习方案主题2021-11-1111页
- 北京专版2020中考化学复习方案主题2021-11-117页
- 新课标RJ2020中考化学复习方案主题2021-11-1154页
- 包头专版2020中考化学复习方案主题2021-11-1143页
- 河北专版2020中考化学复习方案主题2021-11-1110页
- 徐州专版2020中考化学复习方案第22021-11-116页
- 徐州专版2020中考化学复习方案第22021-11-116页
- 2020中考化学复习方案主题三身边的2021-11-118页
- 2020中考化学复习方案主题三身边的2021-11-118页