- 1.22 MB
- 2021-11-12 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第
14
课时
溶液酸碱性 常见的酸和碱
第
7
章 应用广泛的酸、碱、盐
【
考试要求
】
1.
了解用酸碱指示剂
(
酚酞、石蕊
)
和
pH
试纸检验溶液酸碱性的方法。
(B)
2.
知道酸碱性对人体健康和农作物生长的影响。
(A)
3.
认识常见酸碱的主要性质和用途。
(B)
4.
知道酸碱的腐蚀性。
(A)
5.
初步学会常见酸碱溶液的稀释方法。
(B)
6.
初步认识常见的复分解反应。
(A)
7.
能用常见的四种反应类型解释日常生活中的一些化学现象。
(C)
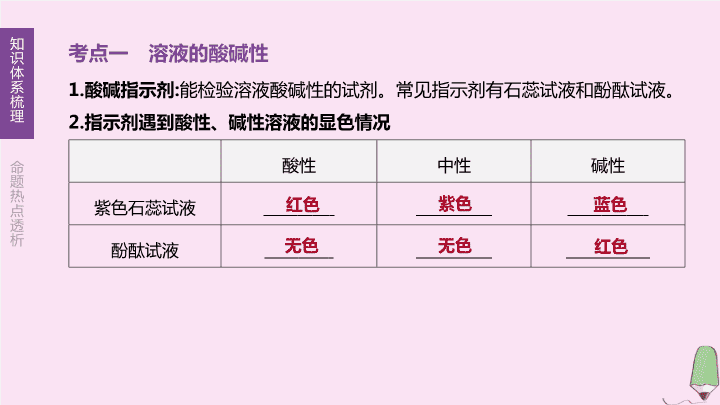
考点一 溶液的酸碱性
1.
酸碱指示剂
:
能检验溶液酸碱性的试剂。常见指示剂有石蕊试液和酚酞试液。
2.
指示剂遇到酸性、碱性溶液的显色情况
酸性
中性
碱性
紫色石蕊试液
酚酞试液
红色
紫色
蓝色
无色
无色
红色
3.
用蓝色石蕊试纸和红色石蕊试纸检测溶液酸碱性
(1)
检测
性溶液用红色石蕊试纸
,
现象是试纸变
色。
(2)
检测
性溶液用蓝色石蕊试纸
,
现象是试纸变
色。
碱
蓝
酸
红
易错判断
(1)
石蕊试液遇碱变蓝
,
遇酸变红属于化学变化
(
)
(2)
可以用无色酚酞试液一次性鉴别氯化钠溶液、纯碱溶液和稀盐酸
(
)
(3)
能使无色酚酞试液变红色的溶液一定是碱溶液
(
)
√
×
×
考点二 溶液酸碱度的表示方法
1.
酸碱度
:
是指溶液酸碱性强弱的程度
,
常用
pH
表示。
(1)pH
的取值范围通常在
之间。
(2)
溶液酸碱性强弱与
pH
的关系如图
14-1
所示。
图
14-1
0~14
(3)
酸碱溶液稀释时的
pH
变化
若向酸性溶液中加水将其稀释
,
溶液的
pH
将会
增大
,
但不会超过
7
;
而向碱性溶液中加水将其稀释时
,
溶液的
pH
将会
减小
,
但不会
小于
7(
如图
14-2
所示
)
。
图
14-2
2.pH
的测定方法
测定溶液
pH
可以用
pH
计和
,
其中较简便的方法是用
。具体操作方法为
:
用干燥洁净的玻璃棒蘸取被测溶液并滴在
上
,
把显示的颜色与标准比色卡对照
,
读出相同颜色的
pH
。
pH
试纸
pH
试纸
pH
试纸
3.
溶液酸碱度的应用
(1)
科学实验及化工生产有许多
变化必须在一定
pH
的溶液中才能发生。
(2)
农作物一般适宜在
pH
的土壤中才能生长。
(3)
测定雨水的
pH
能了解空气质量
,
酸雨的
pH
5.6(
因溶有二氧化碳
,
正常雨水的
pH
约为
5.6)
。
(4)
测定人体内或排出的液体的
pH,
可以了解人的
状况。
化学
=7
或接近
7
小于
健康
易错判断
(1)
检测溶液酸碱度时
,
可以将
pH
试纸伸入待测溶液中
(
)
(2)
用湿润的
pH
试纸检测溶液酸碱度时
,
对检测结果没有影响
(
)
(3)
用
pH
试纸测定一瓶稀盐酸的
pH,
结果为
pH=3.6 (
)
(4)
可以用
pH
试纸、酸度计
(pH
计
)
和酸碱指示剂检测溶液的酸碱度
(
)
×
×
×
×
考点三 常见的酸
1.
浓盐酸与浓硫酸
(1)
浓盐酸和浓硫酸性质比较
浓
盐酸
(
溶质为
HCl)
浓
硫酸
(
溶质为
H
2
SO
4
)
性质
无色、有
气味的液体
,
密度比水大
,
具有
性
,
打开瓶塞后
,
瓶口有
冒出
无色、黏稠、油状的液体
,
密度比
水
,
具有
性
(
物理性质
)
、
脱水性
和腐蚀性
(
化学性质
)
刺激性
挥发
白雾
大
吸水
(续表)
浓
盐酸
(
溶质为
HCl)
浓
硫酸
(
溶质为
H
2
SO
4
)
敞口放
置后的
变化
溶液质量变
,
溶质的质量分数变
,
需密封保存
溶液质量变
,
溶质的质量分数
变
,
需密封保存
小
小
大
小
(2)
浓硫酸稀释
在稀释浓硫酸时
,
一定要把
沿容器壁慢慢注入
里
,
并用玻璃棒不断搅拌
,
使产生的热量迅速地扩散
,
切不可把
倒入
中。
浓硫酸
水
水
浓硫酸
图
14-3
2.
酸的通性
(
以稀盐酸和稀硫酸为例
)
酸的通性
稀盐酸
稀硫酸
与
酸碱指示剂作用
使紫色石蕊试液变
,
无色酚酞试液
酸
+
活泼金属→
盐
+
氢气
(
以锌为例
)
酸
+
金属
氧化物
→盐
+
水
(
以氧化铁为例
)
红
不变色
2HCl+Zn ZnCl
2
+H
2
↑
H
2
SO
4
+Zn ZnSO
4
+H
2
↑
6HCl+Fe
2
O
3
2FeCl
3
+
3H
2
SO
4
+Fe
2
O
3
Fe
2
(SO
4
)
3
3H
2
O
+3H
2
O
(续表)
酸的通性
稀盐酸
稀硫酸
酸
+
碱→盐
+
水
(
以氢氧化钠为例
)
酸
+
盐
→新
酸
+
新
盐
(
以碳酸钠为例
)
性质相似的原因
溶液中都有
HCl+NaOH NaCl+
H
2
SO
4
+2NaOH Na
2
SO
4
+
2HCl+Na
2
CO
3
H
2
O
H
2
SO
4
+Na
2
CO
3
H
2
O+CO
2
↑
H
+
+H
2
O
+CO
2
↑
+2NaCl
+2H
2
O
+CO
2
↑
+Na
2
SO
4
3.
用途
:
盐酸常用于金属表面除铁锈、制药等
;
硫酸常用于制化肥、农药、火药、染料以及冶炼金属、精炼石油和金属表面除锈等。
易错判断
(1)
用如图
14-4
所示装置干燥气体时
,
瓶内装有稀硫酸
,
将气体从
a
端通入
(
)
(2)
浓硫酸不慎沾到皮肤或衣服上时
,
应先用大量水冲洗
,
再涂上氢氧化钠溶液
(
)
×
×
图
14-4
考点四 常见的碱
1.
氢氧化钠和氢氧化钙性质及用途
氢氧化钠
(NaOH)
氢氧化钙
[Ca(OH)
2
]
俗称
、
、
、
物理
性质
白色固体
,
易溶于水
,
溶解
时
__________
热量
,
易吸收空气中水蒸气
而
白色粉末
,
溶于水
,
溶解度随温度升高而
腐蚀性
有强烈腐蚀性
有腐蚀性
火碱
烧碱
苛性钠
熟石灰
消石灰
放出
潮解
微
减小
(续表)
氢氧化钠
(NaOH)
氢氧化钙
[Ca(OH)
2
]
制
取
(
化学方程式
)
Na
2
CO
3
+Ca(OH)
2
CaCO
3
↓
+
2NaOH
(
该反应能
热量
)
保存
密封保存的原因
:
①
氢氧化钠固体易潮解
;②
可与空气中的
CO
2
反应而变质
,
化学方程式
为
密封保存
,
其原因是可与空气中的
CO
2
反应而变质
,
化学方程式
为
用途
用于制取肥皂、造纸、石油、纺织、印染等
用于建筑业
;
改良酸性土壤和配制波尔多液
CaO+H
2
O Ca(OH)
2
放出
2NaOH+CO
2
Na
2
CO
3
+H
2
O
Ca(OH)
2
+CO
2
CaCO
3
↓
+H
2
O
2.
碱的通性
(
以氢氧化钠和氢氧化钙为例
)
碱的通性
氢氧化钠
氢氧化钙
与
酸碱指示剂
作用
使
紫色石蕊试液变成
色
,
无色酚酞试液变成
色
碱
+
非金属
氧化物
→盐
+
水
(
以
CO
2
为例
)
碱
+
盐
→新
碱
+
新盐
(
以
CuSO
4
为例
)
碱
+
酸→盐
+
水
(
中和反应
)(
以
HCl
为例
)
性质相似的原因
溶液中都有
蓝
红
2NaOH+CO
2
Ca(OH)
2
+CO
2
CaCO
3
↓
+H
2
O
2NaOH+CuSO
4
Ca(OH)
2
+CuSO
4
Cu(OH)
2
↓
+
NaOH+HCl
Ca(OH)
2
+2HCl CaCl
2
+2H
2
O
OH
-
+CaSO
4
Na
2
CO
3
+H
2
O
Cu(OH)
2
↓
+Na
2
SO
4
NaCl+H
2
O
易错判断
(1)
可以用氢氧化钠溶液治疗胃酸过多
(
)
(2)
用碱石灰
(
烧碱和生石灰的混合物
)
干燥二氧化碳
,
用浓硫酸干燥氨气
(
)
×
×
考点五 中和反应 复分解反应
1.
定义
和
作用生成盐和水的反应叫作中和反应。中和反应能
热量
,
属于
反应。
2.
应用
(1)
改良土壤的酸碱性。
(2)
处理工厂的废水
,
一般用
中和硫酸厂的污水
(
污水中含硫酸等杂质
)
。
(3)
用于医药和日常生活中
,
如用胃舒平
(
含氢氧化铝
)
等药物来治疗胃酸过多症。
(4)
被蚊虫叮咬
(
分泌出蚁酸
)
后
,
涂一些碱性物质
(
如肥皂、牙膏
),
就可减轻痛痒。
(5)
调节溶液的酸碱性
,
把溶液的
pH
控制在一定范围内。
酸
碱
放出
复分解
熟石灰
3.
复分解反应是指两种
相互交换成分
,
生成两种新的
的反应。可表示为
AB+CD AD+CB,
其特征为“双交换、价不变”。
(1)
复分解反应通常发生在以下五组物质之间
:①
酸和碱、
②
酸和金属氧化物、
③
酸和盐、
④
碱和盐、
⑤
盐和盐
(
初中化学暂不要求
)
。
(2)
复分解反应发生的条件
①
反应物的要求
:
有酸酸溶
,
无酸两可溶。
②
生成物的要求
:
两种化合物交换成分后
,
能生成气体、沉淀或水。
(3)
常见的不溶物有
:
“五白”
[CaCO
3
、
BaCO
3
、
BaSO
4
、
AgCl
、
Mg(OH)
2
]
、“一蓝”
[Cu(OH)
2
]
、“一红褐”
[Fe(OH)
3
]
。
化合物
化合物
易错判断
(1)
能生成盐和水的反应一定是中和反应
(
)
(2)
二氧化碳与氢氧化钠溶液的反应属于复分解反应
(
)
×
×
化学方程式网络构建
图
14-5
①
;
②
;
③
;
④
;
⑤
;
⑥
;
⑦
;
⑧
;
⑨
;
HCl+NaOH NaCl+H
2
O
Mg+2HCl MgCl
2
+H
2
↑
2Al+6HCl 2AlCl
3
+3H
2
↑
Zn+H
2
SO
4
ZnSO
4
+H
2
↑
Fe+H
2
SO
4
FeSO
4
+H
2
↑
Fe
2
O
3
+6HCl 2FeCl
3
+3H
2
O
Na
2
CO
3
+H
2
SO
4
Na
2
SO
4
+H
2
O+CO
2
↑
2NaOH+CO
2
Na
2
CO
3
+H
2
O
2NaOH+CuSO
4
Cu(OH)
2
↓
+Na
2
SO
4
对点演练
1.
厨房中的下列物质或其水溶液呈酸性的是
(
)
A.
食醋
B.
淀粉
C.
白糖
D.
豆油
题组
1
溶液的酸碱性
A
2.
下列溶液能使紫色石蕊试液变成蓝色的是
(
)
A.
澄清石灰水
B.NaCl
溶液
C.
稀硫酸
D.KNO
3
溶液
[
答案
]A
[
解析
]
澄清石灰水显碱性
,
能使石蕊试液变蓝色
;
氯化钠溶液和硝酸钾溶液显中性
,
不能使石蕊试液变色
;
稀硫酸显酸性
,
能使石蕊试液变红色。
3.
四种植物花汁在不同酸碱性下呈现的颜色如下表所示。若要检测某溶液的酸碱性
,
最好选用
(
)
A.
玫瑰花汁
B.
万寿菊花汁
C.
大红花汁
D.
万年青花汁
pH
<7
=7
>7
玫瑰花汁
粉红
粉红
黄
万寿菊花汁
黄
黄
黄
大红花汁
橙
粉红
绿
万年青花汁
橙黄
浅绿
浅绿
[
答案
]
C
[
解析
]
通过比较表中信息
,
可以发现只有大红花汁能在酸性、碱性、中性溶液中分别呈现不同的颜色
,
故最好选用大红花汁检测某溶液的酸碱性。
4.
一些食物的
pH
范围如下
,
其中呈碱性的是
(
)
A.
柠檬汁
(2.0~3.0) B.
番茄汁
(4.0~4.4)
C.
牛奶
(6.3~6.6) D.
鸡蛋清
(7.6~8.0)
题组
2
溶液酸碱度的表示方法
D
5.
下列有关测定氢氧化钠溶液
pH
的实验操作或描述
,
你认为正确的是
(
)
A.
用镊子夹取
pH
试纸直接伸入氢氧化钠溶液中测量
B.
先用蒸馏水将
pH
试纸润湿
,
再用滴管吸取氢氧化钠溶液滴到
pH
试纸上测量
C.
用洁净干燥的玻璃棒蘸取氢氧化钠溶液滴到
pH
试纸上
,
再与标准比色卡对照
D.
用
pH
试纸测得该氢氧化钠溶液的
pH=12.6
[
答案
]
C
[
解析
]
不能将
pH
试纸伸入待测液中
,
以免污染待测液
;
氢氧化钠溶液显碱性
,
若使用蒸馏水润湿后的
pH
试纸进行测定
,
会使溶液的碱性减弱
,
测定结果偏小
;
用
pH
试纸测得溶液的
pH
应取整数。
6.
一些物质的近似
pH
如图
14-6,
下列有关说法正确的是
(
)
A.
苹果汁的酸性比纯鲜牛奶的酸性弱
B.
肥皂水的碱性比炉具清洁剂的碱性强
C.
厕所清洁剂与炉具清洁剂能混用
D.
人被某些蚊虫叮咬后
,
可涂抹肥皂水以减轻痛痒
图
14-6
[
答案
]
D
[
解析
]
苹果汁的
pH
约为
3,
纯鲜牛奶的
pH
约为
6~7,pH
越小
,
酸性越强
,
所以苹果汁的酸性比纯鲜牛奶的酸性强
;
肥皂水的
pH
约为
10,
炉具清洁剂的
pH
约为
12~13,pH
越大
,
碱性越强
,
所以肥皂水的碱性比炉具清洁剂的碱性弱
;
厕所清洁剂呈酸性
,
炉具清洁剂呈碱性
,
二者能发生反应
,
所以不能混合使用
;
蚊虫叮咬后会产生蚁酸
,
而肥皂水显碱性
,
所以人被某些蚊虫叮咬后可涂抹肥皂水以减轻痛痒。
7.
下列有关硫酸和盐酸的说法不正确的是
(
)
A.
打开浓盐酸的试剂瓶盖
,
出现白雾
B.
稀盐酸和稀硫酸都可用于金属除锈
C.
浓硫酸敞口放置在空气中因变质导致浓度变小
D.
稀释浓硫酸时
,
要把浓硫酸缓缓注入盛有水的烧杯中
,
用玻璃棒不断搅拌
题组
3
常见的酸
C
8.
在
①
氧化铁、
②
金属锌、
③
氢氧化铜、
④
氯化钡溶液四种物质中
,
跟稀硫酸、稀盐酸都能发生反应且反应中表现了“酸的通性”的组合是
(
)
A.①②③④ B.①②③
C.①③④ D.②③④
[
答案
]B
[
解析
]
氧化铁与稀硫酸、稀盐酸都能反应生成可溶性铁盐
,
属于金属氧化物与酸的反应
;
金属锌与稀硫酸、稀盐酸能反应生成锌盐和氢气
,
属于金属与酸的反应
;
氢氧化铜与稀硫酸、稀盐酸能反应生成铜盐和水
,
属于碱和酸的反应
;
氯化钡只能与稀硫酸反应
,
不能与稀盐酸反应。
9.
盐酸是重要的化工产品。
(1)
盐酸可用于金属表面除锈
,
请写出盐酸除铁锈的化学方程式
:
。
[
答案
]
(1)Fe
2
O
3
+6HCl 2FeCl
3
+3H
2
O
[
解析
]
(1)
铁锈主要成分是氧化铁
,
盐酸与氧化铁反应生成氯化铁和水
,
化学方程式为
Fe
2
O
3
+6HCl 2FeCl
3
+3H
2
O
。
9.
盐酸是重要的化工产品。
(2)
盐酸具有挥发性
,
在空气中打开盛有浓盐酸的试剂瓶瓶盖
,
在瓶口处观察到的现象是
。
[
答案
]
(2)
有白雾
[
解析
]
(2)
盐酸具有挥发性
,
在空气中打开盛有浓盐酸的试剂瓶瓶盖
,
氯化氢气体与水蒸气在瓶口处形成盐酸小液滴
,
观察到的现象是有白雾形成。
9.
盐酸是重要的化工产品。
(3)
氨水也具有挥发性
,
可挥发出氨气。如图
14-7,
在
a
、
b
处放有浸泡过浓盐酸或浓氨水的棉花
,
过一会儿在
c
处可观察到的现象是
,a
处是放有浸泡过
的棉花
(
已知
:①NH
3
与
HCl
在空气中相遇可反应生成白色固体
NH
4
Cl;②
相对分子质量越小的气体扩散速度越快
)
。
图
14-7
[
答案
]
(3)
有白烟 浓氨水
[
解析
]
(3)
氨气与氯化氢气体反应生成白色固体氯化铵
,c
处可观察到有白烟生成。相对分子质量越小的气体扩散速度越快
,
故
a
处是放有浸泡过浓氨水的棉花。
9.
盐酸是重要的化工产品。
(4)
实验室可用
NH
4
Cl
与
Ca(OH)
2
固体加热发生复分解反应制取
NH
3
,
请写出此反应的化学方程式
:
,
收集
NH
3
可用向
排空气法。
[
答案
]
(4)2NH
4
Cl+Ca(OH)
2
CaCl
2
+ 2NH
3
↑
+2H
2
O
下
[
解析
]
(4)NH
4
Cl
与
Ca(OH)
2
固体受热反应生成
NH
3
、氯化钙和水
,
反应的化学方程式为
2NH
4
Cl+Ca(OH)
2
CaCl
2
+ 2NH
3
↑
+2H
2
O,NH
3
密度比空气小
,
收集
NH
3
可用向下排空气法。
10.
下列关于氢氧化钠的描述中错误的是
(
)
A.
易溶于水
,
溶解时放出大量的热
B.
对皮肤具有强烈的腐蚀作用
C.
氢氧化钠溶液能使紫色石蕊试液变红
D.
能去除油污
,
可作炉具清洁剂
题组
4
常见的碱
C
11.
下面是某同学进行碱的化学性质实验时记录的实验现象
,
其中与事实不相符的是
(
)
A.
在
NaOH
溶液中加入稀盐酸
,
无明显变化
B.
在
NaOH
溶液中通入
CO
2
气体
,
有白色沉淀生成
C.
在
Ca(OH)
2
溶液中滴加石蕊试液
,
溶液呈蓝色
D.
在
NaOH
溶液中加入
CuSO
4
溶液
,
有蓝色沉淀生成
B
12.
某同学用如图
14-8
总结
NaOH
的四条化学性质
(
即
NaOH
能够与四类物质发生化学反应
)
。
(1)
为验证性质
①,
该同学将无色酚酞试液滴入
NaOH
溶液中
,
溶液颜色由无色变成
。
图
14-8
[
答案
]
(1)
红色
[
解析
]
(1)
氢氧化钠溶液显碱性
,
能使无色酚酞试液变成红色。
12.
某同学用如图
14-8
总结
NaOH
的四条化学性质
(
即
NaOH
能够与四类物质发生化学反应
)
。
(2)
为了验证性质
③,
该同学可选择的物质是
(
填序号
)
。
A.Na
2
CO
3
B.HCl
C.CuSO
4
D.Ba(NO
3
)
2
图
14-8
[
答案
]
(2)C
[
解析
]
(2)
根据复分解反应发生的条件可知
,
氢氧化钠不能与碳酸钠、硝酸钡反应
;HCl
属于酸
,
不符合题意
;
氢氧化钠能与硫酸铜溶液反应生成蓝色沉淀。
12.
某同学用如图
14-8
总结
NaOH
的四条化学性质
(
即
NaOH
能够与四类物质发生化学反应
)
。
(3)
利用性质
④,
可以用氢氧化钠溶液吸收二氧化碳气体
,
该反应的化学方程式为
。
图
14-8
CO
2
+2NaOH Na
2
CO
3
+H
2
O
13.
海水提取镁的反应之一为
MgCl
2
+Ca(OH)
2
CaCl
2
+Mg(OH)
2
↓
,
该反应属于
(
)
A.
化合反应
B.
复分解反应
C.
置换反应
D.
分解反应
题组
5
中和反应 复分解反应
B
14.
中和反应在生活中有广泛应用。下列应用不属于中和反应的是
(
)
A.
用盐酸除铁锈
B.
服用含有氢氧化镁的药物治疗胃酸过多
C.
用熟石灰改良酸性土壤
D.
用硫酸处理印染厂含碱废水
[
答案
]A
[
解析
]
中和反应是指酸和碱的反应
,
用盐酸除铁锈
,
反应物是金属氧化物和酸。
15.
兴趣小组的同学用氢氧化钠溶液和稀盐酸进行中和反应实验
,
具体操作如图
14-9
。
在烧杯中加入
10 mL
的氢氧化钠溶液
,
滴入几滴酚酞试液
,
此时溶液呈
色。接着加入一定量的稀盐酸
,
用玻璃棒搅拌后发现溶液为无色
,
此时
(
填“能”或“不能”
)
得出两者恰好中和的结论。以下操作及实验现象能证明加入的盐酸过量的是
(
填序号
)
。
A.
加入少量铁粉
,
无明显现象
B.
滴加紫色石蕊试液
,
搅拌后溶液变蓝
C.
加入碳酸钠溶液
,
产生气泡
图
14-9
[
答案
]
红 不能
C
[
解析
]
碱性溶液能使无色酚酞试液变红色。加入一定量的稀盐酸后
,
溶液为无色
,
溶液可能呈中性
,
也可能呈酸性
,
不能得出两者恰好中和的结论。若盐酸过量
,
则加入铁粉
,
会产生气泡
,
滴加紫色石蕊试液
,
溶液会变成红色
,
加入碳酸钠溶液
,
会产生气泡
,
综上所述
,
应选
C
。
16.
某实验小组做中和反应的实验
,
向盛有氢氧化钠溶液
(
滴有酚酞试液
)
的烧杯中逐滴加入稀盐酸
,
并不断搅拌。如图
14-10
为依据实验数据绘制的
V
(
盐酸
)-pH
图。
(1)
滴加盐酸的体积为
V
1
时
,
溶液呈
色。
(2)
滴加盐酸的体积为
V
2
时
,
溶液中除了水分子
外
,
还存在的微粒有
。
(3)
举出中和反应的一个应用实例
:
。
红
用熟石灰改良酸性土壤等
图
14-10
钠离子和氯离子
考向一 溶液的酸碱性和酸碱度
(
6
年
6
考)
1.
[2016
·
徐州
]
下列有关实验的叙述错误的是
(
)
A.
酚酞试液遇到白醋不变色
B.
石灰水中滴加硫酸铜溶液产生蓝色沉淀
C.
硝酸铵溶于水使溶液温度降低
D.
红磷在空气中燃烧产生大量白雾
D
2.
[2015
·
徐州
]
下列有关实验操作的叙述中
,
错误的是
(
)
A.
用
pH
试纸测定未知溶液的酸碱度时
,
应将
pH
试纸预先用水湿润
B.
实验室用高锰酸钾制取
O
2
,
在实验结束时应先将导管移出水面
,
再停止加热
C.
稀释浓硫酸时
,
要把浓硫酸缓缓注入盛有水的烧杯中
,
用玻璃棒引流并不断搅拌
D.
在粗盐提纯实验中
,
待蒸发皿中出现较多固体时
,
停止加热
,
利用余热将滤液蒸干
[
答案
]A
[
解析
]
用湿润的
pH
试纸测定溶液的
pH,
有可能会使测得的
pH
不准确。
3.
拓展
某化学组进行“溶液酸碱性的检验”的实验。
(1)
把自制的紫薯汁分别滴加到试管中
,
观察到的现象如下表所示。
据上表推测
,
紫薯汁遇到稀硫酸可能显示的颜色是
,
该汁液
(
填“能”或“不能”
)
作酸碱指示剂。
溶液
白醋
盐酸
蔗糖水
草木灰水
石灰水
加入紫
薯汁
后
的颜色
红色
红色
紫色
绿色
绿色
红色
能
3.
拓展
某化学组进行“溶液酸碱性的检验”的实验。
(2)
用
pH
试纸测定表中部分溶液的酸碱度
:
草木灰水
pH>7,
属于
(
填“酸性”“碱性”或“中性”
)
溶液
,
白醋
pH
(
填“
>
”“
<
”或“
=
”
)7
。
[
答案
]
(2)
碱性
<
[
解析
]
(2)pH>7
的溶液属于碱性溶液
;
向白醋与盐酸中分别加入紫薯汁后
,
试管中溶液均呈红色
,
即白醋呈酸性
,
故其
pH<7
。
3.
拓展
某化学组进行“溶液酸碱性的检验”的实验。
(3)
如图
14-11
是三位同学分别测定土壤酸碱度的操作示意图
,
其中正确的操作是
(
填“
A
”“
B
”或“
C
”
,
下同
),
可能导致被测溶液的
pH
发生改变的错误操作是
。
图
14-11
[
答案
]
(3)B
C
(4)D
[
解析
]
(3)
不能将试纸伸入溶液中
,
以免溶液被污染
;
不能用润湿的
pH
试纸测定
pH,
否则可能导致测定值不准确。
3.
拓展
某化学组进行“溶液酸碱性的检验”的实验。
(4)
在一次实验开放日活动中
,
小明同学取出一无色溶液
,
向其中滴加酚酞试液后变红色。小明同学得出的下列结论中正确的是
。
A.
该溶液能使石蕊试液变成红色
B.
该溶液的
pH
小于
7
C.
该溶液中的溶质一定是某种碱
D.
该溶液显碱性
[
答案
]
(4)D
[
解析
]
(4)
碱性溶液能使石蕊试液变蓝
;
碱性溶液的
pH
大于
7;
碱性溶液的溶质也可能是某种盐
,
比如碳酸钠。
【
技法点拨
】
用
pH
试纸测定未知溶液的
pH
时
,
可按“一蘸、二滴、三比较”的方法进行
,
切不可把试纸伸入待测液中
,
以免污染待测液
;
也不能用湿润的
pH
试纸
,
否则对测定值可能会有影响
,
具体表现为“酸大碱小中不变”。
考向二 酸和碱的性质与用途
(
6
年
6
考)
4.
[2019
·
徐州
]
下列实验方案设计不能达到实验目的的是
(
)
A.
用灯帽熄灭酒精灯
,
以说明物质燃烧需要达到着火点
B.
用铁和硫酸铜溶液可验证铁、铜两种金属的活动性强弱顺序
C.
利用盛有浓硫酸的洗气瓶
,
可除去
CO
2
气体中混有的少量水蒸气
D.
用紫色石蕊试液
,
就可区别盐酸、氢氧化钠溶液和食盐水三种无色溶液
[
答案
]
A
[
解析
]
用灯帽熄灭酒精灯利用的是隔绝空气的灭火原理
,A
符合题意
;
铁能把铜从硫酸铜溶液中置换出来
,
说明铁的活动性比铜强
,B
不符合题意
;
浓硫酸具有吸水性
,
且不与二氧化碳反应
,
能用于干燥二氧化碳气体
,C
不符合题意
;
将紫色石蕊试液分别滴入三种溶液中
,
溶液变红色
,
则原溶液为稀盐酸
,
溶液变蓝色
,
则原溶液为氢氧化钠溶液
,
溶液不变色
,
则原溶液为食盐水
,D
不符合题意。
5.
[2016
·
徐州
]
下列有关实验的描述错误的是
(
)
A.
用肥皂水可以区分硬水和蒸馏水
B.
稀释浓硫酸时应将水倒入浓硫酸中
C.
用氢氧化钠溶液可以除去一氧化碳中混有的二氧化碳
D.
蒸发结晶时
,
当蒸发皿中出现较多固体时即可停止加热
[
答案
]
B
[
解析
]
稀释浓硫酸时
,
应将浓硫酸慢慢注入水中
,
并用玻璃棒搅拌。
6.
[2017
·
徐州
]
酸、碱、盐是我们身边重要的化合物。
(1)
碱溶液有许多共同性质
,
是因为不同的碱溶液中都有
(
填离子符号
)
。
(2)
常用小苏打治疗胃酸过多
,
有关反应的化学方程式是
______________________
。
OH
-
NaHCO
3
+HCl
NaCl+H
2
O+CO
2
↑
6.
[2017
·
徐州
]
酸、碱、盐是我们身边重要的化合物。
(3)
将一定量的硫酸铜溶液与氢氧化钠溶液混合
,
充分反应后过滤
,
得到无色溶液。该无色溶液中一定含有溶质硫酸钠
,
可能含有溶质
。若要验证这种可能含有的溶质
,
不宜使用
(
填序号
)
。
A.
酚酞试液
B.pH
试纸
C.
硫酸铵
D.
氯化钠
[
答案
]
(3)NaOH(
或氢氧化钠
)
D
[
解析
](3)
硫酸铜溶液与氢氧化钠溶液发生反应的化学方程式为
2NaOH+CuSO
4
Na
2
SO
4
+Cu(OH)
2
↓
,
过滤后
,
得到无色溶液
,
说明硫酸铜反应完了
,
氢氧化钠可能反应完
,
也可能过量
,
因此可能含有的溶质是
NaOH
。检验是否含有氢氧化钠
,
就是检验溶液是否呈碱性
,
可以用酚酞
,
观察溶液是否变红
;
可以测
pH;
可以用硫酸铵
,
观察是否有刺激性气味的气体产生
;
碱性溶液不与氯化钠反应
,
不能用
NaCl
检验
NaOH
。
7.
[2017
·
徐州二模
]
盛有氢氧化钠溶液的试剂瓶
,
如果密封不好
,
氢氧化钠就会变质。
(1)
写出氢氧化钠变质的化学方程式
:
。
(2)
既能证明氢氧化钠变质
,
又能除去变质氢氧化钠中的杂质
,
该试剂是
(
填序号
)
。
A.
稀盐酸
B.Ca(OH)
2
溶液
C.CaCl
2
溶液
D.
稀硫酸
(3)
变质后的氢氧化钠溶液
,
其
pH
(
填“
>
”“
<
”或“
=
”
)7
。
2NaOH+CO
2
Na
2
CO
3
+H
2
O
B
>
8.
拓展
碳酸钙、生石灰、熟石灰在一定条件下可以发生如图
14-12
所示转化关系。
(1)
生石灰是常用的干燥剂
,
其主要成分属于
(
填序号
)
。
①
酸
②
碱
③
盐
④
氧化物
④
图
14-12
8.
拓展
碳酸钙、生石灰、熟石灰在一定条件下可以发生如图
14-12
所示转化关系。
(2)
写出熟石灰在工农业生产中的一种用途
:
。
图
14-12
[
答案
]
(2)
改良酸性土壤
(
合理即可
)
[
解析
]
(2)
熟石灰可用作建筑材料、改良酸性土壤、配制农药波尔多液等。
8.
拓展
碳酸钙、生石灰、熟石灰在一定条件下可以发生如图
14-12
所示转化关系。
(3)
写出从生石灰得到熟石灰的化学方程式
:
。
CaO+H
2
O Ca(OH)
2
图
14-12
9.
拓展
[2019
·
枣庄
]
酸、碱、盐在生产生活中具有广泛的用途。化学实验室中有失去标签的四瓶无色溶液
:
稀盐酸、氢氧化钙溶液、碳酸钠溶液、酚酞试液。现将其任意编号为
A
、
B
、
C
、
D,
然后两两组合进行实验
,
其中部分现象如下表
:
(1)
酚酞试液是
(
填编号
)
。
(2)B
与
C
反应的化学方程式为
,
反应所属的类型是
。
(3)
写出
D
的一种用途
:
。
实验
A+B
A+C
B+C
B+D
现象
溶液变红
溶液变红
产生沉淀
产生气体
[
答案
]
(1)A
(2)Na
2
CO
3
+Ca(OH)
2
CaCO
3
↓
+2NaOH
复分解反应
(3)
除铁锈
(
合理即可
)
[
解析
]
由表格中现象分析可知
,A
是酚酞试液
,B
、
C
分别是氢氧化钙溶液、碳酸钠溶液中的一种
,D
为稀盐酸
,
可用于除铁锈
;
由
B+C
产生沉淀、
B+D
产生气体可知
,B
为碳酸钠溶液
,C
为氢氧化钙溶液
;B
与
C
反应
,
是碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠
,
属于复分解反应。
考向三 酸碱中和反应
(
6
年
3
考)
10.
[2018
·
徐州树人二模
]
NaOH
溶液和稀盐酸发生中和反应的过程中
,
溶液
pH
的变化如图
14-13
所示。下列说法正确的是
(
)
A.
反应开始前
,
测量的是
NaOH
溶液的
pH
B.
b
点时
,NaOH
和
HCl
恰好完全反应
C.
a
点处的溶液能够使酚酞试液变红
D.
c
点处的溶液能与
Fe
反应产生气体
图
14-13
[
答案
]
B
[
解析
]
根据
pH
曲线走势可知
,
该实验是将氢氧化钠溶液滴入稀盐酸中
,A
错误
;
在
a
点
,
稀盐酸没有完全反应
,
溶液呈酸性
,
滴加酚酞不变色
,C
错误
;c
点时
,
氢氧化钠过量
,
溶液呈碱性
,
不能与铁发生反应
,D
错误。
11.
[2014
·
徐州
]
中和反应在工农业生产中应用广泛
,
现向
40 g 10%
的氢氧化钠溶液中不断滴加盐酸
,
同时测定溶液
pH
的变化
(
曲线如图
14-14)
。请分析计算
:
(1)40 g 10%
的氢氧化钠溶液中含有
g
的氢氧化钠
;
当滴入
36.5 g
盐酸时
,
溶液的
pH
为
。
图
14-14
4
7
11.
[2014
·
徐州
]
中和反应在工农业生产中应用广泛
,
现向
40 g 10%
的氢氧化钠溶液中不断滴加盐酸
,
同时测定溶液
pH
的变化
(
曲线如图
14-14)
。请分析计算
:
(2)
所用盐酸的溶质质量分数。
(
写出计算过程
)
图
14-14
(2)
解
:
设盐酸中溶质的质量为
x
。
NaOH+HCl NaCl+H
2
O
40 36.5
4 g
x
x
=3.65 g
所用盐酸的溶质质量分数为
×100%=10%
。
答
:
所用盐酸的溶质质量分数为
10%
。
12.
拓展
[2019
·
宿迁改编
]
根据氢氧化钠溶液和稀硫酸反应的微观示意图回答问题。
(1)
写出氢氧化钠溶液和稀硫酸反应的化学方程式
:__________________________
。
图
14-15
2NaOH+H
2
SO
4
Na
2
SO
4
+2H
2
O
12.
拓展
[2019
·
宿迁改编
]
根据氢氧化钠溶液和稀硫酸反应的微观示意图回答问题。
(2)
从微观的角度分析
,
上述反应的实质是
。
图
14-15
[
答案
]
(2)H
+
+OH
-
H
2
O
[
解析
]
(2)
比较反应前后的微观示意图可以发现
,
溶液中钠离子和硫酸根离子在反应前后没有改变
,
而
H
+
和
OH
-
转化为
H
2
O
。
12.
拓展
[2019
·
宿迁改编
]
根据氢氧化钠溶液和稀硫酸反应的微观示意图回答问题。
(3)
恰好完全中和时
,Na
+
与
S
的个数比为
。
图
14-15
2
:
1
相关文档
- 徐州专版2020中考化学复习方案第72021-11-118页
- 徐州专版2020中考化学复习方案第72021-11-116页
- 徐州专版2020中考化学复习方案第72021-11-1061页
- 徐州专版2020中考化学复习方案第72021-11-067页
- 徐州专版2020中考化学复习方案第72021-11-065页
- 徐州专版2020中考化学复习方案第72021-11-067页
- 徐州专版2020中考化学复习方案第72021-11-068页
- 徐州专版2020中考化学复习方案第72021-11-068页
- 徐州专版2020中考化学复习方案第72021-11-068页
- 中考化学模拟题专练应用广泛的酸碱2021-05-1032页