- 54.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2011年中考化学总复习教学案
知识·巧学·升华
一、质量守恒定律
1.质量守恒定律
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。这个规律叫做质量守恒定律。一切化学反应都遵循质量守恒定律。
【实验探究】
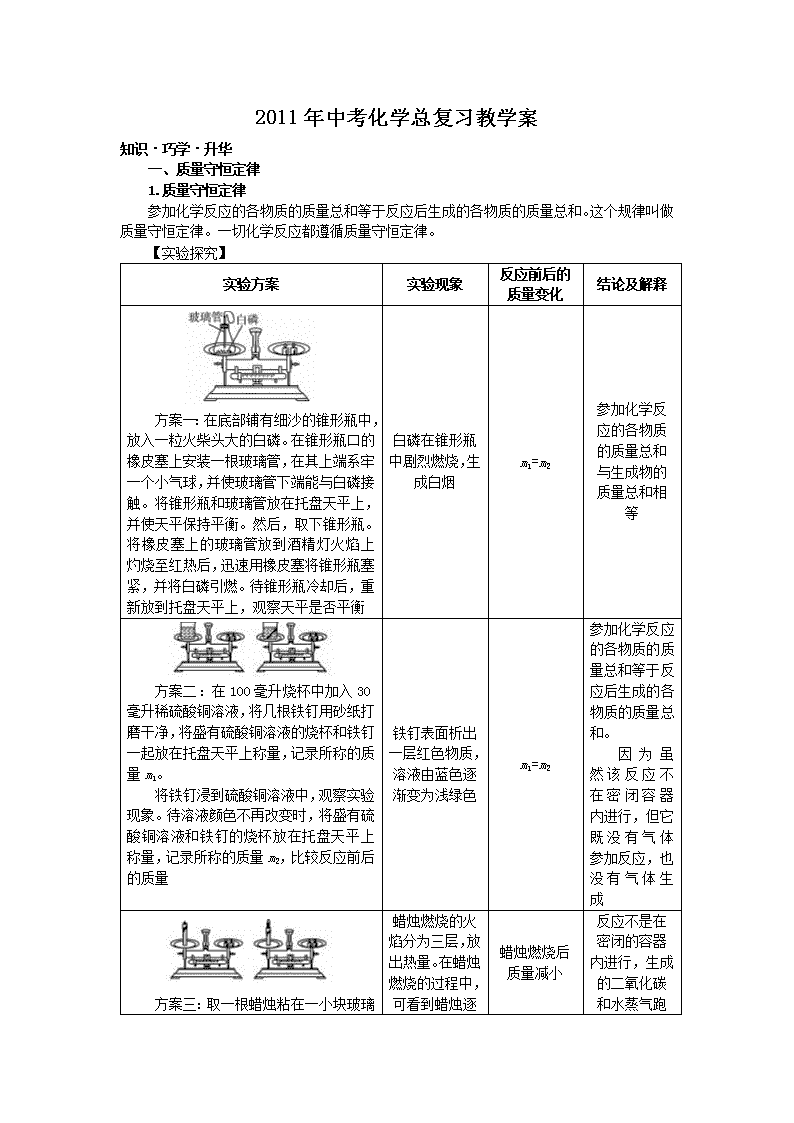
实验方案
实验现象
反应前后的质量变化
结论及解释
方案一:在底部铺有细沙的锥形瓶中,放入一粒火柴头大的白磷。在锥形瓶口的橡皮塞上安装一根玻璃管,在其上端系牢一个小气球,并使玻璃管下端能与白磷接触。将锥形瓶和玻璃管放在托盘天平上,并使天平保持平衡。然后,取下锥形瓶。将橡皮塞上的玻璃管放到酒精灯火焰上灼烧至红热后,迅速用橡皮塞将锥形瓶塞紧,并将白磷引燃。待锥形瓶冷却后,重新放到托盘天平上,观察天平是否平衡
白磷在锥形瓶中剧烈燃烧,生成白烟
m1=m2
参加化学反应的各物质的质量总和与生成物的质量总和相等
方案二:在100毫升烧杯中加入30毫升稀硫酸铜溶液,将几根铁钉用砂纸打磨干净,将盛有硫酸铜溶液的烧杯和铁钉一起放在托盘天平上称量,记录所称的质量m1。
将铁钉浸到硫酸铜溶液中,观察实验现象。待溶液颜色不再改变时,将盛有硫酸铜溶液和铁钉的烧杯放在托盘天平上称量,记录所称的质量m2,比较反应前后的质量
铁钉表面析出一层红色物质,溶液由蓝色逐渐变为浅绿色
m1=m2
参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
因为虽然该反应不在密闭容器内进行,但它既没有气体参加反应,也没有气体生成
蜡烛燃烧后质量减小
方案三:取一根蜡烛粘在一小块玻璃片上,将玻璃片和蜡烛一起放在托盘天平上,调节天平平衡,点燃蜡烛,观察天平的平衡情况
蜡烛燃烧的火焰分为三层,放出热量。在蜡烛燃烧的过程中,可看到蜡烛逐渐变短,天平不再平衡,指针向右偏转
反应不是在密闭的容器内进行,生成的二氧化碳和水蒸气跑到空气中去了,因而天平不平衡
方法点拨
对质量守恒定律的实验探究,重点是会设计实验方案、描述实验现象,能够根据实验现象得到正确的结论。
2.质量守恒的原因(微观解释)
因为化学反应的过程,就是参加反应的各物质(反应物)的原子,重新组合而生成其他物质(生成物)的过程。也就是说,在化学反应中,反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也没有改变。所以,反应前后各物质的质量总和相等。
要点提示
①该定律只适用于化学变化,如果不是化学变化,则不适合该定律。如5克水在加热的条件下变成5克水蒸气符合质量守恒定律,这句话是不对的。因为水变成水蒸气是物理变化。
②质量守恒定律一定是指参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。即不能将没有参加反应的质量和反应后剩余的质量计算在内。
③要注意是“各物质”的质量总和,不能遗漏任一反应物或生成物,尤其是气体。
④反应前后,元素种类不变,同种元素质量相等。
⑤反应前后,原子种类不变,原子质量也不变。
⑥反应前后,分子种类一定改变,分子数目不一定改变。
二、化学方程式
1.定义
用化学式来表示化学反应的式子叫做化学方程式。
CuO+H2Cu+H2O
CuO+MgCu+MgO
要点提示
通过化学方程式,能够看出反应物和生成物,以及反应条件,还能体现反应物和生成物各物质间的质量关系,以及发生反应的物质间的粒子个数比,也符合质量守恒定律。
2.化学方程式提供的信息
(1)哪些物质参加了反应(反应物)。
(2)生成了哪些物质(生成物)。
(3)反应条件。
(4)反应物与生成物之间的质量比。
(5)反应物与生成物之间的粒子数量比。
(6)反应前后质量守恒等等。
3.化学方程式表示的意义
意义
实例
C+O2CO2
表示反应物、生成物以及反应条件。
反应物是碳和氧气,生成物是二氧化碳,反应条件是点燃。
表示反应物、生成物各物质之间的质量关系,即质量比。
C + O2CO2
12∶16×2 ∶ 44
12∶ 32 ∶ 44
3 ∶ 8 ∶ 11
表示反应物、生成物之间的粒子数关系(粒子个数比)。
C+O2CO2
1∶1 ∶ 1
4.化学方程式的读法。以C+O2CO2为例。
化学方程式的读法从宏观和微观两个方面来读。宏观又从质和量两个方面来读,微观从粒子的个数来读。以C+O2=CO2为例。
①质的方面:碳和氧气在点燃的条件下生成二氧化碳。
②量的方面:每12份质量的碳和32份质量的氧气,在点燃的条件下完全反应,生成44份质量的二氧化碳。
③粒子方面:一个碳原子和一个氧分子在点燃的条件下完全反应生成一个二氧化碳分子。
问题·思路·探究
问题1在实际操作过程中,常常遇到反应物的质量和生成物的质量不相等的情况,于是有的同学认为部分化学反应不遵循质量守恒定律,对吗?
思路:解决这一疑点,必须全面理解质量守恒定律。有这样两点值得注意:
(1)找全生成物:很多化学反应有气体生成,定律中“生成的各物质的质量总和”包括气体,不能因为生成了气体而误认为质量减少,不符合质量守恒定律。
(2)找全反应物:有些反应有气体参与,定律中“参加化学反应的各物质的质量总和”包括气体的质量,忘记的话,往往会误认为反应后物质的质量增加了。
注意到这两点,就很容易解释实验中遇到的反应物的质量和生成物的质量不相等的情况了。
探究:不对,所有的化学反应都遵循质量守恒定律。
典题·热题·新题
例1下列对质量守恒定律的理解正确的是 ( )
A.根据质量守恒定律可知10 g碳和10 g氧气完全反应生成20 g二氧化碳
B.铝条燃烧后增加的质量等于参加反应的氧气的质量
C.10 g高锰酸钾完全分解所得各生成物的质量总和一定是10 g
D.蒸发液态空气所得各气体的质量总和等于液态空气的质量,这有力地证实了质量守恒定律
思路解析:A选项是对“参加反应”四字理解不透,10 g碳与10 g氧气反应时,碳并没有全部参加反应,而是仅有一部分反应,还有一些未反应,因而生成的二氧化碳的质量应小于20 g。B选项中铝条燃烧是铝和空气中的氧气反应生成氧化铝,根据质量守恒定律,铝条燃烧后增加的质量一定等于参加反应的氧气的质量,故B选项正确。C选项中高锰酸钾完全分解生成三种物质,是分解反应,因此,10 g高锰酸钾完全分解所得各生成物的质量总和一定是10 g,故C选项正确。D选项是物理变化,而质量守恒定律适用于化学变化。
答案:BC
深化升华
质量守恒定律是指参加反应的各物质的质量总和与反应后生成的各物质的质量总和相等。理解概念时要注意“参加反应”“之和”等关键字词。
例2某物质在空气中完全燃烧只生成二氧化碳和水,则该物质中 ( )
A.只含有碳元素
B.只含有碳、氢元素
C.一定含有碳、氢、氧三种元素
D.一定含有碳、氢元素,可能含有氧元素
思路解析:由题给信息该反应可表示为:某物质+氧气二氧化碳+水,根据化学反应前后元素的种类不变,生成物中含有碳、氢、氧三种元素,则反应物中也必定含有碳、氢、氧三种元素,又因为反应物中已经有氧气,所以,该物质中一定含有碳、氢两种元素,可能含有氧元素。
答案:D
深化升华
本题一方面要注意质量守恒,同时还要考虑反应物中有氧参加,所以该物质中可能含有氧元素,也可能不含有氧元素。
例3对化学方程式2CO+O22CO2的读法或叙述正确的是 ( )
A.一氧化碳加氧气点燃等于二氧化碳
B.一氧化碳与氧气在点燃条件下生成二氧化碳
C.反应中CO、O2、CO2的质量比为28∶32∶44
D.2个一氧化碳分子加1个氧分子等于2个二氧化碳分子
思路解析:表述化学方程式时,两物质间的“+”读成“和”或“与”而不是数学符号中的加号,“”表示生成的意思。故A、D选项错误。化学方程式反映物质间质量比是建立在质量守恒定律基础上的,必须是物质相对分子质量与前面化学计量数乘积之比,CO、O2、CO2的质量比应为56∶32∶88。
答案:B
深化升华
化学方程式表示的意义及其读法是化学的最基本内容,化学的特点就是用符号来表达一定的含义。通过一个化学方程式我们可以获得很多信息,如反应物之间的分子个数比,各种反应物以及生成物的质量比等。
例4 已知反应:2A+5O24CO2+2H2O,则A的化学式为 ( )
A.C2H4 B.C4H4 C.C2H2 D.C4H2O
思路解析:在化学反应前后,原子的种类、数目没有发生变化。
2A+5O24CO2+2H2O
由上式可以看出,反应后一共含有4个碳原子、4个氢原子和10个氧原子,反应前已经含有10个氧原子,所以2A中一定含有4个碳原子、4个氢原子。因此A中一定含有2个碳原子、2个氢原子,故A的分子式为C2H2。
答案:C
深化升华
此题实际是质量守恒定律的应用,根据方程式左边所含原子总数与方程式右边所含原子总数相等,即可解得。