- 199.50 KB
- 2021-05-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
一.选择题(共3小题)
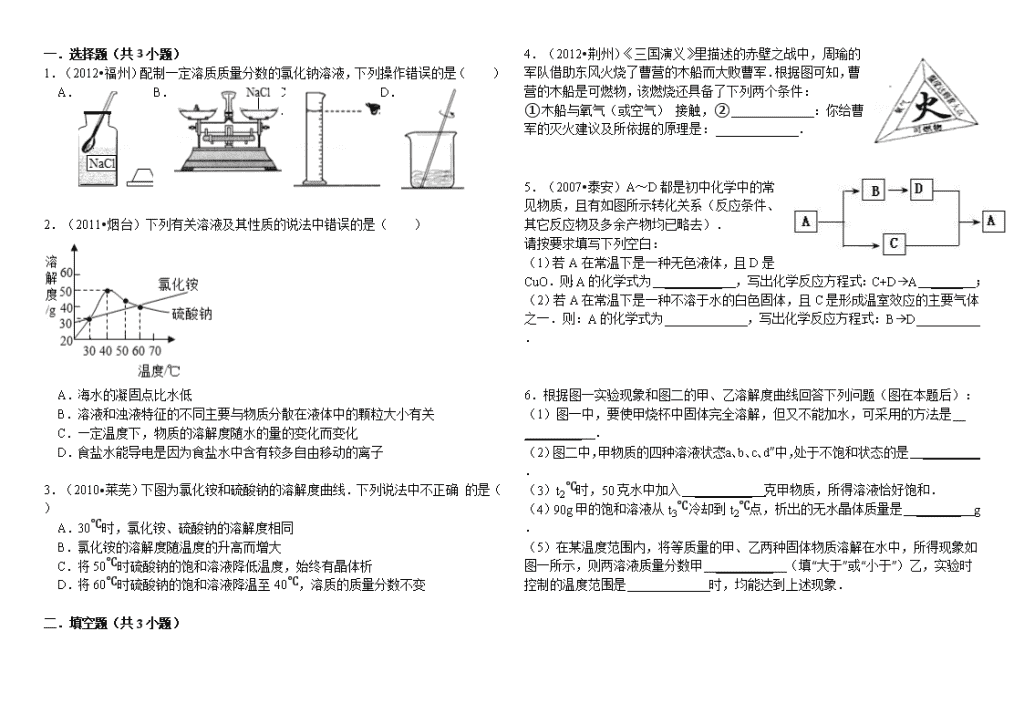
1.(2012•福州)配制一定溶质质量分数的氯化钠溶液,下列操作错误的是( )
A.
B.
C.
D.
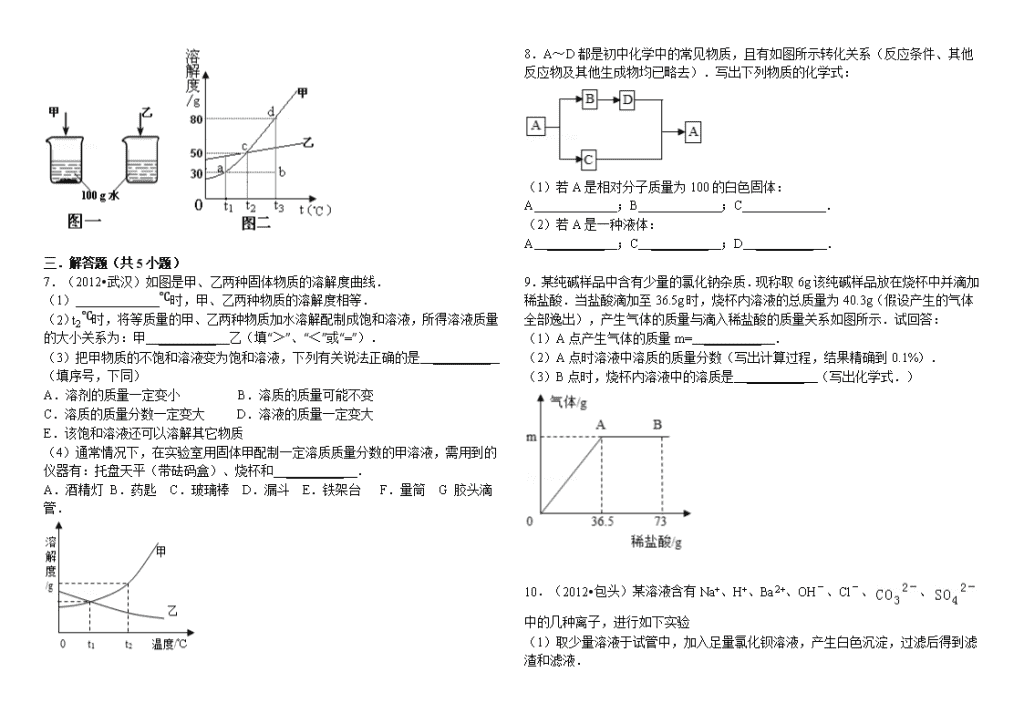
2.(2011•烟台)下列有关溶液及其性质的说法中错误的是( )
A.
海水的凝固点比水低
B.
溶液和浊液特征的不同主要与物质分散在液体中的颗粒大小有关
C.
一定温度下,物质的溶解度随水的量的变化而变化
D.
食盐水能导电是因为食盐水中含有较多自由移动的离子
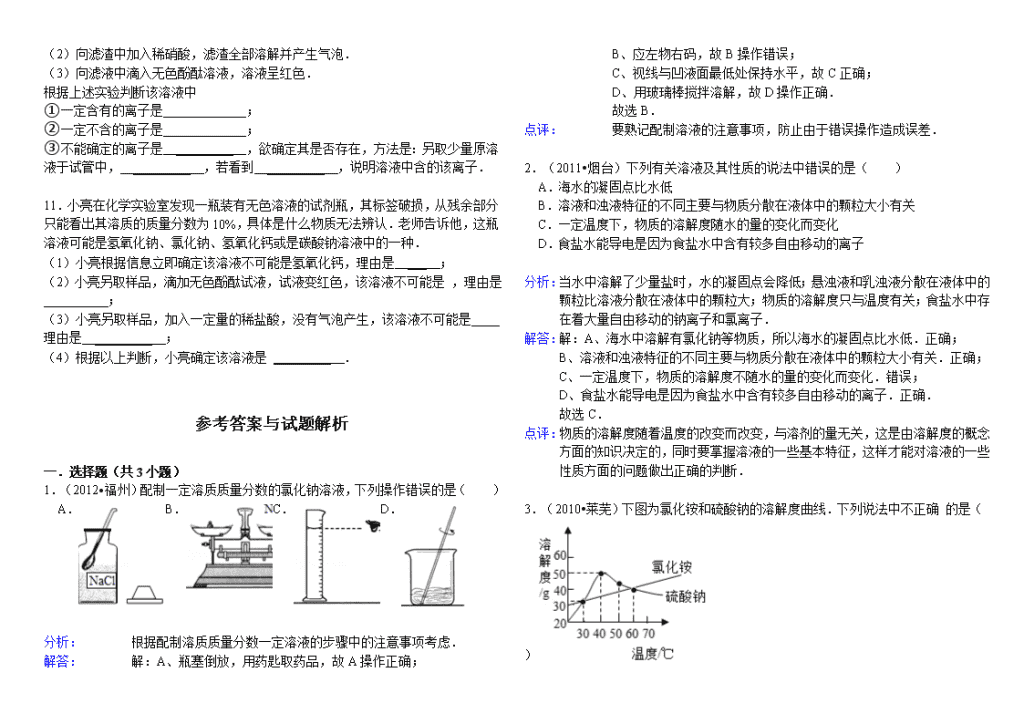
3.(2010•莱芜)下图为氯化铵和硫酸钠的溶解度曲线.下列说法中不正确 的是( )
A.
30℃时,氯化铵、硫酸钠的溶解度相同
B.
氯化铵的溶解度随温度的升高而增大
C.
将50℃时硫酸钠的饱和溶液降低温度,始终有晶体析
D.
将60℃时硫酸钠的饱和溶液降温至40℃,溶质的质量分数不变
二.填空题(共3小题)
4.(2012•荆州)《三国演义》里描述的赤壁之战中,周瑜的军队借助东风火烧了曹营的木船而大败曹军.根据图可知,曹营的木船是可燃物,该燃烧还具备了下列两个条件:
①木船与氧气(或空气) 接触,② _________ :你给曹军的灭火建议及所依据的原理是: _________ .
5.(2007•泰安)A~D都是初中化学中的常见物质,且有如图所示转化关系(反应条件、其它反应物及多余产物均已略去).
请按要求填写下列空白:
(1)若A在常温下是一种无色液体,且D是CuO.则:A的化学式为 _________ ,写出化学反应方程式:C+D→A _____ ;
(2)若A在常温下是一种不溶于水的白色固体,且C是形成温室效应的主要气体之一.则:A的化学式为 _________ ,写出化学反应方程式:B→D ________ .
6.根据图一实验现象和图二的甲、乙溶解度曲线回答下列问题(图在本题后):
(1)图一中,要使甲烧杯中固体完全溶解,但又不能加水,可采用的方法是 _________ .
(2)图二中,甲物质的四种溶液状态“a、b、c、d”中,处于不饱和状态的是 _________ .
(3)t2℃时,50克水中加入 _________ 克甲物质,所得溶液恰好饱和.
(4)90g甲的饱和溶液从t3℃冷却到t2℃点,析出的无水晶体质量是 _______ g.
(5)在某温度范围内,将等质量的甲、乙两种固体物质溶解在水中,所得现象如图一所示,则两溶液质量分数甲 _________ (填“大于”或“小于”)乙,实验时控制的温度范围是 _________ 时,均能达到上述现象.
三.解答题(共5小题)
7.(2012•武汉)如图是甲、乙两种固体物质的溶解度曲线.
(1) _________ ℃时,甲、乙两种物质的溶解度相等.
(2)t2℃时,将等质量的甲、乙两种物质加水溶解配制成饱和溶液,所得溶液质量的大小关系为:甲 _________ 乙(填“>”、“<”或“=”).
(3)把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是 _________ (填序号,下同)
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量一定变大
E.该饱和溶液还可以溶解其它物质
(4)通常情况下,在实验室用固体甲配制一定溶质质量分数的甲溶液,需用到的仪器有:托盘天平(带砝码盒)、烧杯和 _________ .
A.酒精灯 B.药匙 C.玻璃棒 D.漏斗 E.铁架台 F.量筒 G 胶头滴管.
8.A~D都是初中化学中的常见物质,且有如图所示转化关系(反应条件、其他反应物及其他生成物均已略去).写出下列物质的化学式:
(1)若A是相对分子质量为100的白色固体:
A _________ ;B _________ ;C _________ .
(2)若A是一种液体:
A _________ ;C _________ ;D _________ .
9.某纯碱样品中含有少量的氯化钠杂质.现称取6g该纯碱样品放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试回答:
(1)A点产生气体的质量m= _________ .
(2)A点时溶液中溶质的质量分数(写出计算过程,结果精确到0.1%).
(3)B点时,烧杯内溶液中的溶质是 _________ (写出化学式.)
10.(2012•包头)某溶液含有Na+、H+、Ba2+、OH﹣、Cl﹣、、中的几种离子,进行如下实验
(1)取少量溶液于试管中,加入足量氯化钡溶液,产生白色沉淀,过滤后得到滤渣和滤液.
(2)向滤渣中加入稀硝酸,滤渣全部溶解并产生气泡.
(3)向滤液中滴入无色酚酞溶液,溶液呈红色.
根据上述实验判断该溶液中
①一定含有的离子是 _________ ;
②一定不含的离子是 _________ ;
③不能确定的离子是 _________ ,欲确定其是否存在,方法是:另取少量原溶液于试管中, _________ ,若看到 _________ ,说明溶液中含的该离子.
11.小亮在化学实验室发现一瓶装有无色溶液的试剂瓶,其标签破损,从残余部分只能看出其溶质的质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠溶液中的一种.
(1)小亮根据信息立即确定该溶液不可能是氢氧化钙,理由是 ___ ;
(2)小亮另取样品,滴加无色酚酞试液,试液变红色,该溶液不可能是 ,理由是________ ;
(3)小亮另取样品,加入一定量的稀盐酸,没有气泡产生,该溶液不可能是___ 理由是 _________ ;
(4)根据以上判断,小亮确定该溶液是 _________ .
参考答案与试题解析
一.选择题(共3小题)
1.(2012•福州)配制一定溶质质量分数的氯化钠溶液,下列操作错误的是( )
A.
B.
C.
D.
分析:
根据配制溶质质量分数一定溶液的步骤中的注意事项考虑.
解答:
解:A、瓶塞倒放,用药匙取药品,故A操作正确;
B、应左物右码,故B操作错误;
C、视线与凹液面最低处保持水平,故C正确;
D、用玻璃棒搅拌溶解,故D操作正确.
故选B.
点评:
要熟记配制溶液的注意事项,防止由于错误操作造成误差.
2.(2011•烟台)下列有关溶液及其性质的说法中错误的是( )
A.
海水的凝固点比水低
B.
溶液和浊液特征的不同主要与物质分散在液体中的颗粒大小有关
C.
一定温度下,物质的溶解度随水的量的变化而变化
D.
食盐水能导电是因为食盐水中含有较多自由移动的离子
分析:
当水中溶解了少量盐时,水的凝固点会降低;悬浊液和乳浊液分散在液体中的颗粒比溶液分散在液体中的颗粒大;物质的溶解度只与温度有关;食盐水中存在着大量自由移动的钠离子和氯离子.
解答:
解:A、海水中溶解有氯化钠等物质,所以海水的凝固点比水低.正确;
B、溶液和浊液特征的不同主要与物质分散在液体中的颗粒大小有关.正确;
C、一定温度下,物质的溶解度不随水的量的变化而变化.错误;
D、食盐水能导电是因为食盐水中含有较多自由移动的离子.正确.
故选C.
点评:
物质的溶解度随着温度的改变而改变,与溶剂的量无关,这是由溶解度的概念方面的知识决定的,同时要掌握溶液的一些基本特征,这样才能对溶液的一些性质方面的问题做出正确的判断.
3.(2010•莱芜)下图为氯化铵和硫酸钠的溶解度曲线.下列说法中不正确 的是( )
A.
30℃时,氯化铵、硫酸钠的溶解度相同
B.
氯化铵的溶解度随温度的升高而增大
C.
将50℃时硫酸钠的饱和溶液降低温度,始终有晶体析
D.
将60℃时硫酸钠的饱和溶液降温至40℃,溶质的质量分数不变
分析:
由溶解度曲线图可知,不同物质在同一温度下的溶解度的大小关系.也可知,同一物质在不同温度下的溶解度的大小关系.溶解度曲线的相交点表示在此温度下两物质的溶解度相等.
解答:
解:A、由溶解度曲线图可知:30℃时氯化铵、硫酸钠的溶解度相同.
B、氯化铵的溶解度随温度的升高而增大.
C、将50℃时降温至40℃时,硫酸钠的溶解度随着温度的降低而增大,没有晶体析出.该选项说法不正确.
D、硫酸钠的溶解度随温度的降温而增大,因此将60℃时硫酸钠的饱和溶液降温至40℃,硫酸钠的饱和溶液会变成不饱和溶液,溶质的质量分数不变.
故选C.
点评:
主要考查了对固体溶解度的概念的理解和固体溶解度曲线的意义,以此培养学生的理解能力、培养学生分析问题、解决问题的能力.
二.填空题(共3小题)
4.(2012•荆州)《三国演义》里描述的赤壁之战中,周瑜的军队借助东风火烧了曹营的木船而大败曹军.根据图可知,曹营的木船是可燃物,该燃烧还具备了下列两个条件:
①木船与氧气(或空气) 接触,② 温度达到着火点 :你给曹军的灭火建议及所依据的原理是: 将燃烧的木船与其它船隔离,清除可燃物 .
分析:
根据燃烧的条件及灭火原理进行分析解答本题.
解答:
解:根据燃烧的条件:燃烧需要同时满足三个条件①可燃物②氧气或空气③达到燃烧所需的最低温度即着火点,可知曹军的木船是可燃物,木船燃烧的条件是温度达到着火点,与氧气接触;要灭火只需破坏燃烧三个条件中的一个即可,因此可将燃烧的木船与其它船隔离,清除可燃物,即可达到灭火的目的.
故答案为:温度达到着火点:将燃烧的木船与其它船隔离,清除可燃物
点评:
本题考查学生根据燃烧的条件及灭火原理进行分析解题的能力,并将知识灵活应用
5.(2007•泰安)A~D都是初中化学中的常见物质,且有如图所示转化关系(反应条件、其它反应物及多余产物均已略去).
请按要求填写下列空白:
(1)若A在常温下是一种无色液体,且D是CuO.则:A的化学式为 H2O ,写出化学反应方程式:C+D→A H2+CuOCu+H2O ;
(2)若A在常温下是一种不溶于水的白色固体,且C是形成温室效应的主要气体之一.则:A的化学式为 CaCO3,写出化学反应方程式:B→D CaO+H2O=Ca(OH)2.
分析:
(1)由题意可知:A在常温下是一种无色液体,分解的产物能与CuO反应,又生成A,可以想到:水在常温下是液态的,水分解生成的氢气与氧化铜反应又生成水,可以推出A是水.
(2)由C是形成温室效应的主要气体之一,可以推出C是二氧化碳;再由A在常温下是一种不溶于水的白色固体,能分解生成二氧化碳,可以推出A是CaCO3.
:(1)阅读文字结合图框中物质之间的转换关系可知:A在常温下是一种无色液体,分解的产物能与CuO反应,又生成A,可以推出A是水;
(2)分析文意和图意可知:C是形成温室效应的主要气体之一,可以推出C是二氧化碳;再由A在常温下是一种不溶于水的白色固体,能分解生成二氧化碳,可以推出A是CaCO3;
推断出了物质,就可以写出有关化学式和化学方程式:H2+CuOCu+H2O,CaO+H2O=Ca(OH)2.
故答为:(1)H2O,H2+CuOCu+H2O
(2)CaCO3,CaO+H2O=Ca(OH)2.
本题属于图框题推断题、框图推断题的特点:有的题目条件隐蔽难以找全,有的题目文图较多、关系复杂难以捋顺,有的题目已知信息较少无从下手等,在解答框图推断题时,可按下列的解题步骤进行解题:1、审题,认真审读题目,弄清题意和图意.2、分析,找准解题的突破口,从突破口出发,探求知识间的内在联系.3、解答,依照题目的要求,按照分析和推理的结果,认真而全面地解答.4、检验,得出结论后切勿忘记验证.
6.根据图一实验现象和图二的甲、乙溶解度曲线回答下列问题(图在本题后):
(1)图一中,要使甲烧杯中固体完全溶解,但又不能加水,可采用的方法是 升温 .
(2)图二中,甲物质的四种溶液状态“a、b、c、d”中,处于不饱和状态的是 b .
(3)t2℃时,50克水中加入 25 克甲物质,所得溶液恰好饱和.
(4)90g甲的饱和溶液从t3℃冷却到t2℃点,析出的无水晶体质量是 15 g.
(5)在某温度范围内,将等质量的甲、乙两种固体物质溶解在水中,所得现象如图一所示,则两溶液质量分数甲 小于 (填“大于”或“小于”)乙,实验时控制的温度范围是 0℃﹣﹣﹣t2℃ 时,均能达到上述现象.
考点:
固体溶解度曲线及其作用.
专题:
溶液、浊液与溶解度.
分析:
(1)甲的溶解度随温度的升高而增大,要使其饱和溶液中溶质溶解可以采用升温的方法;
(2)溶解度曲线上的点表示该溶液处于饱和状态,溶解度曲线下的点是不饱和状态;
(3)根据t2℃时甲物质的溶解度是50g,及溶解度的概念分析回答;
(4)运用t3℃时甲的溶解度为80g,计算出该温度下90g甲的饱和溶液中溶质和溶剂水的质量,然后求出t2℃这些水要达到饱和状态所溶解的溶质的质量解答;
(5)由题意分析可知:该温度范围内,甲的溶解度小于乙,然后结合图二甲乙两种物质溶解度溶解度曲线图分析解答.
解答:
解:(1)甲的溶解度随温度的升高而增大,因此要使烧杯中固体完全溶解,但又不能加水,可以采用升温的方法;
故答案为:升温;
(2)溶解度曲线上的点表示该溶液处于饱和状态,溶解度曲线下的点表示该溶液处于不饱和状态;
故答案为:b.
(3)t2℃时甲物质的溶解度是50g,溶解度是指该温度下100g水最多溶解的溶质的质量,所以t2℃时,50克水中加入25g甲物质所得溶液恰好饱和;
故答案为:25;
(4)因为t3℃时A的溶解度为80g,所以设t3℃时,A物质的饱和溶液90g中溶质的质量为x,则有=,解得x=40g,水的质量为50g;t2℃时A物质的溶解度为50g,所以50g水中溶解的溶质为25g,故可析出晶体的质量为:40g﹣25g=15g;
故答案为:15;
(5)由题意可知:将等质量的甲、乙两种固体物质溶解在水中,图一烧杯中甲有剩余乙全溶,可知溶解的甲的质量小于乙的质量,说明该温度范围内,甲的溶解度小于乙;图二中甲乙两种物质溶解度在温度高于t2℃时,甲的溶解度大于乙的溶解度,饱和溶液溶质质量分数甲大于乙;温度低于t2℃时甲的溶解度小于乙的溶解度,饱和溶液溶质质量分数甲小于乙,符合题意;
故答案为:小于; 0℃﹣﹣﹣t2℃
点评:
本题较好的考查了对溶解度概念的理解和溶解度曲线意义的理解及应用,只有掌握相关知识才能正确分析解答.
三.解答题(共5小题)
7.(2012•武汉)如图是甲、乙两种固体物质的溶解度曲线.
(1) t1℃时,甲、乙两种物质的溶解度相等.
(2)t2℃时,将等质量的甲、乙两种物质加水溶解配制成饱和溶液,所得溶液质量的大小关系为:甲 < 乙(填“>”、“<”或“=”).
(3)把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是 BE (填序号,下同)
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量一定变大
E.该饱和溶液还可以溶解其它物质
(4)通常情况下,在实验室用固体甲配制一定溶质质量分数的甲溶液,需用到的仪器有:托盘天平(带砝码盒)、烧杯和 BCFG .
A.酒精灯 B.药匙 C.玻璃棒 D.漏斗 E.铁架台 F.量筒 G 胶头滴管.
考点:
固体溶解度曲线及其作用;一定溶质质量分数的溶液的配制;饱和溶液和不饱和溶液相互转变的方法;溶质的质量分数、溶解性和溶解度的关系.
专题:
溶液、浊液与溶解度.
分析:
(1)根据曲线中交点的含义考虑;(2)根据t2℃时,甲、乙两种物质的溶解度考虑;(3)根据甲物质的不饱和溶液变为饱和溶液的方法考虑;(4)根据配制溶液需要的仪器考虑.
解答:
解:(1)曲线中交点表示该温度时两种物质的溶解度相等,所以t1℃时,甲、乙两种物质的溶解度相等;
(2)t2℃时,甲的溶解度大于乙物质的溶解度,即相同质量水中甲溶解的多,所以想溶解相同质量的甲和乙,乙需要的水多,甲需要的水少,所以甲的溶液质量少;
(3)A、把甲物质的不饱和溶液变为饱和溶液可以用加入溶质,此时溶剂质量不变,故A错;
B、把甲物质的不饱和溶液变为饱和溶液可以用蒸发溶剂的方法,此时溶质质量不变,故B正确;
C、如果用降低温度的方法,刚好饱和时溶质质量分数是不变的,故C错;
D、如果用降低温度的方法,刚好饱和时,溶液质量不变,故D错;
E、甲的饱和溶液只是对于甲来说是饱和的,对于其他物质是不饱和的,可以再溶解其他物质,故E正确;
(4)配制溶液需要用到的仪器有:烧杯、玻璃棒、量筒、胶头滴管、天平、药匙.
故答案为:(1)t1;(2)<;(3)BE;(4)BCFG.
点评:
解答本题关键是要知道溶解度曲线表示的意义,知道了溶解度如何比较大小,饱和溶液与不饱和溶液的相互转化,配制溶液需要的仪器.
8.A~D都是初中化学中的常见物质,且有如图所示转化关系(反应条件、其他反应物及其他生成物均已略去).写出下列物质的化学式:
(1)若A是相对分子质量为100的白色固体:
A CaCO3;B CaO ;C CO2.
(2)若A是一种液体:
A H2O ;C H2;D CuO .
考点:
物质的鉴别、推断;化学式的书写及意义.
专题:
常见物质的推断题.
分析:
回想初中的分解反应:实验室用双氧水制氧气,加热高锰酸钾,水在直流电的作用下分解,碳酸不稳定而分解,高温煅烧石灰石;代入验证,发现:水电解和煅烧石灰石合适;
(1)若A是相对分子质量为100的白色固体,则:A、碳酸钙,B、氧化钙,C、二氧化碳,D氢氧化钙,把这个结论代入原题,进行验证即可;
(2)若A是一种液体,则A、H2O,B、O2,C、H2,D、CuO,把这个结论代入原题,进行验证即可.
解答:
解:已知“A~D都是初中化学中的常见物质”
(1)若A是相对分子质量为100的白色固体,假定A为碳酸钙,碳酸钙高温分解成氧化钙和二氧化碳,氧化钙和水反应生成氢氧化钙,氢氧化钙和二氧化碳反应生成碳酸钙,则A、碳酸钙B、氧化钙,C、二氧化碳,D氢氧化钙,把这个结论代入原题,进行验证,正好符合;
(2)若A是一种液体,假定A为水,水电解生成氢气和氧气,氧气和铜反应生成氧化铜,氢气还原氧化铜生成铜和水,则A、H2O,B、O2,C、H2,D、CuO,把这个结论代入原题,进行验证,正好符合;
故答案为:
(1)CaCO3,CaO,CO2;
(2)H2O,H2,CuO.
点评:
本题主要考查了化学式的书写及意义,掌握物质的鉴别方法及技巧,掌握化合反应和分解反应的特点及应用.
9.某纯碱样品中含有少量的氯化钠杂质.现称取6g该纯碱样品放在烧杯中并滴加稀盐酸.当盐酸滴加至36.5g时,烧杯内溶液的总质量为40.3g(假设产生的气体全部逸出),产生气体的质量与滴入稀盐酸的质量关系如图所示.试回答:
(1)A点产生气体的质量m= 2.2g .
(2)A点时溶液中溶质的质量分数(写出计算过程,结果精确到0.1%).
(3)B点时,烧杯内溶液中的溶质是 NaCl、HCl (写出化学式.)
考点:
根据化学反应方程式的计算;有关溶质质量分数的简单计算.
专题:
综合计算(图像型、表格型、情景型计算题).
分析:
(1)产生气体的质量为反应前物质的总质量与反应后烧杯内物质质量之差.
(2)可根据求出的二氧化碳的质量,利用碳酸钠和盐酸反应的化学方程式求出生成的氯化钠的质量,反应后所得溶液中的溶质有原样品中的氯化钠和生成的氯化钠,进而求出溶质的质量分数.
(3)分析图可看出A点后再加入盐酸后没有发生新的反应.
解答:
解:(1)根据质量守恒定律可知,产生气体的质量为反应前物质的总质量与反应后烧杯内物质质量之差.则m=(6g+36.5g)﹣40.3g=2.2g.
故答案为:2.2g
(2)设样品中含纯碱质量为x,反应生成氯化钠质量为y.
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 117 44
x y 2.2g
解之得:x=5.3g;y=5.85g
反应后溶液中溶质氯化钠的质量为(6﹣5.3+5.85)=6.55g
所以氯化钠的质量分数=×100%=16.3%
答:A点时溶液中溶质的质量分数为16.3%.
(3)由图可看出A点后再加入盐酸,已没有反应发生,所以B点时溶液中的溶质有前一阶段生成的氯化钠及A点后加入的盐酸.
故答案为:NaCl、HCl
点评:
解答本题有个关键学生必须清楚,就是审题,第二问求所得溶液中的溶质的质量分数,溶质是什么?它有两个来源.
10.(2012•包头)某溶液含有Na+、H+、Ba2+、OH﹣、Cl﹣、、中的几种离子,进行如下实验
(1)取少量溶液于试管中,加入足量氯化钡溶液,产生白色沉淀,过滤后得到滤渣和滤液.
(2)向滤渣中加入稀硝酸,滤渣全部溶解并产生气泡.
(3)向滤液中滴入无色酚酞溶液,溶液呈红色.
根据上述实验判断该溶液中
①一定含有的离子是 CO32﹣、OH﹣、Na+;
②一定不含的离子是 SO42﹣、Ba2+、H+;
③不能确定的离子是 Cl﹣,欲确定其是否存在,方法是:另取少量原溶液于试管中, 加入适量硝酸银溶液和稀硝酸 ,若看到 有白色沉淀产生 ,说明溶液中含的该离子.
考点:
常见离子的检验方法及现象.
专题:
物质的检验、鉴别与推断.
分析:
根据题干提供的信息结合物质的性质进行分析,能够和氯化钡反应生成白色沉淀的有CO32﹣和SO42﹣,钡离子能与SO42﹣结合产生不溶于水和稀硝酸的沉淀,根据(2)中滤渣全部溶解可以知道该沉淀为碳酸钡沉淀,而(1)所得的滤液能够使酚酞溶液变红,说明该溶液为碱性,所以可以判断该溶液中含有OH﹣;可以据此进行分析并完成解答.
解答:
解:根据题干提供的信息结合物质的性质可以知道,能够和氯化钡反应生成白色沉淀的有CO32﹣和SO42﹣,钡离子能与SO42﹣结合产生不溶于水和稀硝酸的沉淀,根据(2)中滤渣全部溶解可以知道该沉淀为碳酸钡沉淀,从而可以判断一定不含SO42﹣;而(1)所得的滤液能够使酚酞溶液变红,说明该溶液为碱性,所以可以判断该溶液中含有OH﹣;所以可以判断在溶液中一定含有的离子为:CO32﹣和OH﹣;一定不含SO42﹣;由于CO32﹣能够Ba2+和生成沉淀,所以一定不含Ba2+,而OH﹣和H+能够反应生成水,所以一定不含H+;根据溶液中电荷守恒可以判断在溶液中一定含有的阳离子为Na+;而氯离子在实验中没有涉及到,所以不能判断是否含有Cl﹣,由于Cl﹣能够和银离子反应生成沉淀,且生成的氯化银沉淀难溶于稀硝酸,所以可以用稀硝酸和硝酸银来进行检验.
故答案:①CO32﹣、OH﹣、Na+;
②SO42﹣、Ba2+、H+;
③Cl﹣;加入适量硝酸银溶液和稀硝酸;有白色沉淀产生.
点评:
本考点考查的是物质的鉴别,要根据题目给出的信息,由现象得出正确的结论.鉴别题是初中阶段的一个重点,可以根据不同的性质来鉴别,因此掌握好常见物质和酸碱盐的性质,问题就会迎刃而解.
11.小亮在化学实验室发现一瓶装有无色溶液的试剂瓶,其标签破损,从残余部分只能看出其溶质的质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化钠、氯化钠、氢氧化钙或是碳酸钠溶液中的一种.
(1)小亮根据信息立即确定该溶液不可能是氢氧化钙,理由是
氢氧化钙微溶于水,其溶质的质量分数不可能为10% ;
(2)小亮另取样品,滴加无色酚酞试液,试液变红色,该溶液不可能是
氯化钠 ,理由是
只有氯化钠溶液显中性,它不能使酚酞变红色 ;
(3)小亮另取样品,加入一定量的稀盐酸,没有气泡产生,该溶液不可能是
碳酸钠 理由是
碳酸钠溶液中加盐酸应该有气泡产生 ;
(4)根据以上判断,小亮确定该溶液是
氢氧化钠 .
分析:
(1)根据氢氧化钙的溶解性分析;
(2)根据溶液的酸碱性进行分析;
(3)碳酸盐的检验方法是:加盐酸会产生气泡,据此现象进行分析;
(4)用排除法得出结论.
解答:
解:(1)根据氢氧化钙的溶解性为微溶于水,所以其溶质的质量分数不可能为10%;
(2)滴加酚酞溶液,溶液变红色,说明溶液显碱性,而氯化钠溶液为中性溶液,所以不可能是氯化钠;
(3)向溶液中加入一定量的稀盐酸,没有气泡产生,说明溶液中不含碳酸根离子或碳酸氢根离子,所以溶液中没有碳酸钠;
(4)由上述探究过程可得,溶液中不含氢氧化钙、氯化钠和碳酸钠,所以可知溶液为氢氧化钠.
故答案为:(1)氢氧化钙微溶于水,其溶质的质量分数不可能为10%;
(2)氯化钠;只有氯化钠溶液显中性,它不能使酚酞变红色;
(3)碳酸钠;碳酸钠溶液中加盐酸应该有气泡产生
(4)氢氧化钠
点评:
本题考查物质的鉴定方法,要求我们熟悉常见酸、碱、盐的特性,用排除的方法进行确定.