- 382.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
东田庄学校2013中考化学复习身边的化学物质:水和溶液
中考说明
1.水:
①认识水的组成。
②知道纯水与矿泉水、硬水与软水等的区别。
③了解吸附、沉淀、过滤和蒸馏等净化水的常用方法。
④理解水对生命活动的重要意义,认识水是宝贵的自然资源,形成保护水资源和节约用 水的意识。
2.溶液:
①认识溶解现象。②知道水是最重要的溶剂,酒精、汽油也是常见的溶剂。
③了解饱和溶液和溶解度的含义。④能配制一定溶质质量分数的溶液。
⑤了解结晶现象。⑥能说出一些常见的乳化现象。
⑦了解溶液在生产、生活中的重要作用。⑧能进行溶质质量分数的简单计算。
解读考纲
围绕考纲我们应掌握如下要点:
1.水:
①正确描述水的组成、性质及用途。知道水组成的测定方法。
②能区分纯水与矿泉水、硬水与软水,掌握鉴别硬水与软水的方法。
③学会吸附、沉淀、过滤和蒸馏等净化水的常用方法。
④理解水对生命活动的重要意义,了解保护水资源和节约用水的常见措施。
2.溶液:
①能正确描述溶液的组成,理解溶液和溶质、溶剂的概念,明确它们的关系。
②通过实验认识水溶液的一些性质。
③了解饱和溶液和溶解度的含义。
④认识溶液由溶质和溶剂组成,水是常用的溶剂。
⑤正确领会饱和溶液、不饱和溶液的概念,知道它们在一定的条件下是可以相互转化的。
⑥记住溶解性和溶解度的概念,明确它们的关系。认识固体物质溶解度曲线,正确描述温度对固体溶解度的影响规律,并会简单的应用。
⑦结晶方法及其在生产生活中的应用。
⑧学会溶质质量分数的计算及一定溶质质量分数的溶液的配制。
考情回顾
(河北省)
考点
年份
考查方式
水
①对水的综合认识
2012年4题(2分)单选
考查对水的认识
②电解水
2011年30题(4分)
2012年14题(2分)单选
考查水电解实验
③水的净化
2011年29题(3分)填空
以水的组成、净化、软硬水综合认识水
溶液
①溶液
2011年29题(2分)填空
考查溶液形成、乳化作用
2012年14题(2分) 选填
以图示形式考查溶解热量变化
②饱和溶液&
不饱和溶液
2012年6题(2分)单选
考查饱和与不饱和的转化、结晶
③溶解度、溶解度曲线
2011年6题(2分)选择
以溶解度曲线考查溶解度及应用
2012年7题(2分)选择
④溶质的质量分数
2011年36题(5分)
利用守恒关系解方程式计算表格沉淀
2012年36题(5分)计算
利用守恒关系解方程式计算图示气体
创设具体情景,以“节约用水,防止水污染”为主题的信息题、开放题是中考的热点之一;围绕水的组成和性质、水的电解实验、水的净化设计考题是有关水的知识又是一个热点。
命题预测
溶液这部分内容常以填空与说明题形式考查有关溶解度的图表分析,以计算题考查溶质质量分数的计算,溶解度曲线、溶质质量分数的计算是近年来必考内容。
【教材放大镜】
知识点一 水(H2O)
1.水的组成、性质与用途
组成
水是由 和 两种元素组成的 ,也是一种氧化物。
构成
每个水分子是由 和 构成。
性
质
物性
色、 气味、 味道的液休,凝固点 ℃,沸点 ℃,4℃时密度最 ,为1g/cm3,冰的密度比水 。
化性
化学反应
化学方程式
现象
①水通电分解
②水与二氧化碳反应
③水与氧化钙反应
用途
水是生命产生、存在、发育和繁殖的基本前提,没有水就没有生命。水是农业的命脉,是工业的基础。
2.水与硬水、软水、矿泉水等的区别
不同的水
水
矿泉水
硬水
软水
海水
成分
水
含有可溶性矿物质
较多可溶性Ca2+、Mg2+
较少Ca2+、Mg2+
还含有较多可溶性盐等物质
本质区别
纯净物
混合物
3.水的净化
由低到高
原理
作用
沉淀
①静置沉淀(如用大水缸盛水);②吸附沉淀(用明矾做吸附剂)
除去不溶性杂质
过滤
把液体与不溶于液体的固体分离,过滤器的使用:“一贴二低三靠”
除去不溶性杂质
吸附
利用活性炭的吸附天然水中一些可溶性杂质和臭味物质
除去可溶性杂质和不溶性杂质
蒸馏
根据液体中各物质的沸点不同,通过加热使水中的钙、镁化合物等分解生成沉淀
①除去可溶性杂质和不溶性杂质;
②硬水软化。
4.爱护水资源
水的存在
地球表面约 被水覆盖。海洋是地球最大的储水库,其储水量占全球总储水量的96.5%,且其中含有的化学元素有 多种,淡水只约占全球储水量的2.53%,但可利用的淡水不到 。
水资源危机
①生活、生产的用水量不断增加;
②工业生产中的“三废”( 、 、 )的任意排放;
③农业中化肥、农药的不合理施用;
④生活污水的任意排放。
爱护
水资源
节约
①工业用水循环使用;②农业采用滴灌、喷灌;③生活上做到一水多用。
防治
措施
①清除污染源:工业“三废”处理达标后再排放;
农业上农药、化肥合理使用;
生活污水集中处理达标后再排放。
②加强对水质的监测,及时化解水质危机;
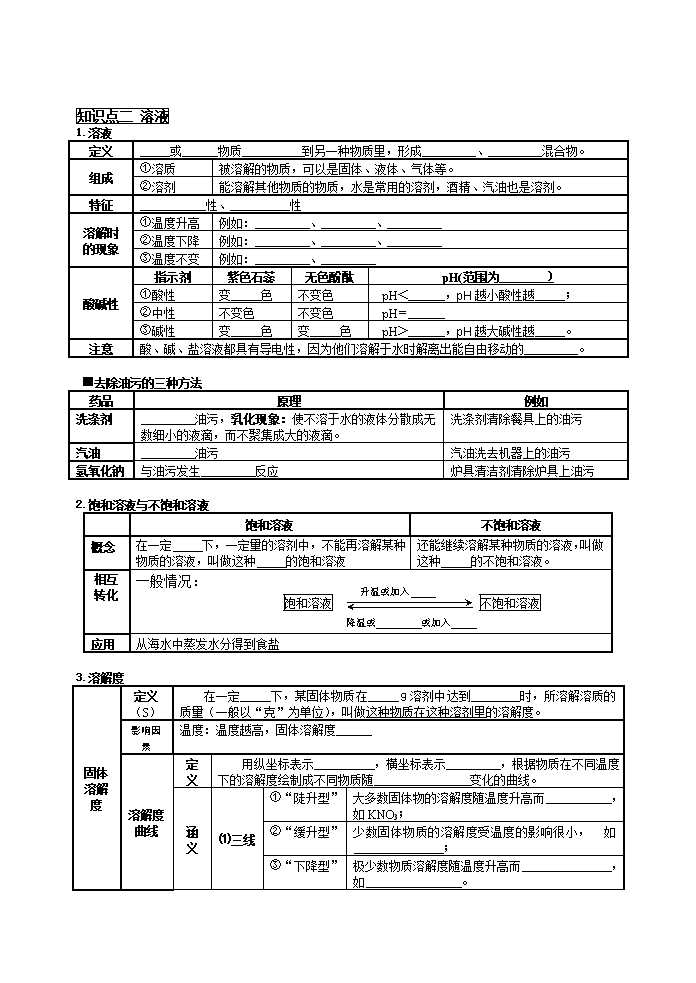
知识点二 溶液
1.溶液
定义
或 物质 到另一种物质里,形成 、 混合物。
组成
①溶质
被溶解的物质,可以是固体、液体、气体等。
②溶剂
能溶解其他物质的物质,水是常用的溶剂,酒精、汽油也是溶剂。
特征
性、 性
溶解时
的现象
①温度升高
例如: 、 、
②温度下降
例如: 、 、
③温度不变
例如: 、
酸碱性
指示剂
紫色石蕊
无色酚酞
pH(范围为 )
①酸性
变 色
不变色
pH< ,pH越小酸性越 ;
②中性
不变色
不变色
pH=
③碱性
变 色
变 色
pH> ,pH越大碱性越 。
注意
酸、碱、盐溶液都具有导电性,因为他们溶解于水时解离出能自由移动的 。
■去除油污的三种方法
药品
原理
例如
洗涤剂
油污,乳化现象:使不溶于水的液体分散成无数细小的液滴,而不聚集成大的液滴。
洗涤剂清除餐具上的油污
汽油
油污
汽油洗去机器上的油污
氢氧化钠
与油污发生 反应
炉具清洁剂清除炉具上油污
2.饱和溶液与不饱和溶液
饱和溶液
不饱和溶液
概念
在一定 下,一定量的溶剂中,不能再溶解某种物质的溶液,叫做这种 的饱和溶液
还能继续溶解某种物质的溶液,叫做这种 的不饱和溶液。
饱和溶液
不饱和溶液
降温或 或加入
升温或加入
相互
转化
一般情况:
应用
从海水中蒸发水分得到食盐
3.溶解度
固体
溶解度
定义
(S)
在一定 下,某固体物质在 g溶剂中达到 时,所溶解溶质的质量(一般以“克”为单位),叫做这种物质在这种溶剂里的溶解度。
影响因素
温度:温度越高,固体溶解度
溶解度曲线
定义
用纵坐标表示 ,横坐标表示 ,根据物质在不同温度下的溶解度绘制成不同物质随 变化的曲线。
涵义
⑴三线
①“陡升型”
大多数固体物的溶解度随温度升高而 ,如KNO3;
②“缓升型”
少数固体物质的溶解度受温度的影响很小, 如 ;
③“下降型”
极少数物质溶解度随温度升高而 ,如 。
⑵四点
①曲线上的点
所示某温度下某物质的溶解度(该温度下 状态)。
②两曲线交点
两物质在该点所示温度下的溶解度数值 。
③线上方的点
在该温度下,该溶液是 且有部分 ;
④线下方的点
该温度下,该溶液是 。
应用
参见下方练习题
气体
溶解度
定义
在压强为101 kPa和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积。
影响
因素
①温度:温度越高,气体溶解度 ,如烧开水时的现象:“响水不开,开水不响”;
②压强:压强越大,气体溶解度 ,如打开雪碧易拉罐后,气体喷涌而出。
溶解性
定义
指一种物质在另一种物质中的溶解能力,是物质的一种物理性质。
影响因素
溶质种类、溶剂种类、温度等。
与溶解度关系
物质的溶解性
易溶
可溶
难溶(不溶)
20℃时溶解度
>10g
0.01g-1g
【例题】认真分析溶解度曲线图,回答下列问题。
①Q点的含义: 。
②P点的含义: 。
③t1℃时甲、乙、丙的溶解度由大到小的顺序为 。
④t3℃时,甲物质的饱和溶液中,溶质质量、溶剂质量与溶液质量之比为 。
⑤t3℃时,将甲物质的不饱和溶液转变成饱和溶液可采取的方法有 或 。
⑥t3℃时甲、乙、丙的饱和溶液各W克,降温到t1℃时,析出晶体最多
是 物质,无晶体析出是 物质。
⑦从甲溶液中获取甲晶体(即提纯甲晶体)可用 的方法获取晶体。
⑧从乙溶液中获取乙晶体(即提纯乙晶体)可用 的方法获取晶体。
⑨除去甲中的泥沙用 法;分离甲与乙(含量少)的混合物,用 法。
⑩在t2℃时,30g 甲物质加入到50g水中不断搅拌,能形成80g溶液吗? (填“能”或“不能”)为什么? 。
4.结晶
5.配制一定溶质质量分数的溶液
类型
步骤
仪器
用固体配制
计算、称量、溶解
天平、药匙;量筒、滴管;烧杯、玻璃棒
用浓溶液稀释
计算、量取、稀释
量筒、滴管;烧杯、玻璃棒
6.有关溶液中溶质的质量分数的计算
⑴有关公式(注意单位统一):
①溶液的质量=溶质的质量+溶剂的质量=溶液的体积×溶液的密度
②溶质的质量分数= 的质量÷ 的质量×100%
③饱和溶液中溶质的质量分数:
饱和溶液中溶质的质量分数= ————————×100%
⑵计算类型
①溶液加水稀释的计算:
稀释前后溶质的质量相等:m(浓)×a%(浓)=[m(浓)+m(水)] ×a%(稀)
②溶质质量分数不同的同溶质溶液混合问题:
m(浓)×a%(浓)+m(稀)×a%(稀)=m(混)×a%(混)
③求化学反应后所得溶液中溶质质量分数的问题:
通过化学反应计算出溶质质量,再分析各量间关系求出溶液总质量,运用公式计算出反应后溶液中溶质的质量分数.
求反应后所得溶液质量的一般方法:质量守恒法,即:m液==m总---m↓---m↑
■溶解度&溶质质量分数的比较
溶解度
溶质质量分数
定义
在一定 下,某固体物质在 g溶剂中达到 时,所溶解溶质的质量。
溶质质量与 质量之比。
表示意义
①物质溶解性大小的定量表示。
②表示某温度时的饱和溶液中溶质的质量与溶剂的质量关系。
①是溶液浓稀的定量表示。
②表示某溶液中溶质的质量与溶液的质量关系。
温度要求
与温度 关
与温度 关
溶剂的量
在 g溶剂中
溶剂的量不一定是100g
溶液类型
一定是 溶液
饱和溶液与不饱和溶液均可
单位
克(g)
比值无单位。常用百分数(%)表示
计算公式
溶解度(S)=——————×100g
溶质的质量分数=————×100%
■重点疑点讨论
1、凡是澄清透明的、均一稳定的液体就是溶液吗?举例说明。
2、只要升高温度就一定能使饱和溶液变为不饱和溶液吗?
3、一定温度下饱和NaCl溶液中还能溶解KNO3吗?请说明理由。
4、溶液长期放置溶质能否从溶液中分离出来?
5、怎样理解“溶质的质量是指溶解在溶液中的物质的质量,而不是加入
到溶剂中的物质的质量”这句话?举例说明。
6、为什么说一定温度下,某物质饱和溶液的溶质的质量分数最大?
7、“饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液”此说法合理吗?
8、不饱和溶液变为饱和溶液后溶质的质量分数一定增大吗?饱和溶液中
析出晶体后,剩余溶液的溶质的质量分数一定减小吗?请分别举例说明。
9、溶液混合时,溶液的质量可以相加,其体积能否直接相加?为什么?
■知识系统再现
1.水是常用溶剂,物质溶于水能使水溶液的沸点升高,凝固点下降,导电性增强。
2.饱和和不饱和溶液的意义在于指明“一定温度”和“一定量的溶剂”,且可以相互转化:一般情况
①降温②加溶质③蒸发溶剂
不饱和溶液 饱和溶液
①加溶剂②升温
3.溶解性是一种物质在另一种物质中的溶解能力,它与溶质、溶剂的性质有关,与外界的条件有关(如温度),气体物质还与压强有关。
4.固体物质溶解度随温度变化可用溶解度曲线表示,利用该曲线可查找某温度下某物质的溶解度,可利用根据曲线判断某物质溶解度受温度影响情况,也可以比较同温度下不同物质的溶解度的大小等。
5.溶解度和溶质质量分数的关系:
溶解度
溶质的质量分数
区别
受温度影响
不受温度影响
指一定温度下,100g溶剂中最多溶解溶质的质量
指溶液中所含溶质的质量分数
单位g
无单位
联系
饱和溶液中溶质质量分数=×100%
6.溶液的酸碱性的表示方法:pH值,测定酸碱性用指示剂,测定酸碱度用pH测纸。
7.乳化是液体小液滴悬浮在水中形成的乳浊液,这一原理可以帮助我们理解清除油污的原理。
8.有关计算:
计算类型
依据
内容
计算式
1.基本计算
溶质的质量分数的概念
m水、m质、m液及ω互换
ω=(m质/m液)×100%
=[ m质/(m质+m水) ]×100%
2.与溶液密度有关的溶质的质量分数的计算
溶液密度与溶质的质量分数概念
ρ、m质、m液及ω计算
ω=m质/(ρ·V液)×100%
3.稀释计算
稀释前后溶质的质量相等
溶液加水稀释计算
m1×ω=[m1+m水]×ω2
⑴.溶质的质量分数表示溶质在溶液里的相对含量。当溶液的质量一定时,溶质的质量越大,溶质的质量分数也越大;当溶质的质量一定时,溶液的质量越大,溶质的质量分数就越小。
●计算时的注意点:
①溶质的质量分数是质量比而不是体积比,若是体积,必须先用物理公式ρ=m/v进行换算,然后计算;
②在运算过程中,质量的单位要统一;
③因为通常溶液均为水溶液,所以溶质应为无水的物质;能与水反应的物质,其溶质应是反应后的生成物,而不是原来加入的物质,因此计算时应先算出反应后的生成物的质量。
④若溶质虽不与水发生反应,但没全部溶解,则溶质的质量只能计算已经溶解的部分,未溶解的部分不能参加计算。
⑤若溶质为结晶水合物,溶于水后,其溶质的质量就不包括结晶水的质量。
⑥关于酸、碱、盐溶液间发生的化学反应,求反应后溶液中溶质质量分数的计算,要明确生成的溶液中溶质是什么,再求出其质量是多少,最后运用公式计算出反应后溶液中溶质的质量分数。
●解题思路:审题 → 写出配平的化学方程式 → 找出关系量 → 列出比例式 → 求解。
⑵.溶液的稀释与浓缩的计算
①溶液中溶质质量分数增大的方法有两种:一是加溶质,另一种是蒸发溶剂(即浓缩)。
②溶液稀释的方法是加溶剂。
一、选择题(每题2分,共40分。)
1、下列关于水的性质的叙述中,属于化学性质的是( )
A.降温到0℃,水结成冰 B.加热到100℃,水变成水蒸气
C.水蒸气遇冷,凝结成水 D.给水通电,生成氧气和氢气
2、从一杯食盐水的上部取出一些溶液,测定它的密度是ag/mL,再从下部取出一些溶液,测定它的密度,其数值应该是( )
A.大于 a B、小于a C、等于a D、无法判断
3、小兰通过化学方程式知道,通电分解水时生成氢气和氧气的体积应该为2:1,但实验所得数据氢气和氧气的体积比略大于2:1。针对这一发现你认为下列做法中不可取的是( )
A. 反复多次实验查找原因
B. 实验所得数据与理论值相差不多,可以诊断实验已经成功
C. 大胆提出假设:氧气比氢气易溶于水
D. 查找实验装置是否漏气
4、已知20℃时食盐的溶解度为36g。20℃时把20g食盐放入50g水中,充分搅拌后,所得饱和溶液的质量是( ) 版权:侯红吉
A.70g B.69g C.68g D.67g
5、海洋是人类未来开发利用资源的主要场所。下列操作不能用来淡化海水的是( )
A.过滤 B.蒸馏 C.使海水结冰脱盐 D.多级闪急蒸馏
6、地球上的总储水量虽然很大,但淡水很少,爱护水资源是每个公民的责任和义务。下列行为属于节约用水的是( )
A.公共场所不用随手关水龙头 B.洗完菜的水用来浇花
C.不间断放水刷牙 D.用大容量马桶可以冲洗得更干净
7、今年春季,我国西南地区发生了百年一遇的特大旱灾,国家投入大量人力物力来保障灾区人民的基本生活用水。下列关于水的认识正确的是( )
A.水是良好的溶剂,许多物质都能溶于水
B.通过电解水试验,可知水是有氢气和氧气组成的
C.为了节约用水,提倡用工业废水直接灌溉农田
D.用沉淀法、过滤法和蒸馏法净化水,效果最好的是过滤法
8、灾区人民解决用水困难的一个应急办法,是将浑浊的河水直接静置(或投入沉淀剂静置)后过滤。若在化学实验室进行过滤操作,下列仪器不需要的是( )
9、用氯化钠配制l00g溶质质量分数为20%的氯化钠溶液,现有下列操作:①溶解;②称取氯化钠;③过滤;④量取水;⑤计算;⑥蒸发结晶。正确的操作顺序是( )
A.①②③④ B.⑤②④① C.①③⑤②④① D.①③⑥⑤②④①
10、据报道,我市人均水资源量仅为全国人均水资源量的14%,属于严重缺水的城市。并且地处淮河水系下游和入海口,污染水多。因此,节约用水和污水处理就显得尤为重要。下列是保护市区主要供水河流——蔷薇河水质的建议,其中不合理的是( )
A.严禁将含磷废水排入河中
B.坚决杜绝岸边农田使用农药和化肥 版权:侯红吉
C.严禁在河边随意堆放生活垃圾
D.严禁在河北丢弃含汞、铅等金属的废旧电池
11、将70℃的硝酸钠饱和溶液降温到10℃,有晶体析出(晶体中不含水),下列各量没有发生变化的是( )
A.硝酸钠的溶解度 B.溶液中溶质的质量
C.溶液中溶剂的质量 D.溶液中溶质的质量分数
12、今年世界各国频发地震。为防止震后疾病传染须对饮用水源进行处理,采取的措施有:
①煮沸 ②消毒 ③过滤 ④自然沉降,合理处理的顺序是( )
A.③①②④ B.②④③① C.④③①② D.④③②①
13、下列说法中不正确的是( )
A、碘酒中的溶剂是酒精,溶质是碘
B、浓溶液加水稀释过程中,溶质的质量保持不变
C、析出晶体的溶液是该溶质的饱和溶液
D、葡萄糖、植物油、蛋清都可溶于水形成溶液
14、在一定温度下,向盛有氯化钠饱和溶液的烧杯中加入氯化钠晶体后,则( )
A.晶体质量减少 B.晶体质量不变
C.溶质质量分数增大 D.氯化钠溶解度增大
15、在温度不变的条件下,下列欲使溶质的质量分数变为原来2倍的方法,最可行的是( )
A.将20g硝酸钾饱和溶液蒸发掉10g水
B.将20g硝酸钾不饱和溶液蒸发掉10g水
C.在10g10﹪的硝酸钾溶液中,加入5g40﹪的硝酸钾溶液
D.将10g硝酸钾不饱和溶液中加入10g硝酸钾固体
16、稀释质量分数为98%(密度为1.84g/ mL)的浓硫酸配制500 mL质量分数为20%的稀硫酸(密度为1.14g/ mL),稀释时需用的水的体积约为( )
A.436.8 mL B.453.7mL C.456.0 mL D.458.3mL
17、右图是a、b两种固体物质(不含结晶水)的溶解度曲线。下列说法正确的是( )
A.b的溶解度大于a的溶解度
B.t1℃时,将a、b两种物质的饱和溶液分别恒温蒸发等质量的水,析出晶体的质量一定相等
C.将t2℃时的b的不饱和溶液降温至t1℃,一定能得到b的饱和溶液
D.t2℃时,a溶液的溶质质量分数一定小于b溶液的溶质质量分数
18、下图为氯化铵和硫酸钠的溶解度曲线。下列说法中不正确的是( )
A.30℃时,氯化铵、硫酸钠的溶解度相同
B.氯化铵的溶解度随温度的升高而增大
C.将50℃时硫酸钠的饱和溶液降低温度,始终有晶体析出
D.将60℃时硫酸钠的饱和溶液降温至40℃,溶质的质量分数不变
19、室温下,称取氯化钠和碳酸钠各30g放入同一烧杯中,加入l00g水充分搅拌后静置,得到二者的混合溶液。请参照氯化钠、碳酸钠两物质的溶解度表判断,以下结论不正确的是( )
A.20℃时,氯化钠的溶解度大于碳酸钠的溶解度
B.20℃时,未溶解固体是氯化钠和碳酸钠的混合物
C.30℃时,溶液中氯化钠和碳酸钠的质量分数相同
D.30℃时,溶液为氯化钠和碳酸钠的不饱和溶液
20、甲、乙两种固体的溶解度曲线如右图。将①②两试管中的甲、乙饱和溶液(均有少量未溶解的固体)放进盛有热水的烧杯里。升高温度后,下列有关说法正确的是( )
A.①②两溶液的质量一定相等
B.①②两溶液均变为不饱和溶液
C.①溶液质量增加,②溶液质量减少 版权:侯红吉
D.①溶液中溶质的质量分数一定大于②溶液
二、简答题(每空2分,共40分。)
21.2010年4月14日07时49分,青海玉树发生了7.1级地震,震后当地生态环境和生活条件受到极大破坏,水源受到一定程度污染。灾区人们日常生活用水必需经过一系列的精华处理才能使用。
⑴向水样中加入明矾,经溶解、静置、 (填操作名称),除去不溶性杂质,然后加入活性炭,利用其 性除去异味,再杀菌消毒,得到生活用水。
⑵“中水”是指生活污水经处理后,达到规定的水质标准,可在一定范围内再次使用的非饮用水,利用“中水”的实际意义是 。
22.化学中有许多概念是相对的,又是统一的。下图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系。
⑴从右图可以看出,饱和溶液与浓溶液、稀溶液的关系是
。
⑵0.9%的医用生理盐水可归于上图中 区域(选填“Ⅰ”、“Ⅱ”、“Ⅲ”或“Ⅳ”)。
⑶生产上要配制5000g10%的盐酸来清洗钢材,需38%的盐酸(密度为1.19g/cm3
)__________mL(计算结果保留小数点后一位)。
23.运用溶解度表与溶解度曲线回答下列问题:
⑴B是 的溶解度曲线。
⑵60℃时,100g水中加入100g硝酸钾,所得溶液是 (填“饱和”或“不饱和”)溶液,当60℃的该溶液降温到30℃时,析出晶体的质量为 g。
24.请根据如图中A、B两种固体物质的溶解度曲线,回答下列问题。
⑴t2℃时,100g水中溶解 gA物质恰好达到饱和,该饱和溶液中溶质的质量分数为 ,若要把该饱和溶液稀释成质量分数为10%的溶液,应加水 g。
⑵将t2℃时A、B两种物质的饱和溶液降温至t1℃(其它条件不变),溶质的质量分数保持不变的是 。
⑶要把B的a溶液转化为b的溶液,你可用 。
25.小明同学绘制了如右图所示A、B两种固体物质的溶液度曲线:
⑴若将B物质从溶液中结晶析出,宜采用的方法是 。
⑵我国有许多盐碱湖,湖中溶有大量的氯化钠和硝酸钾,那里的人们“冬天捞碱,夏天晒盐。”据此你认为图中 (填“A”或“B”)物质的溶解度曲线与纯碱的相似。
26.下表列出了固体物质A在不同温度时的溶解度:
温度/℃
0
10
20
30
40
50
60
70
80
90
溶解废/g
36
35
34
33
32
31
30
29
28
27
(1)70℃时,向盛有100g水的烧杯中加入30g固体A,充分溶解形成的是 (填“饱和”或“不饱和”)溶液,再将烧杯内物质温度降至20℃,此时溶液中溶质与溶剂的质量比为 (填最简整数比);
(2)通过对上表数据的分析,物质A的溶解度曲线应是右图中的 (填“甲”或“乙”);
(3)80℃时,配制一定量甲物质的溶液,将其降温到60℃,是否有固体析出? (填“有”、“没有”或“不确定”)。
三、实验探究题(每空1分,共10分。) 版权:侯红吉
27.下图是小明配制100g质量分数为18.5%的蔗糖溶液的实验操作示意图:
① ② ③ ④ ⑤[
⑴配制上述溶液,小明要称取蔗糖 g。
⑵上图①、②、④中相同的仪器名称是 。
⑶用上图所示的序号表示正确配制该溶液的操作顺序为 。
⑷若上图③中砝码的质量为15 g,游码的读数为3.5 g,则小明称得的蔗糖质量实际为
g。若所量取的水的质量没有错误,实际配制的溶质质量分数为 。
⑸用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 。
A.增加适量氯化钠固体 B.减少适量氯化钠固体 C.调节平衡螺母
28.人类的生活和工农业生产都离不开水。下图是自来水厂净水过程示意图。
请根据图示回答下列问题:
⑴自来水厂生产自来水时,使用的净水方法有______________;
A.沉淀 B.过滤 C.煮沸 D.蒸馏 E.吸附
⑵过滤是一种净水的方法,利用过滤的方法,可将不溶于水的固体杂质与水分离开来。如右图是过滤操作示意图,请指出两点错误:
① ;
② ;
⑶若过滤后仍然浑浊,则原因可能有:
。
29. 根据如图所示的信息计算:
⑴加入的稀硫酸质量为 g.
⑵所用稀硫酸溶质的质量分数.(化学方程式:2KOH+H2SO4═K2SO4+2H2O)
30. 过氧化氢溶液长期保存会自然分解,使得溶质质量分数减小。小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定溶质质量分数。他们取出该溶液51g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如
图37-21所示。
(1)完全反应后生成氧气的质量为________。
(2)计算该溶液中溶质的质量分数。