- 1.41 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2014年厦门市中考化学试题
H-1 C-12 O-16 Fe-56 Zn-65
一、 单项选择题(共10小题,共25分;第1-5题各2分,第6-10题各3分。)
1.下列食品显碱性的是( )
A.醋(pH=2.1) B.酒(pH=7.0) C.酱油(pH=4.4) D.皮蛋(pH=10.1)
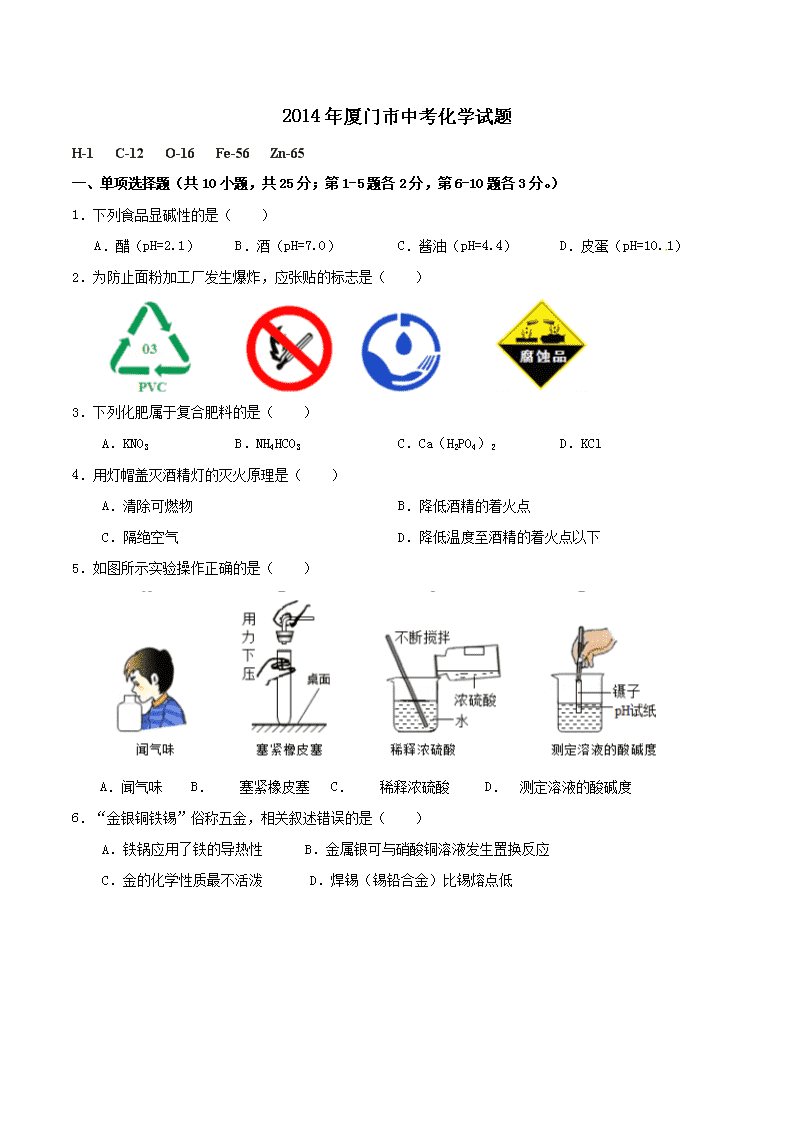
2.为防止面粉加工厂发生爆炸,应张贴的标志是( )
3.下列化肥属于复合肥料的是( )
A.KNO3 B.NH4HCO3 C.Ca(H2PO4)2 D.KCl
4.用灯帽盖灭酒精灯的灭火原理是( )
A.清除可燃物 B.降低酒精的着火点
C.隔绝空气 D.降低温度至酒精的着火点以下
5.如图所示实验操作正确的是( )
A.闻气味 B. 塞紧橡皮塞 C. 稀释浓硫酸 D. 测定溶液的酸碱度
6.“金银铜铁锡”俗称五金,相关叙述错误的是( )
A.铁锅应用了铁的导热性 B.金属银可与硝酸铜溶液发生置换反应
C.金的化学性质最不活泼 D.焊锡(锡铅合金)比锡熔点低
7.浑浊的海水经如图净水器处理后,有关叙述正确的是( )
A.消灭了水中的细菌 B.所得的水一定是软水
C.有减少海水的异味 D.能得到纯净水
8.已知氨气是极易溶于水、密度比空气小的气体,用试管收集氨气,可选用的装置是( )
9.某密闭容器中,物质变化过程的微观示意图如图所示,图中“”代表碳原子,“”代表氧原子.下列说法正确的是( )
A.过程Ⅰ反应类型化合反应 B.过程Ⅱ发生了化学变化
C.示意图中所有物质均为氧化物 D.参加反应的CO与O2分子个数比为1:1
10.如图是三种固体物质的溶解度曲线,下列说法正确的是( )
A.物质c的溶解度随温度的升高而增大
B.物质a的溶解度大于物质c的溶解度
C.t2℃时,60g物质a与100g水充分混合后所得溶液的总质量为160g
D.将t1℃b,c两种物质的饱和溶液升温至t2℃,溶液中溶质质量分数不变的是b溶液
二、填空与简答题(共5小题,共44分)
11.(11分)人体必需的微量元素有铁、氟、锌、硒、碘等.它们在人体内虽然含量少,但对健康至关重要.
(1)图1是氟元素的原子结构示意图,其最外层电子数是 ;
(2)从图2可知硒元素的原子序数为 ;
(3)加碘盐所含KIO3中的I的化合价是 ;
(4)写出化学符号:①氟离子 ;②三个铁原子 ;③碘单质(双原子分子) ;
(5)葡萄糖酸锌(C12H22O14Zn)由 种元素组成,其中碳元素与氢元素的质量比为 ;
(6)硫酸亚铁是一种补铁剂,写出一个由铁单质获得硫酸亚铁的化学方程式: .
12.(11分)化学在交通“节能减排”中发挥重要作用.
(1)液化天然气(LNG)是我市正在推广的公交车燃料,它具有燃烧效率高、污染小的优点.写出天然气主要成分完全燃烧的化学方程式: .
(2)汽车尾气中NO与CO在催化剂的作用下,反应生成CO2和一种无污染的单质气体.写出该反应的化学方程式: .
(3)氢化镁(MgH2)固体与水反应生成氢氧化镁和氢气,可为氢动力汽车提供能源.写出该反应的化学方程式: .
(4)我市倡导自行车“低碳出行”.采用碳纤维材料的自行车轻便、机械强度大,这应用了碳纤维的 (填“物理”或“化学”)性质;自行车采用铝合金材料,金属铝具有较强抗腐蚀性的原因: .
13.(7分)如图所示装置的U形管左侧管内固定一小试管.
(1)若右侧管内挂的是滴有酚酞试液的滤纸条,向小试管中滴加浓氨水,可观察到滤纸条的颜色变化是 ;若先在小试管中加入氧化钙固体,再进行上述实验操作,则可在更短的时间内观察到滤纸条有相同的变化,可能的原因是 .
(2)若右侧管内挂的是石蕊试液浸泡过的滤纸条,其中一条是湿润的,一条是晾干的.向装有碳酸钠粉末的小试管中滴加稀硫酸,写出小试管中发生反应的化学方程式: ;证明二氧化碳可与水反应的现象: ;要让气球明显变瘪,可用针筒向U形管内注入足量的 溶液.
14.(9分)追求化学家的足迹.
(1)舍勒是最早制得氧气的化学家之一,他获得氧气的方法主要有以下两类:
a.加热分解硝酸钾、氧化汞、硝酸银等
b.用二氧化锰与浓硫酸加热:2MnO2+2H2SO4(浓)2MnSO4+2X+O2↑
①a中反应物均可制得氧气,因为它们组成的共同点: ;
②b中物质X化学式为 ;
③写出实验室制取氧气的一个化学方程式: .
(2)舍勒由于受“燃素说”的影响(即认为一切可以燃烧的物质都是由灰和“燃素”组成的,物质燃烧后剩下的是灰,而燃素本身变成了光和热,逸散到空中去了),导致“氧气”从他的鼻尖下溜走.化学家拉瓦锡结合大量实验事实,否定了“燃素说”认为的“物质燃烧后质量应当减轻”的观点,真正发现了氧气.
①写出铁丝在氧气中燃烧的化学方程式: ;
②以铁燃烧的事实,指出上述“燃素说”的谬误: .
15.(6分)氯化钾固体样品中混有少量碳酸钾和硫酸钾两种杂质,为了获得纯净的氯化钾,将样品溶解,按如图所示步骤进行提纯.已知试剂1为氯化钾溶液,B、C为固体难溶物,每步骤加稍过量的试剂.
(1)固体难溶物B含有碳酸钡和 ;
(2)检验步骤①已除去杂质的方法(操作、现象、结论)是
;
(3)试剂Ⅱ中溶质的化学式: ,试剂Ⅲ的名称是 ;
(4)由E获得氯化钾晶体的分离操作名称是 .
三、实验与探究题(共2小题,满分20分)
16.(10分)实验室用溶质质量分数为10%氢氧化钠溶液进行水的电解实验.
实验一:配制100g溶质质量分数为10%氢氧化钠溶液.
(1)所需的氢氧化钠质量: g;
(2)称量时,氢氧化钠固体应放于天平 (填“左”或“右”)盘的烧杯内;量取的需的水(水的密度为1g/cm3),应选择的量筒的规格是 mL(选填“10”、“100”或“250”).
实验二:水的电解实验
用如图装置进行水的电解实验.已知氢氧化钠在水的电解实验中,只起到增强水的导电性作用.
(3)开始反应前a,b两管内都充满溶液.关闭活塞,接通电源,一段时间后,两管产生的气体如图所示,则a管下方导线应接电源的 极(填“正”或“负”).用 验证b管中的气体,写出电解水的化学方程式: .
(4)说明水是一种化合物的实验事实: .
(5)电解后溶液的溶质质量分数 10%(填“<”、“=”或“>”).
17.(10分))已知木炭还原氧化铜实验中发生的主要反应:C+2CuO2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
探究一:检验产物的成份
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体.暗红色固体是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体;Cu2O+H2SO4═CuSO4+Cu+H2O.
【猜想与假设】暗红色固体除铜外还可能含有Cu2O.
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到现象: ,说明暗红色固体含有Cu2O.
探究二:测定产物中Cu2O的含量
原理:Cu2O+H22Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是 ;
(2)若不加装置e,实验结果会偏高,原因是 ;
(3)点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2,关闭K1 ②检查装置的气密性
③连接仪器 ④关闭K2,打开K1,通氢气一段时间
(4)还可通过测定反应前后装置 (填“a”、“b”或“c”)的质量达到实验目的.
四、计算与应用题(共1小题,11分)
18.(11分)已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的组成,称取54.0g草酸亚铁晶体在隔绝空气条件下加热,得到剩余固体的质量随温度变化曲线如图所示.已知:温度t1℃时,草酸亚铁晶体完全脱去结晶水,并生成草酸亚铁(FeC2O4)固体;温度t2℃时,草酸亚铁完全分解,发生反应:3FeC2O4Fe3O4+4CO↑+2CO2↑.
(1)根据化学方程式计算草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量.
(2)求该草酸亚铁晶体中结晶水的质量.
(3)求该草酸亚铁晶体中铁元素的质量分数(精确到0.1%).
2014年厦门市中考化学试题(含详细解析)
一、单项选择题(共10小题,共25分;第1-5题各2分,第6-10题各3分。)
1.下列食品显碱性的是( )
A.醋(pH=2.1) B.酒(pH=7.0) C.酱油(pH=4.4) D.皮蛋(pH=10.1)
考点:溶液的酸碱性与pH值的关系
2.为防止面粉加工厂发生爆炸,应张贴的标志是( )
考点:几种常见的与化学有关的图标
3.下列化肥属于复合肥料的是( )
A.KNO3 B.NH4HCO3 C.Ca(H2PO4)2 D.KCl
考点:常见化肥的种类和作用
4.用灯帽盖灭酒精灯的灭火原理是( )
A.清除可燃物 B.降低酒精的着火点
C.隔绝空气 D.降低温度至酒精的着火点以下
考点:灭火的原理和方法菁优
5.如图所示实验操作正确的是( )
A.闻气味 B. 塞紧橡皮塞 C. 稀释浓硫酸 D. 测定溶液的酸碱度
考点:仪器的装配或连接;浓硫酸的性质及浓硫酸的稀释;溶液的酸碱度测定
6.“金银铜铁锡”俗称五金,相关叙述错误的是( )
A.铁锅应用了铁的导热性 B.金属银可与硝酸铜溶液发生置换反应
C.金的化学性质最不活泼 D.焊锡(锡铅合金)比锡熔点低
【答案】B
【解析】
考点:金属的化学性质;金属的物理性质及用途;合金与合金的性质
7.浑浊的海水经如图净水器处理后,有关叙述正确的是( )
A.消灭了水中的细菌 B.所得的水一定是软水
C.有减少海水的异味 D.能得到纯净水
考点:水的净化;硬水与软水.
8.已知氨气是极易溶于水、密度比空气小的气体,用试管收集氨气,可选用的装置是( )
考点:常用气体的收集方法
9.某密闭容器中,物质变化过程的微观示意图如图所示,图中“”代表碳原子,“”代表氧原子.下列说法正确的是( )
A.过程Ⅰ反应类型化合反应 B.过程Ⅱ发生了化学变化
C.示意图中所有物质均为氧化物 D.参加反应的CO与O2分子个数比为1:1
考点:微粒观点及模型图的应用;从组成上识别氧化物;化学变化和物理变化的判别;反应类型的判定
10.如图是三种固体物质的溶解度曲线,下列说法正确的是( )
A.物质c的溶解度随温度的升高而增大
B.物质a的溶解度大于物质c的溶解度
C.t2℃时,60g物质a与100g水充分混合后所得溶液的总质量为160g
D.将t1℃b,c两种物质的饱和溶液升温至t2℃,溶液中溶质质量分数不变的是b溶液
【答案】D
【解析】
考点:固体溶解度曲线及其作用;溶质的质量分数、溶解性和溶解度的关系.
二、填空与简答题(共5小题,共44分)
11.(11分)人体必需的微量元素有铁、氟、锌、硒、碘等.它们在人体内虽然含量少,但对健康至关重要.
(1)图1是氟元素的原子结构示意图,其最外层电子数是 ;
(2)从图2可知硒元素的原子序数为 ;
(3)加碘盐所含KIO3中的I的化合价是 ;
(4)写出化学符号:①氟离子 ;②三个铁原子 ;③碘单质(双原子分子) ;
(5)葡萄糖酸锌(C12H22O14Zn)由 种元素组成,其中碳元素与氢元素的质量比为 ;
(6)硫酸亚铁是一种补铁剂,写出一个由铁单质获得硫酸亚铁的化学方程式: .
考点:原子结构示意图与离子结构示意图;元素周期表的特点及其应用;化学式的书写及意义;有关元素化合价的计算;元素质量比的计算;化学符号及其周围数字的意义;书写化学方程式、文字表达式、电离方程式.
12.(11分)化学在交通“节能减排”中发挥重要作用.
(1)液化天然气(LNG)是我市正在推广的公交车燃料,它具有燃烧效率高、污染小的优点.写出天然气主要成分完全燃烧的化学方程式: .
(2)汽车尾气中NO与CO在催化剂的作用下,反应生成CO2和一种无污染的单质气体.写出该反应的化学方程式: .
(3)氢化镁(MgH2)固体与水反应生成氢氧化镁和氢气,可为氢动力汽车提供能源.写出该反应的化学方程式: .
(4)我市倡导自行车“低碳出行”.采用碳纤维材料的自行车轻便、机械强度大,这应用了碳纤维的 (填“物理”或“化学”)性质;自行车采用铝合金材料,金属铝具有较强抗腐蚀性的原因: .
考点:常用燃料的使用与其对环境的影响;金属的化学性质;化学性质与物理性质的差别及应用;书写化学方程式、文字表达式、电离方程式.
13.(7分)如图所示装置的U形管左侧管内固定一小试管.
(1)若右侧管内挂的是滴有酚酞试液的滤纸条,向小试管中滴加浓氨水,可观察到滤纸条的颜色变化是 ;若先在小试管中加入氧化钙固体,再进行上述实验操作,则可在更短的时间内观察到滤纸条有相同的变化,可能的原因是 .
(2)若右侧管内挂的是石蕊试液浸泡过的滤纸条,其中一条是湿润的,一条是晾干的.向装有碳酸钠粉末的小试管中滴加稀硫酸,写出小试管中发生反应的化学方程式: ;证明二氧化碳可与水反应的现象: ;要让气球明显变瘪,可用针筒向U形管内注入足量的 溶液.
考点:反应现象和本质的联系;二氧化碳的化学性质;生石灰的性质与用途;酸的化学性质;碱的化学性质;分子的定义与分子的特性;书写化学方程式、文字表达式、电离方程式
14.(9分)追求化学家的足迹.
(1)舍勒是最早制得氧气的化学家之一,他获得氧气的方法主要有以下两类:
a.加热分解硝酸钾、氧化汞、硝酸银等
b.用二氧化锰与浓硫酸加热:2MnO2+2H2SO4(浓)2MnSO4+2X+O2↑
①a中反应物均可制得氧气,因为它们组成的共同点: ;
②b中物质X化学式为 ;
③写出实验室制取氧气的一个化学方程式: .
(2)舍勒由于受“燃素说”的影响(即认为一切可以燃烧的物质都是由灰和“燃素”组成的,物质燃烧后剩下的是灰,而燃素本身变成了光和热,逸散到空中去了),导致“氧气”从他的鼻尖下溜走.化学家拉瓦锡结合大量实验事实,否定了“燃素说”认为的“物质燃烧后质量应当减轻”的观点,真正发现了氧气.
①写出铁丝在氧气中燃烧的化学方程式: ;
②以铁燃烧的事实,指出上述“燃素说”的谬误: .
【答案】(1)①都含氧元素;②H2O;③2H2O22H2O+O2↑;(2)①3Fe+2O2Fe3O4;②铁丝在氧气中燃烧,反应后固体的质量增加.
【解析】
考点:实验室制取氧气的反应原理;氧气的化学性质;质量守恒定律及其应用;书写化学方程式、文字表达式、电离方程式.
15.(6分)氯化钾固体样品中混有少量碳酸钾和硫酸钾两种杂质,为了获得纯净的氯化钾,将样品溶解,按如图所示步骤进行提纯.已知试剂1为氯化钾溶液,B、C为固体难溶物,每步骤加稍过量的试剂.
(1)固体难溶物B含有碳酸钡和 ;
(2)检验步骤①已除去杂质的方法(操作、现象、结论)是
;
(3)试剂Ⅱ中溶质的化学式: ,试剂Ⅲ的名称是 ;
(4)由E获得氯化钾晶体的分离操作名称是 .
酸钡沉淀和氯化钾,所以试剂Ⅱ为碳酸钾;盐酸和碳酸钾反应生成氯化钾、水和二氧化碳,所以试剂Ⅲ的名称是盐酸;(4)氯化钾溶于水,所以由E获得氯化钾晶体的分离操作名称是蒸发结晶.
考点:混合物的分离方法;蒸发与蒸馏操作;盐的化学性质.
三、实验与探究题(共2小题,满分20分)
16.(10分)实验室用溶质质量分数为10%氢氧化钠溶液进行水的电解实验.
实验一:配制100g溶质质量分数为10%氢氧化钠溶液.
(1)所需的氢氧化钠质量: g;
(2)称量时,氢氧化钠固体应放于天平 (填“左”或“右”)盘的烧杯内;量取的需的水(水的密度为1g/cm3),应选择的量筒的规格是 mL(选填“10”、“100”或“250”).
实验二:水的电解实验
用如图装置进行水的电解实验.已知氢氧化钠在水的电解实验中,只起到增强水的导电性作用.
(3)开始反应前a,b两管内都充满溶液.关闭活塞,接通电源,一段时间后,两管产生的气体如图所示,则a管下方导线应接电源的 极(填“正”或“负”).用 验证b管中的气体,写出电解水的化学方程式: .
(4)说明水是一种化合物的实验事实: .
(5)电解后溶液的溶质质量分数 10%(填“<”、“=”或“>”).
考点:一定溶质质量分数的溶液的配制;测量容器-量筒;称量器-
托盘天平;常见气体的检验与除杂方法;电解水实验;书写化学方程式、文字表达式、电离方程式
17.(10分))已知木炭还原氧化铜实验中发生的主要反应:C+2CuO2Cu+CO2↑.化学兴趣小组对该实验产物(假设反应物已完全反应)作如下探究:
探究一:检验产物的成份
【提出问题】实验产物是暗红色固体,很难观察到紫红色固体.暗红色固体是什么?
【查阅资料】氧化亚铜(Cu2O)为红色固体;Cu2O+H2SO4═CuSO4+Cu+H2O.
【猜想与假设】暗红色固体除铜外还可能含有Cu2O.
【设计实验】取少量暗红色固体,加入稀硫酸,如果观察到现象: ,说明暗红色固体含有Cu2O.
探究二:测定产物中Cu2O的含量
原理:Cu2O+H22Cu+H2O,称取一定质量的固体样品,用如图装置进行实验(固定装置略去,碱石灰为氧化钙和氢氧化钠的混合物),通过测定反应前后装置d的质量达到实验目的.
(1)装置a中用稀硫酸而不用稀盐酸,原因是 ;
(2)若不加装置e,实验结果会偏高,原因是 ;
(3)点燃酒精灯前涉及的部分操作如下,正确的顺序是
①打开K2,关闭K1 ②检查装置的气密性
③连接仪器 ④关闭K2,打开K1,通氢气一段时间
(4)还可通过测定反应前后装置 (填“a”、“b”或“c”)的质量达到实验目的.
考点:实验探究物质的组成成分以及含量;常见气体的检验与除杂方法;酸的物理性质及用途;酸的化学性质.
四、计算与应用题(共1小题,11分)
18.(11分)已知有些晶体按比例含有一定量特殊的水(称为结晶水),在一定的温度下可脱去结晶水,为了研究草酸亚铁晶体的组成,称取54.0g草酸亚铁晶体在隔绝空气条件下加热,得到剩余固体的质量随温度变化曲线如图所示.已知:温度t1℃时,草酸亚铁晶体完全脱去结晶水,并生成草酸亚铁(FeC2O4)固体;温度t2℃时,草酸亚铁完全分解,发生反应:3FeC2O4Fe3O4+4CO↑+2CO2↑.
(1)根据化学方程式计算草酸亚铁晶体完全脱去结晶水生成FeC2O4的质量.
(2)求该草酸亚铁晶体中结晶水的质量.
(3)求该草酸亚铁晶体中铁元素的质量分数(精确到0.1%).