- 7.15 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
第3节 电解池 金属的电化学腐蚀与防护
一、电解池的工作原理
1.电解定义
使电流通过电解质溶液或熔融电解质而在______两极引起________反应的过程叫做电解。
注意:电解不同于电解质的电离,电离是电解的前提;电解质溶液导电的过程,就是电解质溶液的电解过程。
2.电解池
将____能转化为____能的装置叫做电解池。电解池是由____电源、固体电极材料以及电解质溶液或熔融电解质组成的。
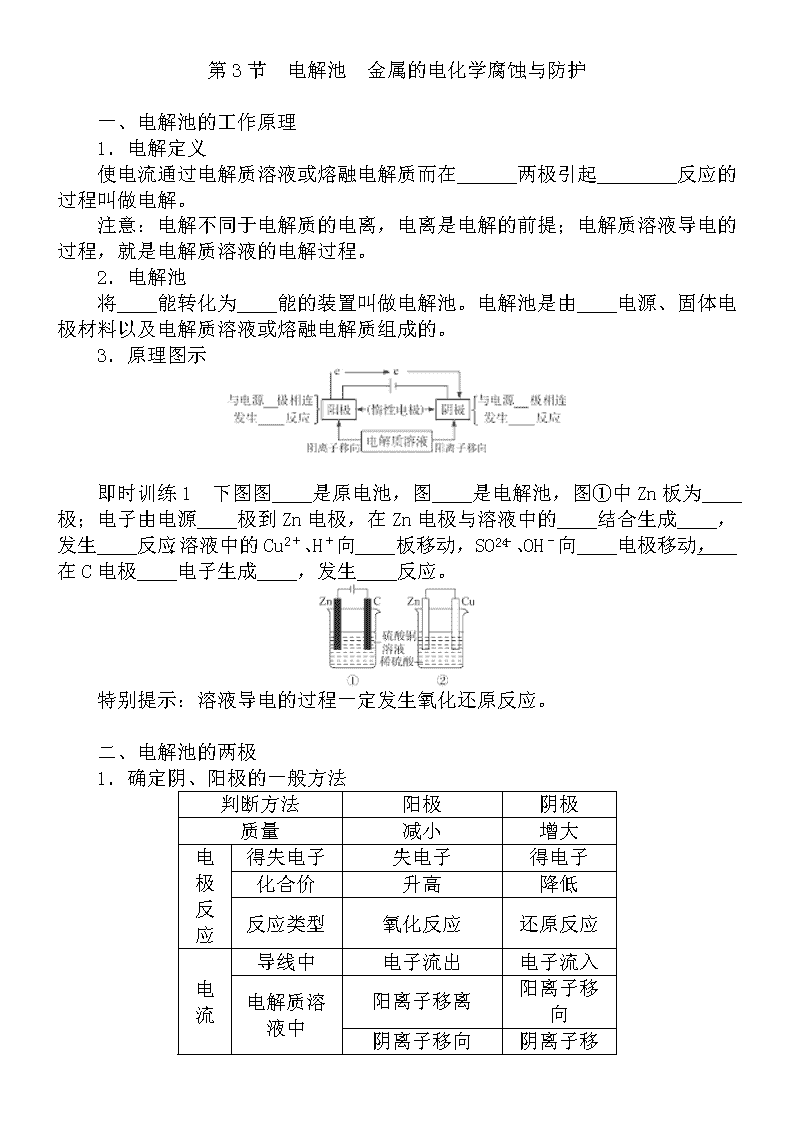
3.原理图示
即时训练1 下图图____是原电池,图____是电解池,图①中Zn板为____极;电子由电源____极到Zn电极,在Zn电极与溶液中的____结合生成____,发生____反应;溶液中的Cu2+、H+向____板移动,SO、OH-向____电极移动,____在C电极____电子生成____,发生____反应。
特别提示:溶液导电的过程一定发生氧化还原反应。
二、电解池的两极
1.确定阴、阳极的一般方法
判断方法
阳极
阴极
质量
减小
增大
电极反应
得失电子
失电子
得电子
化合价
升高
降低
反应类型
氧化反应
还原反应
电流
导线中
电子流出
电子流入
电解质溶液中
阳离子移离
阳离子移向
阴离子移向
阴离子移离
2.电极反应的书写步骤及方法
电解池电极反应的书写可总结为五步:一判、二看、三分、四写、五平。
一判:判断阴、阳极。
二看:阳极要看清电极材料。对于铁、铝、铜、银等活泼电极,则阳极金属电极失电子变成阳离子进入溶液(Fe变成Fe2+),阴离子不失电子;如果是惰性电极(Pt、Au、石墨等)材料,应是溶液中的阴离子失电子。
三分:将离子分成阳离子组、阴离子组(注意:水溶液中一定不要丢掉H+、OH-),阳离子向阴极移动,在阴极得电子;阴离子向阳极移动,在阳极失电子。根据得失电子能力对离子排序,得电子能力:Ag+>Fe3+>Cu2+>H+;失电子能力:S2->I->Br->Cl->OH->含氧酸根。(更详细见课本)
四写:由放电顺序及信息确定放电产物和电极反应。
五平:依据质量守恒、电荷守恒进行配平。
3.分析实验现象
(1)分析电极及电极区的pH及实验现象时,要从电极反应入手,如电解CuSO4溶液,阳极发生4OH--4e-===2H2O+O2↑,OH-浓度减小,酸性增强;
(2)分析电解质溶液中的pH及实验现象时,要从电池反应入手,如电解CuSO4溶液,2CuSO4+2H2O===2Cu+2H2SO4+O2↑,所以整个电解质溶液中酸性增强。
【例2-1】(1)KIO3可用电解的方法制得,原理是:以石墨为阳极,以不锈钢为阴极,在一定温度和碱性条件下电解KI溶液。总反应方程式为 KI+3H2O===KIO3+3H2↑,则阳极的电极反应为_____________;阴极附近pH______(填“增大”“减小”或“不变”)。
(2)科学家P.Tatapudi等人首先使用在酸性条件下用惰性电极电解水的方法制得臭氧。臭氧在阳极周围的水中产生,其电极反应为__________________________;阴极附近的氧气则生成过氧化氢,其电极反应为_______________________________________________。
方法归纳
(1)电极反应的书写首先根据题干要求及信息大胆写出反应物和生成物,然后根据“阴得阳失”加上得失电子数目,最后根据电解质溶液酸碱性补上H+、OH-或H2O,依据电荷守恒配平。
(2)注意运用H+、OH-、H2O进行配平:电解池电极反应中,如果是H+、OH-放电,不论溶液酸碱性则一定写H+、OH-得、失电子,其他情况下酸性溶液中一定不能存在OH-,同理在碱性溶液中一定不能存在H+。
(3)判断电极附近溶液pH变化,可以通过一般经验进行判断:不论原电池还是电解池,如果pH发生变化,一般失电子的电极pH减小,得电子的电极pH增大。
【例2-2】 Na2FeO4
是一种既能杀菌、消毒,又能絮凝净水的水处理剂,其电解制法如图所示,请根据图示分析:Fe电极的电极反应为__________________________,与铁电极相连的为电源的__________极。
*
二、电解原理的应用
1.电解饱和食盐水
(1)电极反应:阳极:____________;
阴极:________________。
(2)电池总反应:__________________________。
(3)应用:工业制______、______、______。
2.电解精炼铜
(1)阳极:材料:______;电极反应:__________________________________________ _________________________________________________________________________。
(2)阴极:材料:__________;电极反应:____________________。
(3)电解液:________。
3.电镀池(如铁上镀铜)
(1)阳极:材料:__________;电极反应:________________________________。
(2)阴极:材料:__________;电极反应:________________________________。
(3)电解液:______________。
4.电冶金
冶炼Na、Mg、Al等活泼金属必须用电解法,原理:Mn++ne-===M,如:
(1)电解熔融的NaCl冶炼金属钠:
①阳极反应:________________;
②阴极反应:________________;
③电池总反应:______________。
(2)电解熔融的Al2O3冶炼金属铝:
①阳极反应:__________________;
②阴极反应:__________________;
③电池总反应:________________。
即时训练2 下列图示中关于铜电极的连接错误的是( )。
特别提示:电解精炼铜实际上是电镀铜的一个特例(往精铜上镀铜)。注意:①电解精炼铜时,由于阳极和阴极发生的电极反应不同,所以两极质量变化不同,但得失电子一定相同;②精炼过程中电解质溶液浓度变化——硫酸铜溶液的浓度逐渐减小,而电镀过程中电解质溶液浓度基本不变。
三、金属的腐蚀与防护
1.金属腐蚀的本质
金属原子____电子变为金属阳离子,金属发生____反应。
2.化学腐蚀与电化学腐蚀
类型
化学腐蚀
电化学腐蚀
概念
金属与接触到的干燥气体(如O2、Cl2等)或非电解质液体等直接发生化学反应引起的腐蚀
不纯金属与电解质溶液接触,会形成__________,____________的金属失去电子被氧化腐蚀
特点
__________电流产生
______电流产生
普遍性
金属的______腐蚀比较普遍,而且危害性大,腐蚀速率快
3.钢铁的析氢腐蚀与吸氧腐蚀
类型
析氢腐蚀
吸氧腐蚀
水膜酸性
负极反应
正极反应
电池反应
其他反应
_______________________________________________、Fe(OH)3→Fe2O3·xH2O(铁锈)
普遍性
____腐蚀更普遍
4.金属腐蚀由快到慢的规律
电解池的阳极>原电池的负极>化学腐蚀>原电池的正极>电解池的阴极。
5.金属的防护
一般有三条途径:
(1)改变金属内部组成结构,可以增强金属耐腐蚀的能力,如不锈钢。
(2)在金属表面覆盖一层保护层,如油脂、油漆、搪瓷、塑料、电镀金属、氧化成致密的氧化膜,以断绝金属与外界物质接触,达到耐腐蚀的效果。
(3)电化学保护法:牺牲阳极的阴极保护法、外加电流的阴极保护法。
即时训练3 下列叙述中正确的是______。
A.生铁比纯铁容易生锈与电化学腐蚀有关
B.将钢铁与电源的正极相连可以起到保护钢铁的作用
C.为保护地下钢管不受腐蚀,可使它与铜板相连
D.海轮外壳上镶入锌块,可减缓船体的腐蚀
E.钢铁析氢腐蚀与吸氧腐蚀均属于电化学腐蚀
F.金属被腐蚀的本质是金属发生了氧化反应
一、原电池、电解池的判断规律
1.从能量的角度分析
原电池:化学能转变为电能的装置。
电解池:电能转变为化学能的装置。
应用:由化学反应方程式设计原电池、电解池要从能量的角度分析。我们只能把能自发进行的放热的氧化还原反应设计成原电池,而只要是氧化还原反应(不论吸热还是放热)理论上均可设计成电解池,如Cu+2HCl===CuCl2+H2↑只能设计成电解池(如装置图A);Fe+2HCl===FeCl2+H2↑既能设计成电解池(如装置图B),也能设计成原电池(如装置图C)。
2.从装置图的角度分析
原电池:若无外接电源,可能是原电池,然后根据原电池的形成条件分析判定,主要思路是“三看”。
先看电极:两极是导体且活泼性不同。
再看溶液:两极插入电解质溶液中。
后看回路:形成闭合回路或两极接触。
电解池:若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。当阳极金属与电解池溶液中的金属阳离子相同则为电镀池,其余情况为电解池。
【例1】 图中,两电极上发生的电极反应如下:a极:2H++2e-===H2
↑,b极:Fe-2e-===Fe2+,则以下说法不正确的是( )。
A.该装置可能是电解池
B.溶液pH变大
C.a、b可能是同种电极材料
D.该过程中能量的转换一定是化学能转化为电能
三、电解类型及有关计算
1.用惰性电极电解电解质溶液
类型
电极反应特点
实例
电解对象
电解质浓度
pH
电解质溶液复原
电解水型
阴极:4H++4e-===2H2↑
阳极:4OH--4e-===2H2O+O2↑
NaOH
水
增大
增大
水
H2SO4
水
增大
减小
水
Na2SO4
水
增大
不变
水
电解电解质型
电解质电离出的阴、阳离子分别在两极放电
HCl
电解质
减小
增大
氯化氢
CuCl2
电解质
减小
略增大
氯化铜
放H2生碱型
阴极:H2O放H2生碱
阳极:电解质阴离子放电
NaCl
电解质和水
生成新
电解质
增大
氯化氢
放O2生酸型
阴极:电解质阳离子放电
阳极:H2O放O2生酸
CuSO4
电解质和水
生成新
电解质
减小
氧化铜
2.有关电化学的计算
原电池和电解池的计算包括两极产物的定量计算、溶液pH的计算、相对原子质量和阿伏加德罗常数测定的计算、根据电荷量求产物的量与根据产物的量求电荷量的计算等。无论哪类计算,均可概括为下列三种方法:
(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电荷量等类型的计算,其依据是阴、阳极得失电子数相等。
(2)根据总反应计算:先写出电极反应,再写出总反应式,最后根据总反应列比例式计算。
(3)根据关系式计算:根据得失电子守恒关系建立已知量与未知量之间的桥梁,建立计算所需的关系式。
【例3-1】 (2012吉林实验中学模拟)A、B、C三种强电解质,它们在水中电离出的离子为Na+、Ag+、NO、SO、Cl-,在如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙烧杯中c电极质量增加了10.8 g。常温下各烧杯中溶液的pH与电解时间t的关系如图所示。据此回答下列问题:
(1)M为电源的________极(填“正”或“负”),甲、乙两个烧杯中的电解质分别为__________、__________(填写化学式)。
(2)计算电极f上生成气体的物质的量为________ mol。
(3)写出乙烧杯中的电解反应方程式:____________________________________。
(4)若电解后甲溶液的体积为10 L,则该溶液的pH为________。
【例3-2】(2012江西南昌调研测试)将质量相等的银片和铂片分别作为阳极和阴极用来电解硝酸银溶液。
i.以电流为1 A通电10 min;
ii.10 min后,反接电源,以电流为2 A继续通电10 min;下列图像分别表示银电极质量、铂电极质量、电解池产生气体质量和电解时间的关系图。其中正确的是( )。
A.①③ B.①②③
C.②③④ D.①②③④
1.(高考集萃)下列叙述中不正确的是( )。
A.(2012山东理综)电解NaCl溶液得到22.4 L H2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)
B.(2012广东理综)自行车钢架生锈主要是电化学腐蚀所致
C.(2012浙江理综)在“镀锌铁皮的镀层厚度的测定”实验中,将镀锌铁皮放入稀硫酸,待产生氢气的速率突然减小,可以判断锌镀层已反应完全
D.(2012江苏化学)镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
2.(2012山东理综,13)下列与金属腐蚀有关的说法正确的是( )。
A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,CuZn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,ZnMnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
3.(2012安徽理综,11)某兴趣小组设计如下微型实验装置。实验时,先断开K2,闭合K1,两极均有气泡产生:一段时间后,断开K1,闭合K2,发现电流表A指针偏转。下列有关描述正确的是( )。
A.断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl-Cl2↑+H2↑
B.断开K2,闭合K1时,石墨电极附近溶液变红
C.断开K1,闭合K2时,铜电极上的电极反应式为:Cl2+2e-===2Cl-
D.断开K1,闭合K2时,石墨电极作正极
4.(2012浙江理综,10)以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
下列说法不正确的是( )。
A.在阴极室,发生的电极反应为:2H2O+2e-===2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO+2H+Cr2O+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1-
参考答案
基础梳理整合
一、1.阴、阳 氧化还原
2.电 化学 直流
3.正 氧化 负 还原
即时训练1
② ① 阴 负 Cu2+ Cu 还原 Zn C OH- 失 O2 氧化
【例2-1】 答案:(1)I--6e-+6OH-===IO+3H2O 增大
(2)3H2O-6e-===O3↑+6H+ O2+2H++2e-===H2O2
【例2-2】 答案:Fe+8OH--6e-===FeO+4H2O 正
二、1.(1)2Cl--2e-===Cl2↑ 2H++2e-===H2↑
(2)2NaCl+2H2O通电,2NaOH+Cl2↑+H2↑
(3)烧碱 氯气 氢气
2.(1)粗铜 Cu-2e-===Cu2+、Zn-2e-===Zn2+、Fe-2e-===Fe2+
(2)精铜 Cu2++2e-===Cu
(3)CuSO4溶液
3.(1)铜 Cu-2e-===Cu2+
(2)铁 Cu2++2e-===Cu
(3)CuSO4溶液
4.(1)①2Cl--2e-===Cl2↑ ②Na++e-===Na ③2NaCl(熔融)通电,2Na+Cl2↑
(2)①6O2--12e-===3O2↑ ②4Al3++12e-===4Al ③2Al2O3(熔融)4Al+3O2↑
即时训练2
C
三、1.失去 氧化
2.原电池 较活泼 无 有微弱 电化学
3.酸性较强 酸性较弱或中性 Fe-2e-===Fe2+ 2H++2e-===H2↑ O2+2H2O+4e-===4OH- Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2 4Fe(OH)2+O2+2H2O===4Fe(OH)3 吸氧
即时训练3
ADEF
核心归纳突破
【例1】 D
【例3-1】 答案:(1)负 NaCl AgNO3
(2)0.025
(3)4AgNO3+2H2O通电,4Ag+O2↑+4HNO3
(4)12
解析:由c电极质量增加可知c电极的电极反应为Ag++e-===Ag,c为阴极,所以a、b、c、d、e、f分别为阴极、阳极、阴极、阳极、阴极、阳极,M、N分别为负极、正极;乙烧杯中为AgNO3溶液,阳极发生4OH--4e-===O2↑+2H2O,电池反应为4Ag++2H2O通电,4Ag+O2↑+4H+,电解过程中pH减小;由pH变化可知A、C分别为NaCl、Na2SO4;生成n(Ag)=0.1 mol,所以转移0.1 mol电子,依据f电极电极反应4OH--4e-===O2↑+2H2O,可知生成0.025 mol O2,依据甲池中的电池反应2Cl-+2H2O通电,Cl2↑+H2↑+2OH-,可知生成n(OH-)=0.1 mol,c(OH-)=0.01 mol·L-1,c(H+)=1×10-12mol·L-1,pH=-lgc(H+)=12。
【例3-2】 A
演练巩固提升
1.A 解析:A选项,根据电解NaCl溶液的阴极反应:2H++2e-===H2↑,产生标准状况下22.4 L H2,转移2NA个电子,错误。