- 97.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
复习学案:铝及其化合物
王劲松
复习重点:
1.掌握金属Al及其重要化合物的主要性质、应用及其计算。
2.了解金属Al的冶炼原理。
知识梳理
一、铝的制取
1.铝元素位于周期表 、 族,是较活泼的金属元素,在自然界中以 态存在,在地壳中的含量占金属中的第 位,铝元素在地壳中主要存在的物质是 。
二、铝的性质
1.物理性质:铝是 色、带有金属光泽的固体,硬度较 ,具有良好的导电性、导热性和延展性。常温下,铝在空气中生成 (现象),因此常温下铝制品具有抗腐蚀的性能,但若遇到含有 的溶液,会受到破坏,不宜长期放置。
2.铝的化学性质:
写出相应的化学方程式或离子方程式
与非金属
O2
S
Cl2
与氧化物
Fe2O3
与酸反应
氧化性的酸
稀硝酸
H+
与强碱反应(NaOH)
与盐溶液反应
三.铝的制法:
铝的制法:
四.铝的用途:
制成种类繁多的轻质铝合金,在汽车、船舶、飞机、宇宙飞船等领域以及日常生活里的用途佷广,用作装饰品;纯铝作导线和电缆,制成铝箔,银粉防锈漆等。
五.铝的化合物
1、氧化铝
物理性质: 色 , 溶于水,熔点很 。属于 氧化物。
化学性质:
(1)与酸反应
与HCl反应 (离子方程式)
与H2SO4反应 (化学方程式)
(2)与强碱反应 (离子方程式)
用途:冶炼金属铝的原料,是一种较好的耐火材料,可制造耐火坩埚、耐火管和耐高温的实验仪器。
2.氢氧化铝
物理性质: 色 , 溶于水,有较强的 ,可用作 。
化学性质(典型的 氢氧化物)其电离方程式为
_________________________________
_______ ______________________ _
(1)热稳定性
(2)与酸反应
(3)与强碱反应
实验室制法: 实验室常用 和 反应制取氢氧化铝。
思考:能否用可溶性的铝盐与强碱反应制取Al(OH)3?
用途:医用的胃酸中和剂。
3.铝盐性质:
①铝盐溶液发生水解反应,使溶液呈酸性其离子方程式为
思考:明矾的化学式为 ,在日常生活中明矾用于 。
②铝盐与碱溶液反应
与强碱溶液发生反应离子方程式:
适量强碱:
过量强碱:
与弱碱(氨水)发生反应离子方程式:
思考:写出Al2(SO4)3溶液与Na2S、NaHCO3、Na2CO3溶液反应的离子方程式。
4.偏铝酸钠
化学式 ,
与少量盐酸反应的离子方程式:
与过量盐酸反应的离子方程式:
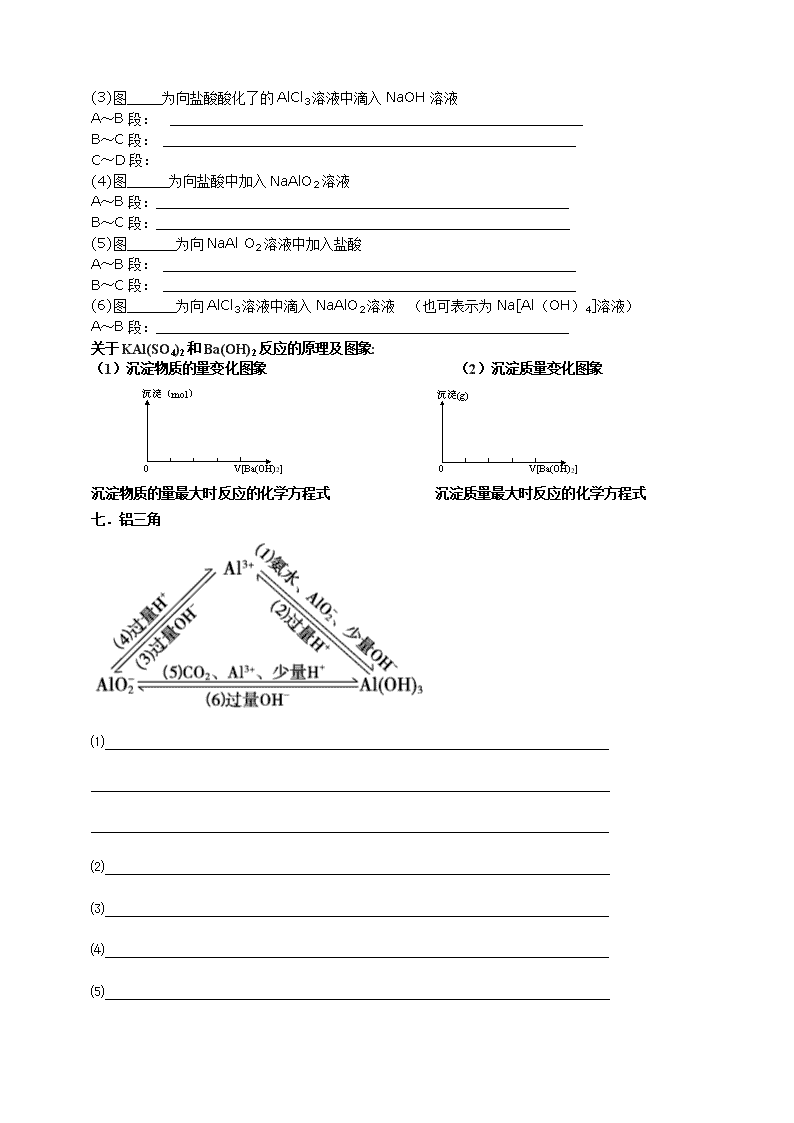
六.铝氢氧化物沉淀的图象
氢氧化铝沉淀量图象大致可以分为如图六类。[图中横坐标为加入试剂的体积]
(1)图 为向AlCl3溶液中滴人NaOH溶液
反应离子方程式:A~B段:
B~C段:
(2)图 为向NaOH溶液中滴入AlCl3溶液
反应离子方程式:A~B段
B~C段
(3)图 为向盐酸酸化了的AlCl3溶液中滴入NaOH溶液
A~B段:
B~C段:
C~D段:
(4)图 为向盐酸中加入NaAlO2溶液
A~B段:
B~C段:
(5)图 为向NaAl O2溶液中加入盐酸
A~B段:
B~C段:
(6)图 为向AlCl3溶液中滴入NaAlO2溶液 (也可表示为Na[Al(OH)4]溶液)
A~B段:
关于KAl(SO4)2和Ba(OH)2反应的原理及图象:
(1)沉淀物质的量变化图象 (2)沉淀质量变化图象
沉淀(g)
0 V[Ba(OH)2]
沉淀(mol)
0 V[Ba(OH)2]
沉淀物质的量最大时反应的化学方程式 沉淀质量最大时反应的化学方程式
七. 铝三角
⑴
⑵
⑶
⑷
⑸
⑹
八.铝及其化合物的转化关系
⑴
⑵
⑶
⑷
⑸
⑹
⑺
⑻
⑼
⑽
⑾
⑿
⒀
⒁
⒂
⒃
试题枚举
【例1】1989年世界卫生组织把铝确定为食品污染源之一,加以控制使用,铝在下列应用时应加以控制的是 ( )
①制铝合金 ②制电线 ③制炊具 ④明矾净水 ⑤明矾和苏打制食品膨松剂 ⑥用氢氧化铝凝胶制胃舒平药品 ⑦银色漆颜料 ⑧制易拉罐 ⑨包装糖果和小食品
A.全部 B.③⑤⑧⑨ C.⑥⑧⑨ D.③④⑤⑥⑧⑨
【例2】在下列各物质中,加入过量盐酸后,最终不产生沉淀或浑浊的是
A.偏铝酸钠溶液 B.苯酚钠溶液 C.硅酸钠溶液 D.硫代硫酸钠溶液
【变式】将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
【例3】将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是
A.3mol/LHCl B.4mol/LHNO3 C.8mol/LNaOH D.18mol/LH2SO4
【例4】甲、乙两烧杯中各盛有100mL3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
A.5.4g B.3.6g C.2.7g D.1.6g
【变式】 氢化钠是一种离子晶体,它与水反应时生成氢氧化钠和氢气,现有氢化钠和铝粉m g,与足量的水反应后铝无剩余,若收集到氢气n g,则混合物中铝粉的质量为:( )
A.36n-3m B.m-24n/5 C.12n-m D.24m-5n
【例5】若在加入铝粉能放出氢气的溶液中,分别加入下列各组离子,可能共存的是
A.NH4+ NO3- CO32- Na+ B.Na+ Ba2+ Mg2+ HCO3-
C.NO3- Ca2+ K+ Cl- D.NO3- K+ AlO2- OH-
【例6】已知Ba(AlO2)2可溶于水。右图表示的是向A12(SO4)3溶液中逐滴加入Ba(OH)2溶液时,生成沉淀的物质的量y与加人Ba(OH)2的物质的量x的关系。下列有关叙述正确的是
A.a—b时沉淀的物质的量:A1(OH)3比BaSO4多
B.c—d时溶液中离子的物质的量:AlO2-比Ba2+多
C.a—d时沉淀的物质的量: BaSO4可能小于A1(OH)3
D.d—e时溶液中离子的物质的量:Ba2+可能等于OH-
X物质的量
沉淀量
【例7】将溶液(或气体)X,逐渐加入(或通入)到一定量的Y溶液中,产生沉淀的量与加入X物质的量的关系如图,符合图中情况的一组物质是
A
B
C
D
X
H2S
HCl
NH3
NH3.H2O
Y
Na2SO3
NaAlO2
AlCl3
AgNO3
w.w.w.k.s.5.u.c.o.mwww.ks5u.comw.w.w.k.s.5.u.c.o.m www.ks5u.com
试题答案
1.解析: “D”中所涉及的铝与进入食品、饭、水等中,并被人体吸收,所以要加以控制。
答案: D
2.解析:各选项中产物依次为Al(OH)3、C6H5OH、H2SiO3、S。但Al(OH)3是两性氢氧化物,能溶于过量的盐酸中。
答案:A
3.解析:在镁、铝混合物中加入HNO3和浓H2SO4(两物质均具有强氧化性)都不能产生H2,加入NaOH溶液只有Al与NaOH溶液反应生成H2而与Mg不反应。而加入HCl,Mg和Al都与盐酸反应生成H2,所以H2量最多。
答案:A
4.解析:根据铝与盐酸和氢氧化钠溶液反应的方程式判断,若在含等物质的量的HCl和NaOH溶液中分别加入足量的铝粉,产生的H2之比为1:3。而题中为1:2,说明铝粉的量相对盐酸是过量的,而对NaOH是不足的。与前者反应的铝粉是2.7g,则与后者反应的铝粉应为5.4g。
答案:A
5.解析:铝粉加入酸溶液或强碱溶液中均可放出H2,A中NH4+与OH-不能大量共存,CO32-不能与H+大量共存;B中HCO3-既能与H+反应又能与OH-反应;C、D在强碱条件下可以共存。
答案:D
6.解析:设A12(SO4)3溶液中含1mol A12(SO4)3,既含2molAl3+和3molSO42-。
[o-a-b] 离子反应:2molAl3+ + 3molSO42- + 3Ba2+ + 6OH- = 3BaSO4↓+2Al(OH)3↓
沉淀为BaSO4 和Al(OH)3 其物质的量之比为 3:2 。b点达最大值,为5mol,此时加入的Ba(OH)2为3mol
(b-c-d )加入的Ba(OH)2,仅OH- 参与离子反应: 2Al(OH)3 + 2OH- = 2AlO2- + 4H2O 每消耗2mol OH—则生成2AlO2-,是留在溶液中Ba2+的两倍。沉淀混合物中Al(OH)3随加入的Ba(OH)2不断溶解.当加入的Ba(OH)2为4mol时, Al(OH)3沉淀恰好溶解完。d点沉淀达最小值组成全为BaSO4, 既y=3mol ,x=4mol. 此时,若不考虑AlO2-的水解,反应后溶液中溶质仅为1mol Ba(AlO2)2, 既 1mol Ba2+ 和 2molAlO2-
[d-e---] 再加入的Ba(OH)2 不发生离子反应,沉淀量不变,只是增加了溶液中的Ba2+和OH- 离子.显然,当再加入1mol Ba(OH)2 ,既x=5mol ,此时溶液中的n(Ba2+)=1mol+1mol=2mol, n(OH-)=2mol , 两种离子的物质的量相等.
答案:B D.
7.解析:由图可知,B中加入试剂1份,沉淀完全,再加入3份,
沉淀全溶解。
NaAlO2+HCl+H2O=Al(OH)3↓+NaCl Al(OH)3+3HCl=AlCl3+3H2O
A中二者反应生成S,继续通入不溶解;C中通入NH3生成沉淀,继续通入也不溶;而D中AgNO3AgOH↓[Ag(NH3)2]++OH-。
答案:B