- 689.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2012年全国新课标理综高考模拟信息卷(二)
化学试题
可能用到的相对质子质量:H-1 C-12 N-14 O-16 S-32 Cl-35.5 Fe-56 Cu-64
第Ⅰ卷 (选择题,共48分)
一、选择题:(每小题3分,每小题只有一个选项符合题意)
1.“化学—我们的生活,我们的未来”。下列有关知识叙述正确的是 ( )
A.苯酚不能用于杀菌消毒 B.氢气是未来的理想燃料
C.人体缺铁易引起甲状腺肿大 D.乙醇是不可再生的生物质能源
2.下列有关化学用语表示正确的是( )
A.N2的电子式: [来源:Z.xx.k.Com]
B.S2-的结构示意图:
C.质子数为53,中子数为78的碘原子:131 53I
D.邻羟基苯甲酸的结构简式:
3.下列离子方程式书写正确的是 ( )
A.将过量的NaOH溶液滴入同浓度的少量Ca(HCO3)2溶液中:
B.向Ba(OH)2溶液中逐滴加入NH4HSO4溶液至刚好沉淀完全:
C.向Ca(ClO)2溶液中通入适量SO2:
D.向FeI2溶液中加少量氯水:
4.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.在铜和稀硝酸的反应中,当转移NA个电子时,产生气体的体积约为11.2L
B.常温常压下,49gH2SO4所含的原子数为3.5NA
C.标准状况下,0.5NA个Br2分子所占的体积约为11.2L
D.常温常压下,将0.5molHI气体和0.5molCl2混合后,气体的分子总数为NA
5.下列各组离子一定能大量共存的是( )
A.在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+
B.在pH=12的溶液中:NH+4、K+、ClO-、Cl-
C.有NO-3存在的强酸性溶液中:NH+4、Ba2+、Fe2+、Br-
D.在碳酸氢钠的溶液中:K+、SO2-4、Cl-、CO2-3
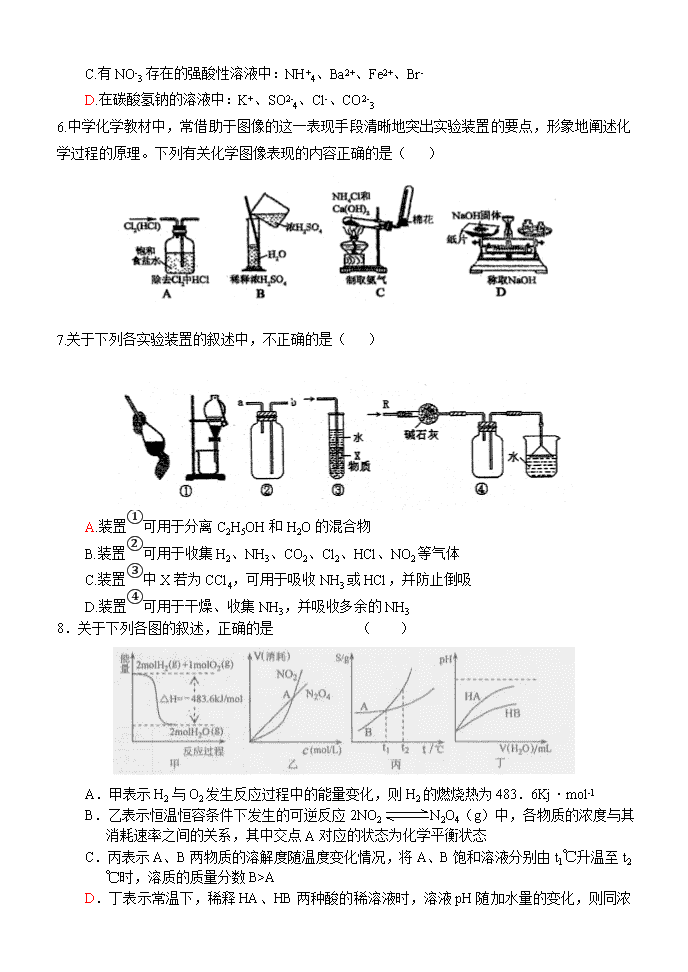
6.中学化学教材中,常借助于图像的这一表现手段清晰地突出实验装置的要点,形象地阐述化学过程的原理。下列有关化学图像表现的内容正确的是( )
7.关于下列各实验装置的叙述中,不正确的是( )
A.装置①可用于分离C2H5OH和H2O的混合物
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体
C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸
D.装置④可用于干燥、收集NH3,并吸收多余的NH3
8.关于下列各图的叙述,正确的是 ( )
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6Kj·mol-l
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1℃升温至t2℃时,溶质的质量分数B>A
D
.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
9.查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-=X+2H+。下列说法中正确的是 ( )
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2=2CH3CHO+2H2O
10.三氯生是一种抗菌剂,其结构简式如图一5所示,遇含氯自来水能生成三氯甲烷。下列说法不正确的是 ( )
A.三氯生的分子式是C12H6Cl3O2
B.三氯甲烷与甲烷均无同分异构体
C.1mol三氯生最多能与6mol H2反应
D.1mol三氯生最多能与7mol NaOH反应
11. Na2FeO4是一种高效多功能水处理剂,应用前景广阔。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
A.Na2O2在反应中只作氧化剂
B.O2是还原产物
C.Na2FeO4既是氧化产物又是还原产物
D.2molFeSO4发生反应时,反应中共有8mol电子转移
12.下列叙述正确的是( )
A.电镀时,通常把待镀的金属制品作阳极
B.氯碱工业是电解熔融的NaCl,在阳极能得到Cl2
C.氢氧燃料电池(酸性电解质)中O2通入正极,
电极反应为O2+4H++4e—=2H2O
D.右图中电子由Zn极流向Cu,盐桥中的Cl—移向CuSO4溶液
13.已知M2O2-n离子可与R2-离子作用,R2-被氧化为R单质,在M2O2-n的还原产物中,M为+3价;又如c(M2O2-3)=0.3mol·L-1的溶液100mL可与c(R2-)=0.6mol·L-1的溶液150mL恰好完全反应,则n值为( )
A.4 B.5 C.6 D.7
14.将由FeSO4、Ba(OH)2、AlCl3三种固体组成的混合物溶于足量的水中,用玻棒搅拌,充分溶解,一段时间后,向稳定的混合物溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的物质的量关系如图所示。下列有关判断不正确的是( )
A.AB段发生反应的的离子方程式为:
Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O
B.D点表示的溶液呈酸性
C.C点表示的沉淀的化学式为Al(OH)3、BaSO4、Fe(OH)2
D.混合物中FeSO4和AlCl3的物质的量相等
15.常温下,用0.1000 mol/L NaOH溶液分别滴定20. 00 mL 0.1000 mol/L 盐酸和20. 00 mL 0.1000 mol/L 醋酸溶液,得到2条滴定曲线,如下图所示。
若以HA表示酸,下列说法正确的是( )
A.滴定盐酸的曲线是图2
B.达到B、D状态时,两溶液中离子浓度均为 c(Na+) = c(A—)
C.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
D.当0 mL< V(NaOH) <20. 00 mL时,对应混合溶液中各离子浓度由大到小的顺序均为 c(A—) >c(Na+)> c(H+) > c(OH—)
16.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
N2(g) + 3H2(g) 2NH3(g) △H=-92.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
容器编号
起始时各物质物质的量/mol
平衡时反应中的能量变化
N2
H2
NH3
①
1
3
0
放出热量a kJ
②
2
3
0
放出热量b kJ
③
2
6
0
放出热量c kJ
下列叙述正确的是 ( )
A.放出热量关系:a < b < 92.4
B.三个容器内反应的平衡常数:③ > ① > ②
C.达平衡时氨气的体积分数:① > ③
D.N2的转化率:② > ① > ③
2012年全国新课标理综高考模拟信息卷(二)
化学答题卷
第Ⅰ卷(每小题3分,共48分)
一、 选择题:(。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
第II卷(非选择题,共52分)
17.(14分)实验室常用的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气,如果用C装置,通常使用的药品是 。检查C装置气密性是否良好的操作方法是
。
若用B装置制取氨气,用化学方程式表示制取氨气的反应原理 。
(2)若用KMnO4与浓盐酸反应制取氯气,应选用的气体发生装置是 ,用离子方程式表示制取氯气的反应原理 。
(3)若用A装置与D装置相连制取收集X气体,则X可能是下列气体中的
①CO2 ②NO ③Cl2 ④H2
其中在D装置中连接小烧杯的目的是 。发生反应的离子方程式为 。
(4)下图是某同学设计收集氨气的几种装置,其中可行的是
18.(10分)近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,长伴有大量物质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:
__C+___K2Cr2O7+__H2SO4(稀 ) → ___CO2+__K2SO4+ Cr2(SO4)3+ __ ___
(1)完成并配平上述反应的化学方程式
(2)此反应的氧化剂______,还原剂______
(3)硫酸在上述反应中表现出的性质是____________(填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应若产生11g气体物质,则转移电子的数目___________
19.(10分)镁化合物具有广泛用途,请回答有关镁的下列问题:
(1)单质镁在空气中燃烧的主要产物是白色的______________,还生成少量的______________(填化学式);
(2)CH3MgCl是一种重要的有机合成剂,其中镁的化合价是_____________,该化合物水解的化学方程式为________________________________________ ;
(3)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。
[来源:Zxxk.Com ]
下列选项中正确的是_______________(填序号)。
①MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
②Mg与F2的反应是放热反应
③MgBr2与Cl2反应的△H<0
④化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
座号
⑤MgF2(s)+Br2(l)=MgBr2(s)+F2(g)△H=+600kJ·mol-1
20.(16分)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
c(mol/L)
0.8 5
1.00
0.50
0.25
0
3
10
t(min)
CO2
CH3OH
(1)① 把含有较高浓度CO2的空气通入饱和K2CO3溶液。
② 在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式 ________。
(2)如将CO2与H2 以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是 (填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
② 适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
从反应开始到平衡,v(H2)= ;氢气的转化率= ;能使平衡体系中n(CH3OH)增大的措施有 ________________。
(3)如将CO2与H2 以1:4的体积比混合,在适当的条件下可制得CH4。
已知:
CH4 (g) + 2O2(g) CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
H2(g) + 1/2O2(g) H2O(l) ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是 ________________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
溶解度(S)/g
溶度积(Ksp)
Ca(OH)2
Ba(OH)2
CaCO3
BaCO3
0.16
3.89
2.9×10-9
2.6×10-9
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是 [填“Ca(OH)2”或“Ba(OH)2”]溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定 ________ 。
21.Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大,Q与W组成的化合物是一种温室气体,W与Y、X与Y组成的化合物是机动车排出的大气污染物,Y和Z能形成原子个数比为1∶1和1∶2的两种离子化合物。
(1)W在元素周期表中的位置是 ,Z2Y的电子式是 。
(2)工业合成XQ3是放热反应。下列措施中,既能加快反应速率,又能提高原料转化率的是 。
a.升高温度 b.加入催化剂
c.将XQ3及时分离出去 d.增大反应体系的压强
(3)2.24 L(标准状况)XQ3被200 mL 1 mol/L QXY3溶液吸收后,所得溶液中离子浓度从大到小的顺序是 ________________。
(4)WQ4Y与Y2的反应可将化学能转化为电能,其工作原理
如右图所示,a极的电极反应式是 ________________。
(5)已知:W(s)+ Y2 (g)= WY2(g) ΔH=-393.5 kJ/mol
WY(g)+ Y2 (g)= WY2(g) ΔH=-283.0 kJ/mol
24 g W与一定量的Y2反应,放出热量362.5 kJ,所得产物的物质的量之比是 。
(6)X和Z组成的一种离子化合物,能与水反应生成两种碱,该反应的化学方程式是 ________________________________________。
22.(14分)已知A为中学化学中的一种盐,B、C为日常生活中常见的金属。通常条件下D、G为无色无味气体,G遇到空气即变为红棕色的气体。已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液。各物质之间的转化关系如下图(部分反应产物已略去)。
请回答下列问题:
(1)E的化学式为____________________。
(2)A溶液与Na2O2反应的总化学方程式为____________________。[来源:学*科*网]
(3)E的稀溶液与F溶液反应的离子方程式为____________________。
(4)电解100mL盐A的溶液一段时间后,断开电路,取出电极,测得所得到的气体D在标准状况下的体积为5.6mL,则电解后溶液的pH为__________。(假设溶液体积不变)
(5)若向100mL盐A的溶液中加入10g金属单质B的粉末,充分搅拌后,过滤,烘干得10.16g固体。则滤液中溶质的物质的量浓度为__________。(假设溶液体积不变)
2012年全国新课标理综高考模拟信息卷(二)
化学试题答案
第Ⅰ卷(每小题3分,共45分)
一、 选择题:(。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
答案
B
C
A
B
D
C
A
D
D
A
C
C
D
C
B
A
第II卷(非选择题,共52分)
二.非选择题
17.(14分)(1)浓氨水和氧化钙(或碱石灰、固体氢氧化钠等);(2分)
将导气管末端插入水槽中,用酒精灯微热或用手捂圆底烧瓶,导气管末端有气泡产生,停止加热或松开手后,导气管末端上升一段稳定的液柱,则说明气密性良好。(2分)
(2分)
(2)C(1分) (2分)
(3)③(1分) 吸收尾气,防止产生污染。(1分)
(2分)(4)d(1分)
18.(1)_3_C+__2_K2Cr2O7+__8H2SO4(稀 ) = __3_CO2+__2K2SO4+ 2Cr2(SO4)3+ _8_ H2O
(2). (2)此反应的氧化剂K2Cr2O7,还原剂C
(3)硫酸在上述反应中表现出的性质是________A____(填选项编号)
(4)转移电子的数目_NA_
19.(9分)(1)MgO , Mg3N2;(2)+2, ;
(3)①②③⑤(填序号)。
20.(16分)(1)② 2KHCO3K2CO3+H2O+CO2↑
(2)① B
② v(H2)=0.24 mol/(L·min) 80%
降低温度(或加压或增大H2的量等)
(3)CO2(g) + 4H2(g) CH4 (g)+ 2H2O(l) ΔH1= +318.7 kJ/mol
(4)Ba(OH)2 BaCO3的质量
21.(1)(2分)第二周期IVA族
(2分)
(2)(2分)d
(3)(2分)c(NO3-)>c(H+)>c(NH4+)>c(OH-)
(4)(2分)CH3OH- 6e-+ 8OH-=CO32-+ 6H2O
(5)(2分)n(CO2)∶n(CO)=1∶3
(6)(2分)Na3N + 4H2O=3NaOH + NH3·H2O
22.(14分) (1)HNO3
(2)2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2↓+4NaNO3+O2↑
(3)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
(4)2
(5)0.2mol/L
14.【解析】不正确的为C项:三种固体组成的混合物溶于足量的水中,用玻璃棒搅拌,充分溶解,一段时间,FeSO4+Ba(OH)2=BaSO4↓+Fe(OH)2↓,4Fe(OH)2+2H2O+O2=4Fe(OH)3,Al3+可与OH-反应,则C点沉淀的化学式为Al(OH)3、BaSO4、Fe(OH)3。
根据图象知,未加H2SO4前:,n[Fe(OH)3]=n(BaSO4)=0.01mol,共0.02mol,此时Al3+变为AlO2-,可知n(FeSO4)=0.01mol;又由最终沉淀0.05mol知:n[Ba(OH)2]=0.05mol。
A→B:Ba2++SO42-=BaSO4↓,OH-+H+=H2O
由C→E共消耗30mLH2SO4,而0.01molFe(OH)3消耗15mLH2SO4,可知Al(OH)3消耗15mLH2SO4,判定n[Al(OH)3]=n[Fe(OH)3]=0.01mol,可知:n(AlCl3)=0.01mol。综上分析,A、B、D均正确。