- 322.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2013年高考理综化学试题及答案(全国Ⅰ卷)
本试卷分第I卷和第II卷两部分,满分240分。考试用时150分钟。答题前考生务必用0.5mm黑色签字笔,将自己的姓名、座号、准考证号、考场号、学校和科类填写在试卷和答题卡规定的位置。考试结束,将本试卷和答题卡一并交回。
第I卷(必做,共87分)
可能用到的相对原子质量:H l C l2 N 14 O 16 Mg 24 S 32 K 39 Mn 55
一、选择题:本题共l3小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学无处不在,下列与化学有关的说法不正确的是
A.侯氏制碱法的工艺过程中应用了物质溶解度的差异
B.可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气
C.碘是人体必需微量元素,所以要多吃富含高碘酸的食物
D.黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成
8.香叶醇是合成玫瑰香油的主要原料,其结构简式如下:下列有关香叶醇的叙述正确的是
A.香叶醇的分子式为C10H18O
B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色
D.能发生加成反应不能发生取代反应
9.短周期元素W、X、Y、Z的原子序数依次增大,其简单离子都能破坏水的电离平衡的是
A.w2-、X+ B.X+、Y3+ C.Y3+、Z2- D.X+、Z2-
10.银质器皿日久表面会逐渐变黑,这是生成了Ag2S的缘故。根据电化学原理可进行如下处理:在铝质容器中加入食盐溶液,再将变黑的银器浸入该溶液中.一段时间后发现黑色会褪去。下列说法正确的是
A.处理过程中银器一直保持恒重 B.银器为正极,Ag2S被还原生成单质银
C.该过程中总反应为2Al+3Ag2S==6Ag+Al2S3 D.黑色褪去的原因是黑色Ag2S转化为白色AgCl
11.已知Ksp(AgCl) = 1.56×10-10,Ksp(AgBr) = 7.7×10-13,Ksp(Ag2CrO4) = 9.0×10-12。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42- B.CrO42-、Br-、Cl- C.Br-、Cl-、CrO42- D.Br-、CrO42-、Cl-
12.分子式为C5H10O2的有机物在酸性条件下可水解为酸和醇,若不考虑立体异构,这些醇和酸重新组合可形成的醇共有
A.15种 B.28种 C.32种 D.40种
13.下列实验中,所采取的分离方法与对应原理都正确的是
选项
目的
分离方法
原理
A.
分离溶于水中的碘
乙醇萃取
碘在乙醇中的溶解度较大
B.
分离乙酸乙醇和乙醇
分液
乙酸乙醇和乙醇的密度不同
C.
除去KNO3固体中混杂的NaCl
重结晶
NaCI在水中的溶解度很大
D.
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
26.(13分)
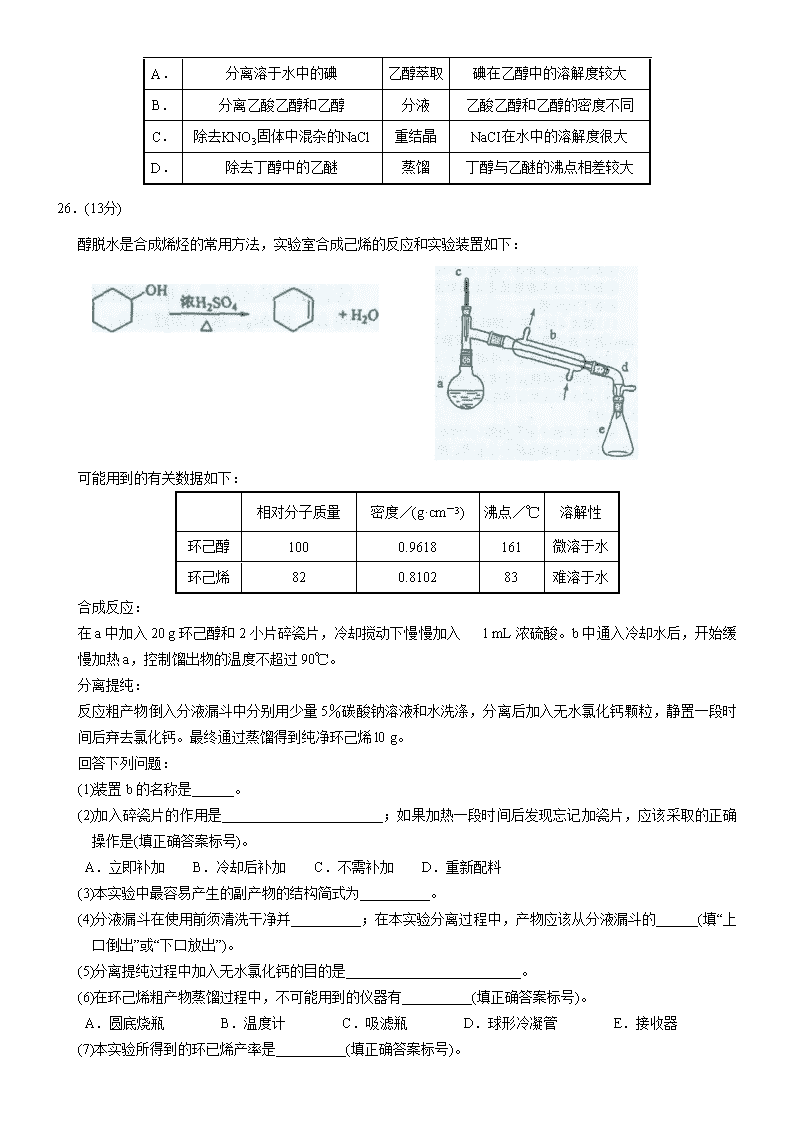
醇脱水是合成烯烃的常用方法,实验室合成己烯的反应和实验装置如下:
可能用到的有关数据如下:
相对分子质量
密度/(g·cm-3)
沸点/℃
溶解性
环己醇
100
0.9618
161
微溶于水
环己烯
82
0.8102
83
难溶于水
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入 1 mL浓硫酸。b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯l0 g。
回答下列问题:
(1)装置b的名称是______。
(2)加入碎瓷片的作用是_______________________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是(填正确答案标号)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为__________。
(4)分液漏斗在使用前须清洗干净并__________;在本实验分离过程中,产物应该从分液漏斗的______(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是_________________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有__________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环已烯产率是__________(填正确答案标号)。
A.41% B.50% C.61% D.70%
27.(15分)
锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-==LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。
(1)LiCoO2中,Co元素的化合价为______。
(2)写出“正极碱浸”中发生反应的离子方程式____________________。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式____________;可用盐
酸代替H2SO4和H2O2的混合液,但缺点是__________。
(4)写出“沉钴”过程中发生反应的化学方程式__________________________。
(5)充放电过程中,发生LiCoO2与LixCoO2之间的转化,写出放电时电池反应方程式___________________。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是________________________。在整个回收工艺中,可回收到的金属化合物有_________________(填化学式)。
28.(15分)
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g)+2H2(g)==CH3OH(g) △H1 = -90.1kJ·mol-1
(ii)CO2(g)+3H2(g)==CH3OH(g)+H2O(g) △H = -49.0kJ·mol-1
水煤气变换反应:
(iii)CO(g)+H2O(g)==CO2(g)+H2(g) △H = -41.1kJ·mol-1
二甲醚合成反应:
(iv)2CH3OH(g)==CH3OCH3(g)+H2O(g) △H = -24.5kJ·mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铅土矿制备较高纯度Al2O3的主要工艺流程是__________________________(以化学方程式表示)。
(2)分析二甲醚合成反应(iv)对于CO转化率的影响_______________________。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为__________________。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响____________________。
(4)有研究者在催化剂(含Cu-Zn-Al-O和Al2O3)、压强为5.0 MPa的条件下,由H2和CO
直接制备二甲醚,结果如右图所示。其中CO转化率随温度升高而降低的原因是__________。
(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度高于甲醇直接燃料电池(5.93 kw·h·kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为_________,一个二甲醚分子经过电化学氧化,可以产生______个电子的电量;该电池的理论输出电压为1.20 V,能量密度E = ______(列式计算。能量密度 = 电池输出电能/燃料质量,lkW·h = 3.6×106J)。
第Ⅱ卷【必做部分129分】
36.[化学——选修2:化学与技术](15分)
草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如右:
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为______________、______________。
(2)该制备工艺中有两次过滤操作,过滤操作①的滤液是__________,滤渣是__________;过滤操作②的滤液是__________和__________,滤渣是__________。
(3)工艺过程中③和④的目的是______________________。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是__________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250 g溶于水,用0.0500 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为____________;列式计算该成品的纯度____________。
37.[化学——选修3:物质结构与性质](15分)
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为______,该能层具有的原子轨道数为______、电子数为____。
(2)硅主要以硅酸盐、______等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以______相结合,其晶胞中共有8个原子,其中在面心位置贡献______个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为______________________。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
化学键
C—C
C—H
C一O
Si—Si
Si—H
Si一O
键能/(kJ·mol-1)
356
413
336
226
318
452
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是_____________。
②SiH4的稳定性小于CH4,更易生成氧化物,原因是__________________________。
(6)在硅酸盐中,SiO44-四面体(如下图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为__________。Si与O的原子数之比为__________________。
38.[化学——选修5:有机化学基础](15分)
查尔酮类化合物G是黄酮类药物的主要合成中间体,其中一种合成路线如下:
已知以下信息:
①芳香烃A的相对分子质量在100~110之间,1 mol A充分燃烧可生成72 g水。
②C不能发生银镜反应。
③D能发生银镜反应、可溶于饱和Na2CO3溶液、核磁共振氢谱显示其有4种氢。
回答下列问题:
(1)A的化学名称为____________。
(2)由B生成C的化学方程式为________________________________。
(3)E的分子式为__________,由E生成F的反应类型为________________________。
(4)G的结构简式为________________。
(5)D的芳香同分异构中,既能发生银镜反应,又能发生水解反应,H在酸催化下发生水解反应的化学方程式为____________________。
(6)F的同分异构体中,既能发生银镜反应,又能与FeCl3溶液发生显色反应的共有______种,其中核磁共振氢谱为5组峰,且峰面积比为2:2:2:l:1的为_________________(写结构简式)。
参考答案
7.C 8.A 9.C 10.B 11.C 12.D 13.D
26.(13分)
(1)直形冷凝管 (2)防止暴沸 B (3)
(4)检漏 上口倒出 (5)干燥(或除水除醇) (6)CO (7)C
27.(15分)
(1)+3 (2)2A1+20H-+6H2O==2Al(OH)4-+3H2↑
(3)2LiCoO2+3H2SO4+H2O2Li2SO4+2CoSO4+O2↑+4H2O
2H2O22H2O+O2↑
有氯气生成,污染较大
(4)CoSO4+2NH4HCO3==CoCO3↓+(NH4)2SO4+H2O+CO2↑
(5)Li1-xCoO2+LixC6==LiCoO2+6C
(6)Li+从负极中脱出,经由电解质向正极移动并进入正极材料中
Al(OH)3、CoCO3、Li2SO4
28.(15分)
(1)A12O3(铝土矿)+2NaOH+3H2O==2NaAl(OH)4
NaAl(OH)4+CO2==Al(OH)3↓+NaHCO3 2Al(OH)3Al2O3+3H2O
(2)消耗甲醇,促进甲酵合成反应(i)平衡右移,CO转化率增大;生成的H2O,通过水煤气变换反应(iii)
消耗部分CO
(3)2CO(g)+4H2(g)==CH3OCH3(g)+H2O(g) △H = -204.7 kJ·mol-1
该反应分子数减少,压强升高使平衡右移,CO和H2转化率增大,cH3OCH3产率增加。压强升高使CO和H2浓度增加,反应速率增大。
(4)反应放热,温度升高。平衡左移
(5)CH3OCH3+3H2O==2CO2+12H++12e- 12
36.[化学——选修2:化学与技术](15分)
(2)NaOH溶液 CaC2O4 H2C2O4溶液 H2SO4溶液 CaSO4
(3)分别循环利用氢氧化钠和硫酸(降低成本),减小污染 (4)Na2SO4
(5)5C2O42-+2MnO4-+16H+==2Mn2++8H2O+10CO2↑
37.[化学——选修3:物质结构与性质](15分)
(1)M 9 4 (2)二氯化硅 (3)共价键 3
(4)Mg2Si+4NH4Cl==SiH4+4NH3+2MgCl2
(5)①C—C键和C—H键较强,所形成的烷烃稳定。而硅烷中Si—Si键和Si—H键的键能较低,易断裂。导致长链硅烷难以生成
②C—H键的键能大于C—O键,C一H键比C—O键稳定。而Si—H键的键能却远小于Si—O键,所以Si—H键不稳定而倾向于形成稳定性更强的Si—O键
(6)sp3 1:3 [SiO3]n2n-(或SiO32-)
38.[化学——选惨5:有机化学基础](15分)
(1)苯乙烯 (2) (3)C7H5O2Na 取代反应
(4)(不要求立体异构)
相关文档
- 高考英语总复习专题对点真题练5短2021-05-1315页
- 高考英语一轮复习 精选阅读理解文2021-05-131页
- 高考一轮复习区域生态环境建设与区2021-05-136页
- 从近三年高考作文题型变化透视作文2021-05-1313页
- 人教高考化学一轮选练习题9及答案2021-05-135页
- 高考化学总复习 从实验学化学 归纳2021-05-135页
- 精品文档龙岗区2006-教学质量年报高2021-05-13181页
- 高考物理年末一模联考新题精选分类2021-05-1311页
- 新课标全国卷高考文科数学试题和答2021-05-1311页
- 新课标高考历史强化复习讲义94 2021-05-1314页