- 400.50 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考专题复习——气体的制备装置
---试验装置分解
华油三中 杨亚平
高中化学中气体制备装置一般分四大部分:发生装置,净化装置(干燥装置),收集装置,尾气处理装置。
一、气体的发生装置
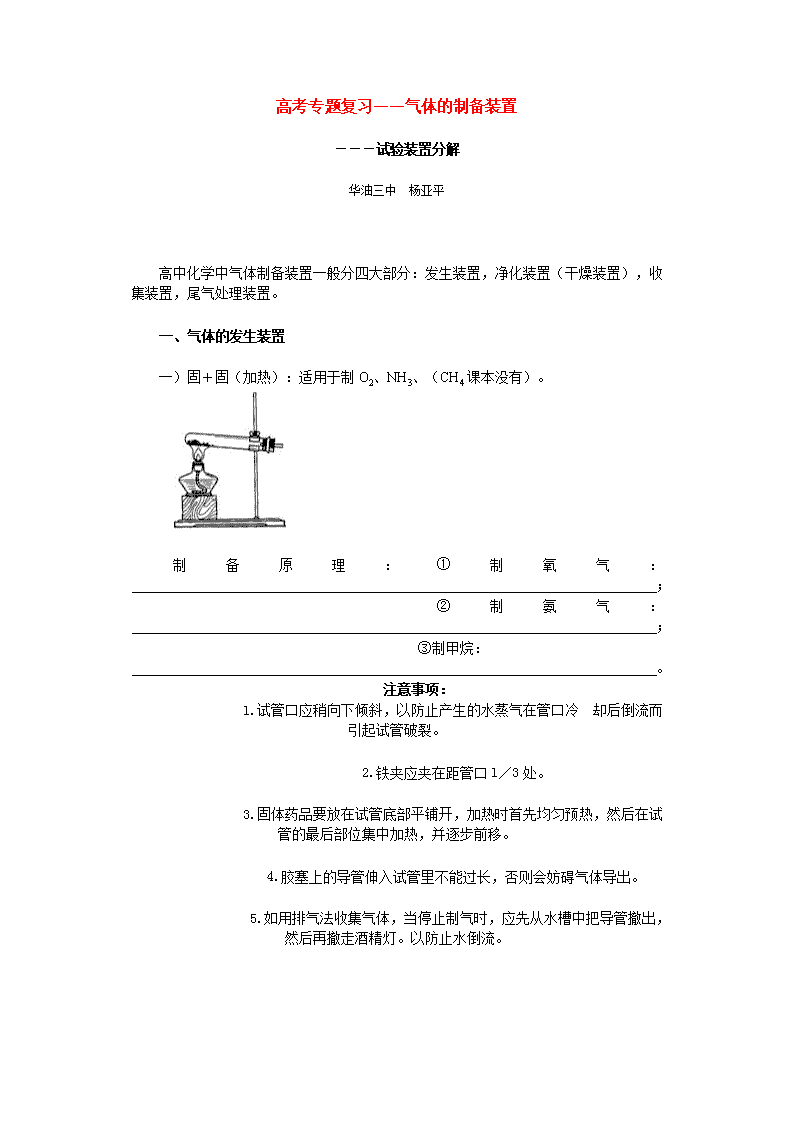
一)固+固(加热):适用于制O2、NH3、(CH4课本没有)。
制备原理:①制氧气: ;
②制氨气: ;
③制甲烷: 。
注意事项:
l.试管口应稍向下倾斜,以防止产生的水蒸气在管口冷 却后倒流而引起试管破裂。
2.铁夹应夹在距管口l/3处。
3.固体药品要放在试管底部平铺开,加热时首先均匀预热,然后在试管的最后部位集中加热,并逐步前移。
4.胶塞上的导管伸入试管里不能过长,否则会妨碍气体导出。
5.如用排气法收集气体,当停止制气时,应先从水槽中把导管撤出,然后再撤走酒精灯。以防止水倒流。
二)固+液体(不加热):适用于制CO2、C2H2、H2 、H2S(SO2、NO2、NO课本没有制法)。
(一)常规类
制备原理:①制CO2: ;
②制C2H2: ;
③制H2: ;
④制SO2、NO2、H2S、NO: 。
注意事项:1.瓶内气密性要好。
2.先放固体后加液体。(为什么?)
3.加入酸的量要适当。
4.生成气体微溶或难溶于水。
(二)启普发生器类
制备原理: ①制CO2: ;
②制H2:
;
③制H2S: 。
注意事项:1.在简易装置中长颈漏斗的下口应深入液面以下,否则起不到液封的作用而无法使用。
2.加入大小适宜不溶于水的块状固体,如果太碎会落入底部的酸中使反应无法控制。造成容器内压力过大,导致酸液溢出。
3.加人酸的量要适当。
4.在导管口点燃氢气或其它可燃性气体时,必须先检验纯度。
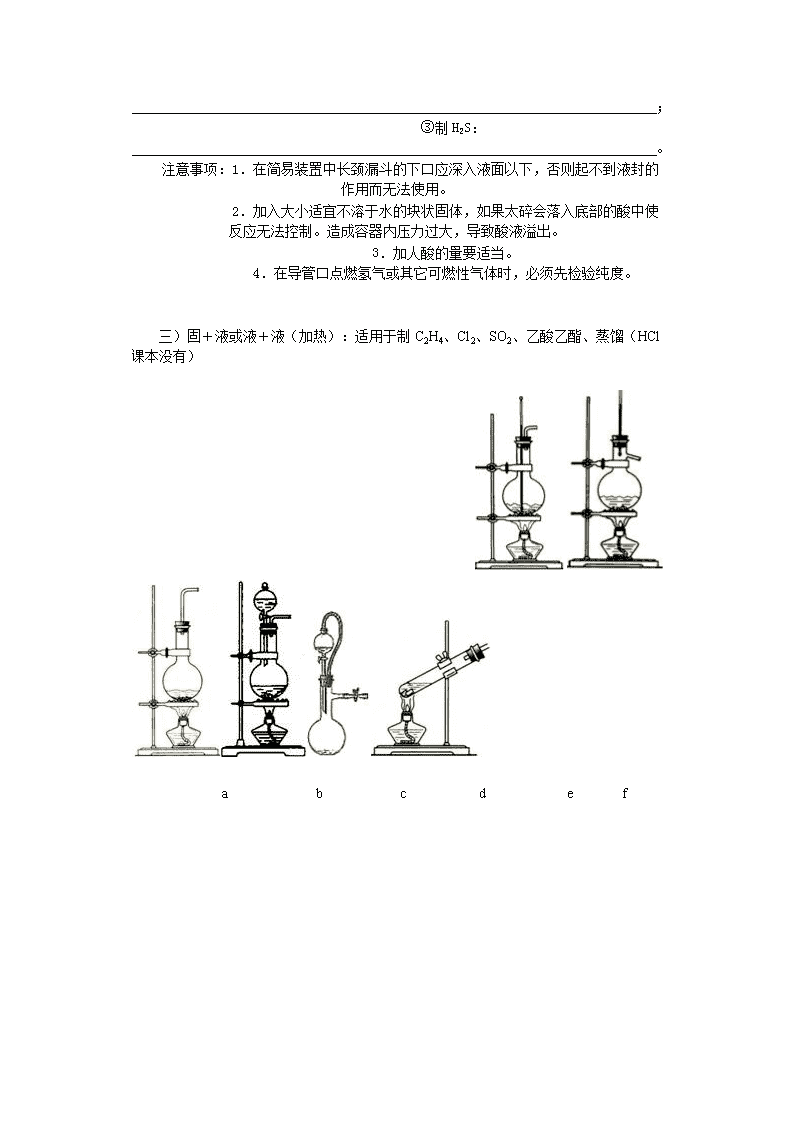
三)固+液或液+液(加热):适用于制C2H4、Cl2、SO2、乙酸乙酯、蒸馏(HCl课本没有)
a b c d e f
注意点:
1、用KMnO4制取O2时,为了防止生成的细小颗粒堵塞导管,在大试管口放一松软棉花。
2、实验室制取氨气时,由于氨气极易与空气中的水结合,导致外部空气向试管里“冲”,里面氨气向外逸出,在小试管口放一疏松棉花。
3、在制取C2H2时,若用大试管为反应器时,在大试管口放一松软棉花,防止生成的泡沫喷出。
4、Cu和浓硫酸制取SO2做性质试验的小试管口堵一块蘸有少量碱液的棉花防止污染。
二、气体的净化(干燥)装置
(一)常见净化原理:气体的净化可分为物理方法和化学方法。遵循以下原理:
①不损失主体气体;②不引入新杂质;③在密闭容器中进行;④先除易除的气体。
1.物理方法:
(1)液化法:利用沸点不同从空气中分离N2和O2。
(2)水洗法:利用溶解度不同从N2和NH3中除去NH3;从NO和NO2中除去NO2。
△
2.化学方法:
(1)氧化还原法:灼热铜丝网除去混合物中的O2(2Cu+O2=2CuO);CuO除去H2、CO等。
(2)酸碱法:NH3和CO2通过碱石灰除去CO2。(CaO+CO2=CaCO3)
(3)沉淀法:除去CO2中的H2S通过CuSO4溶液。H2S+CuSO4=CuS↓+H2SO4
(4)最常用的为洗气法:
①用饱和NaCl除去Cl2中的HCl;
②用饱和NaHCO3除去CO2中的HCl、SO2等;
③用酸性高锰酸钾除去气体中的SO2;(如CO2中的SO2)
注意:以下考得比较少:
④用饱和NaHSO3除去SO2中的SO3;[浓硫酸也可除SO3(SO3易溶于浓硫酸)];冷却同样可以除SO3。
⑤用饱和Na2CO3溶液除去乙酸乙酯中的乙醇或乙酸;
(二)常见净化装置
a b c d e
a为加热固态试剂以除去气体中杂质的装置,为防止固体“流动”,两端用石棉或玻璃棉堵住,但要使气流通畅。b、c、d一般盛液体药品,用于洗液。e一般盛固体药品,往往根据增重可测出吸收物质的质量,用于定量计算。
(三)常见干燥剂及气体的干燥
液态干燥剂
固态干燥剂
装置
常见干燥剂
浓硫酸
无水氯化钙
碱石灰
可干燥气体
H2、O2、Cl2、SO2、CO2、CH4、N2、CO
H2、O2、Cl2、SO2、CO2、CH4、N2、CO
H2、O2、NH3、N2、CO、CH4
不可干燥气体
NH3、H2S、HBr、HI
NH3
Cl2、H2S、HCl、SO2、CO2
三、气体的收集装置
根据气体溶解性(分子极性)和密度(相对分子量,与29比较)不同,把气体的收集方法分为排液法(常为排水法)和排气法(常为排空气法)。装置图见下:
1.排液法:难溶或微溶于水且不与水发生化学反应的气体。例如:H2、O2、CO、CH4、NO(只能用排液法收集)、CH2=CH2、CH≡CH等。注意:Cl2不用排水法收集,但可用排饱和食盐水收集,CO2可以用排饱和NaHCO3
收集。排液法的典型仪器是a,注意导管只能伸入集气瓶内少许。
2.排气法:不与空气反应且密度与空气相差较大的气体;又可分为向上排空气法和向下排空气法。用排气法收集气体时,导气管一定要伸入集气瓶底部,把空气尽量排出。为了减少空气扩散,集气瓶口可盖上毛玻璃片(如图b);试管口轻轻塞上一小团疏松的棉花(如图d)
(1)向上排空气法:式量大于29的气体。如O2、CO2、SO2、H2S、Cl2、NO2(只用排空气)、HCl等;典型装置是b。
(2)向下排空气法:式量小于29的气体。如H2、CH4、NH3等;典型装置是c。
a b向上排空气法 c向下排空气法 d
练习:(发散思维)
1.下列装置也能用于收集气体,试根据气体的流向判断收集气体的种类。
2.排水法收集的气体和排气法收集的气体纯度有何不同?
3.某些气体要求非常干燥,则收集前后都要干燥,如何组装仪器?
四、尾气处理装置
通常有毒和有污染的尾气必须适当处理。常用经典仪器有:
a b c d e
a用于NaOH吸收氯气、CO2;硫酸铜吸收H2S(气体溶解或反应速度不很快,不易引起倒吸);
b用于收集少量气体然后处理;c、d收集极易溶且溶解很快的气体。如HCl、HBr、NH3等;其中d 吸收量少。e用于处理难以吸收(有毒)且可燃的气体。如H2、CO等。
实验装置总装思路
1.装置的安装顺序
2.操作顺序
装置连接→气密性检查→装固体药品→加液体药品→气体制取
要点:气密性的检查
1.将装置的导管口一端浸没于水中,再用双手手掌握住容器(试管可用一只手握住,如左图;复杂仪器还可微热),若在导管口处有气泡冒出,松手后,水在导管里形成了一段水柱,则装置的气密性良好。
概括为:微热看气泡,静置看液面(又称整体法)。
2.如上图,关闭止水夹后,从长颈漏斗向试管中注入一定量的水,使漏斗内液面高于试管内液面,静置后若漏斗内液面不下降,则装置的气密性良好;液面下降,则装置的漏气;
概括为:注液静置看液面(又称局部法)。
创新设计方案集锦:
1.气体安全装置
1)防倒吸安全装置
2)防堵塞安全装置
3)防污染安全装置
2.液封装置
3.量气体体积装置(读数时,要使量筒与洗气瓶中的液面保持水平,消除水位差造成的误差)
4.启普发生器原理及类似反应器
经典套图
中和热测定 制乙烯 CO尾气吸收
海水蒸馏
制乙炔
CO尾气吸收