- 429.00 KB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2018年福建省高考复习化学模拟试卷
可能用到的相对原子质量:H 1 N 14 O 16 Na 23 Al 27 S 32 Pt 195
7.化学与生产、生活密切相关,下列说法错误的是
A.生活污水进行脱氮、脱磷处理可以减少水体富营养化
B.食品袋中装有硅胶的小纸包的作用是防止食品受潮
C.爆竹燃放过程中,硫燃烧直接生成三氧化硫
D.草木灰不能与铵态氮肥混合施用
8.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无砂粘土而为之”,“凡坯既成,干燥之后,则堆积窑中燃薪举火”,“浇水转釉(主要为青色),与造砖同法”。下列说法错误的是
A.粘土是制砖瓦和水泥的主要原料
B.“燃薪举火”使粘土发生复杂的物理化学变化
C.沙子的主要成分为硅酸盐
D.泥坯烧制后自然冷却成红瓦,浇水冷却成青瓦
9.作为“血迹检测小王子”,鲁米诺反应在刑侦中扮演了重要的角色,其一种合成原理如图所示。下列有关说法正确的是
A.鲁米诺的化学式为C8H6N3O2
B.1 mol A分子最多可以与5 mol氢气发生加成反应
C. B中处于同一平面的原子有9个
D.(1)、(2)两步的反应类型分别为取代反应和还原反应
10.用下列实验装置进行相应实验,设计正确且能达到实验目的的是
A.甲用于实验室制取少量CO2 B.乙用于配制一定物质的量浓度的硫酸
C.丙用于模拟生铁的电化学腐蚀 D.丁用于蒸干A1Cl3溶液制备无水AlC13
第1页 共7页
11.W是由短周期非金属主族元素X、Y按原子个数比3∶1组成的化合物。元素周期表中,Y在X的下一周期。下列叙述正确的是
A.Y的最高正价一定大于X B.Y的原子半径可能小于X
C.W只能是无机物 D.W的水溶液一定显酸性
12.全钒液流电池装置如图,电解液在电解质储罐和电池间不断循环。下列说法错误的是
A.充电时,氢离子通过交换膜移向右侧
B.充电时,电源负极连接a电极
C.放电时装置发生的总反应为:
VO2++V2++2H+=VO2++V3++H2O
D.质子交换膜可阻止VO2+与V2+直接发生
反应
13.室温下,某二元碱X(OH)2水溶液中相关组分的物质的量分数随溶液pH变化的曲线如图所示,下列说法错误的是
A.Kb2的数量级为10-8
B.X(OH)NO3水溶液显碱性
C.等物质的量的X(NO3)2和X(OH)NO3混合溶液中
c(X2+)>c[X(OH)+]
D.在X(OH)NO3水溶液中,c[X(OH)2]+c(OH-)= c(X2+)+ c(H+)
第2页 共7页
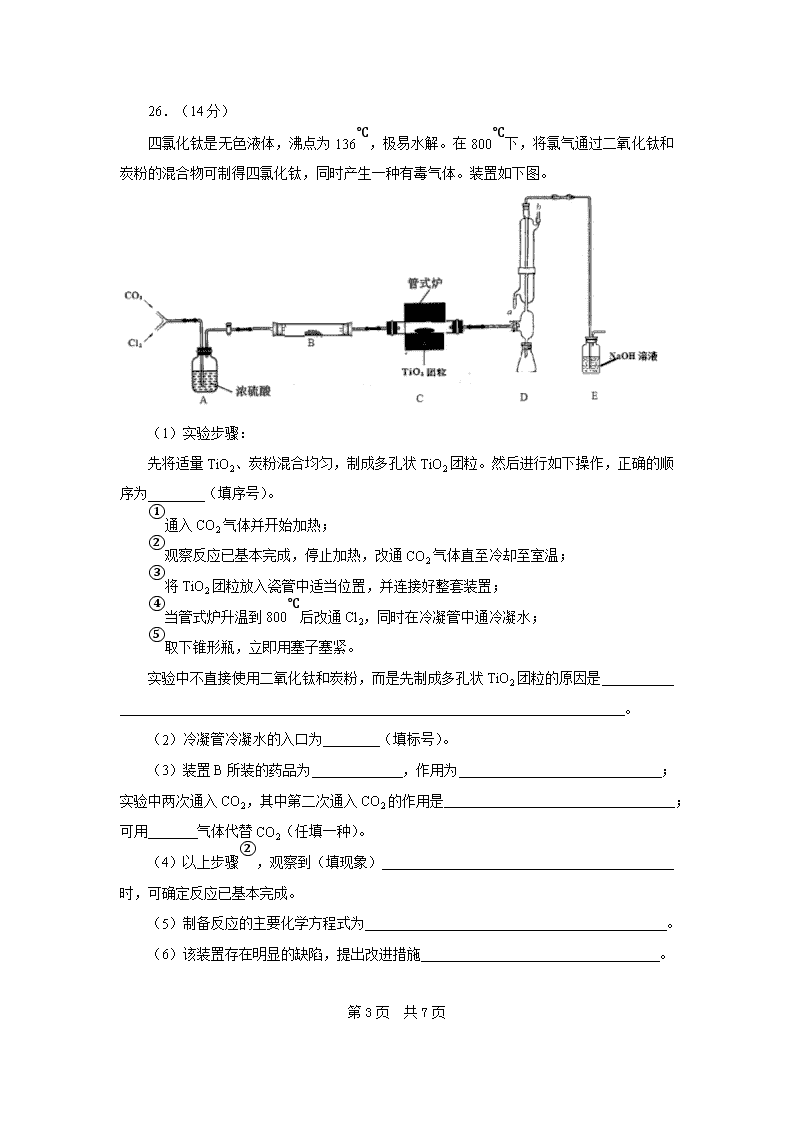
26.(14分)
四氯化钛是无色液体,沸点为136℃,极易水解。在800℃下,将氯气通过二氧化钛和炭粉的混合物可制得四氯化钛,同时产生一种有毒气体。装置如下图。
(1)实验步骤:
先将适量TiO2、炭粉混合均匀,制成多孔状TiO2团粒。然后进行如下操作,正确的顺序为 (填序号)。
①通入CO2气体并开始加热;
②观察反应已基本完成,停止加热,改通CO2气体直至冷却至室温;
③将TiO2团粒放入瓷管中适当位置,并连接好整套装置;
④当管式炉升温到800℃后改通Cl2,同时在冷凝管中通冷凝水;
⑤取下锥形瓶,立即用塞子塞紧。
实验中不直接使用二氧化钛和炭粉,而是先制成多孔状TiO2团粒的原因是
。
(2)冷凝管冷凝水的入口为 (填标号)。
(3)装置B所装的药品为 ,作用为 ;
实验中两次通入CO2,其中第二次通入CO2的作用是 ;可用 气体代替CO2(任填一种)。
(4)以上步骤②,观察到(填现象)
时,可确定反应已基本完成。
(5)制备反应的主要化学方程式为 。
(6)该装置存在明显的缺陷,提出改进措施 。
第3页 共7页
27.(14分)
从废旧锂离子二次电池(主要成分为LiCoO2,还含有少量石墨和镀镍金属钢壳、铝箔以及钙等杂质)中回收钴和锂的工艺流程如下:
回答下列问题:
(1)“碱浸”目的是 。
(2)“酸浸”过程中LiCoO2发生反应的离子方程式为:
浸渣的含有的主要成分是 。
(3)“萃取净化”除去的杂质离子有Ni2+外,还有 。
(4)“萃取分离”中钴、锂萃取率与平衡pH关系如有图所示, pH一般选择5左右,理由是 。
(5)“沉锂”中Li2CO3溶解度随温度变化曲线如右下图所示:
①根据平衡移动原理分析Li2CO3在水中溶解度随温度变化的原因
。
②为获得高纯Li2CO3,提纯操作依次为趁热过滤、 、烘干。
③若“沉锂”中c(Li+)=1.0 mol·L−1,加入等体积等浓度Na2CO3溶液,此时实验所得沉锂率为 。(已知Li2CO3的Ksp为9.0×10-4)
第4页 共7页
28.(15分)
NO、SO2是大气污染物但又有着重要用途。
I.已知:N2 (g) + O2(g) = 2NO (g) ΔH1= 180.5kJ·mol−1
C(s) + O2(g) = CO2(g) ΔH2 = −393.5kJ·mol−1
2C(s) + O2(g) =2CO(g) ΔH3 =−221.0kJ·mol−1
(1)某反应的平衡常数表达式为K= , 此反应的热化学方程式为:
(2)向绝热恒容密闭容器中充入等量的NO和CO进行反应,能判断反应已达到化学平衡状态的是 (填序号)。
a.容器中的压强不变 b.2v正(CO)=v逆(N2)
c.气体的平均相对分子质量保持34.2不变 d.该反应平衡常数保持不变
e.NO和CO的体积比保持不变
II.(3)SO2可用于制Na2S2O3。为探究某浓度的Na2S2O3的化学性质,某同学设计如下实验流程:
用离子方程式表示Na2S2O3溶液具有碱性的原因___________。Na2S2O3与氯水反应的化学方程式是__________。
(4)含SO2的烟气可用Na2SO3溶液吸收。可将吸收液送至电解槽再生后循环使用。再生电解槽如右图所示。a电极上含硫微粒放电的反应式为
(任写一个)。离子交换膜 (填标号)为阴离子交换膜。
(5)2SO3(g)2SO2(g)+O2(g),将一定量的SO3放入恒容的密闭容器中,测得其平衡转化率随温度变化如图所示。
图中a点对应温度下,已知SO3的起始压强为P0,该温度下反应的平衡常数Kp= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。在该温度下达到平衡,再向容器中加入等物质的量SO2和SO3,平衡将 (填“向正反应方向”或“向逆反应方向” “不”) 移动。
第5页 共7页
35.[化学——选修3:物质结构与性质](15分)
铂(Pt)及其化合物用途广泛。
(1)在元素周期表中,Pt与Fe相隔一个纵行、一个横行,但与铁元素同处 族。基态铂原子有2个未成对电子,且在能量不同的原子轨道上运动,其价电子排布式为 。
(2)二氯二吡啶合铂是由Pt2+、Cl-和吡啶结合形成的铂配合物,有顺式和反式两种同分异构体。科学研究表明,顺式分子具有抗癌活性。
①吡啶分子是大体积平面配体,其结构简式如右图所示。每个吡啶分子中含有的σ键数目为 。
②二氯二吡啶合铂中存在的微粒间作用力有 (填序号)。
a.离子键 b.氢键 c.范德华力 d.金属键 e.非极性键
③反式二氯二吡啶合铂分子是非极性分子,画出其结构式: 。
(3)某研究小组将平面型的铂配合物分子进行层状堆砌,使每个分子中的铂原子在某一方向上排列成行,构成能导电的“分子金属”,其结构如右图所示。
① 硫和氮中,第一电离能较大的是 。
②“分子金属”可以导电,是因为 能沿着其中的金属原子链流动。
③“分子金属”中,铂原子是否以sp3的方式杂化?简述理由:
。
(4)金属铂晶体中,铂原子的配位数为12,其立方晶胞沿x、y或z轴的投影图如右图所示。若金属铂的密度为d g·cm-3,则晶胞参数a= nm(列计算式)。
第6页 共7页
36.[化学——选修5:有机化学基础](15分)
香草醛都是食品添加剂的增香原料。由丁香酚合成香草醛流程如下:
(1)写出丁香酚分子中含氧官能团的名称______。
(2)写出化合物乙的结构简式______;
(3)写出化合物丙转化为香草醛的化学方程式______;
(4)烯烃在一定条件下可发生如下氧化反应生成醛或酮:
RCH=CHR′→RCHO+R′CHO。
以上流程中化合物甲转化为化合物乙的目的是______。
(5)乙基香草醛(,相对分子质量=166)的同分异构体丁是一种医药中间体,可在酸性条件下水解。丁的一种水解产物(相对分子质量=152)核磁共振氢谱显示有4种不同化学环境的氢,峰面积比为3∶2∶2∶1,化合物丁的结构简式是______。
(6)写出用HO--CH2CH2OH为原料制备HO--CHO的合成路线:
(其他试剂任选)。
第6页 共7页