- 3.51 MB
- 2021-05-13 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
1
2021 年湖北省普通高中学业水平选择性模拟演练
化学
本试卷共 10 页,19 题。全卷满分 100 分。用时 75 分钟。
注意事项:
1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准考证
号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑.写在试
卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内.写在试卷、草稿纸和
答题卡上的非答题区域均无效。
4.结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 F 19 Mg 24 Si 28 S 32 Cl
35.5 Fe 56 Ni59
一、选择题:本题共 15 小题,每小题 3 分,共 45 分.在每小题给出的四个选项中,只有一项
是符合题目要求的。
1. 科学佩戴口罩对防控新冠病毒疫情有重要作用,生产一次性医用口罩的主要原料为聚丙烯树脂。下列说
法错误的是( )
A. 聚丙烯结构简式为 B. 由丙烯合成聚丙烯的反应类型为缩聚反应
C. 聚丙烯为热塑性合成树脂 D. 聚丙烯在自然环境中不容易降解
2. 14
6 C的衰变反应为 14 14 0
6 z -1C X+ e ,其半衰期(反应物的量被消耗到其初始量的一半需要的时间)为 5730
年。下列说法正确的是( )
A. 14
6 C与 14
z X 互为同位素
B. 14
6 C与 14
z X 的中子数相同
C. 12
6 C和 14
6 C的价层轨道电子数相差 2
D. 某考古样品中 14
6 C的量应为其 11460 年前的 1
4
3. AN 为阿伏加德罗常数的值。下列说法正确的是( )
2
A. 21molH S 分子中,S 原子的价层电子对数目为 A4N
B. 标准状况下, 2.24L 环己烷的分子数为 A0.1N
C. -11L0.01mol L 溶液中, 和 的离子数目之和为 A0.01N
D. 电极反应 - +
4 1-x 4LiFePO -xe =xLi +Li FePO ,每转移1mol 电子释放 A2N 个 +Li
4. 不能正确表示下列反应的离子方程式是( )
A. 将少量溴水滴入过量 2 3Na SO 溶液中: 2- - + 2-
2 2 3 4Br +H O+SO =2Br +2H +SO
B. 将足量 2 4 3Fe SO 溶液滴入 2Mg(OH) 浊液中: 3 2
2 32Fe 3Mg(OH) 2Fe(OH) 3Mg
C. 将过量 2SO 通入 2K S 溶液中: 2
2 2 35SO 2S 2H O 3S 4HSO
D. 将葡萄糖溶液与足量银氨溶液共热:
+ -
2 4 3 2CH OH(CHOH) CHO+2 Ag NH +2OH Δ
- + -
2 4 4 3 2CH OH(CHOH) COO +NH +2Ag +3NH +H O
5. 短周期元素 W、X、Y 和 Z 的原子序数依次增大。W 是宇宙中最丰富的元素, 2W X 是维持生命过程的
必需物质,WY 可用于玻璃的刻蚀, 2ZX 是酸雨的主要形成原因之一,室温下化合物 4ZY 是气体。下列说
法错误的是( )
A. Y 的第一电离能在四种元素中最大 B. 2W X 和 2ZX 的中心原子分别为 3sp 和 2sp 杂化
C. 2W X 的沸点高于 2W Z 的沸点 D. 4ZY 分子中原子均为 8 电子结构
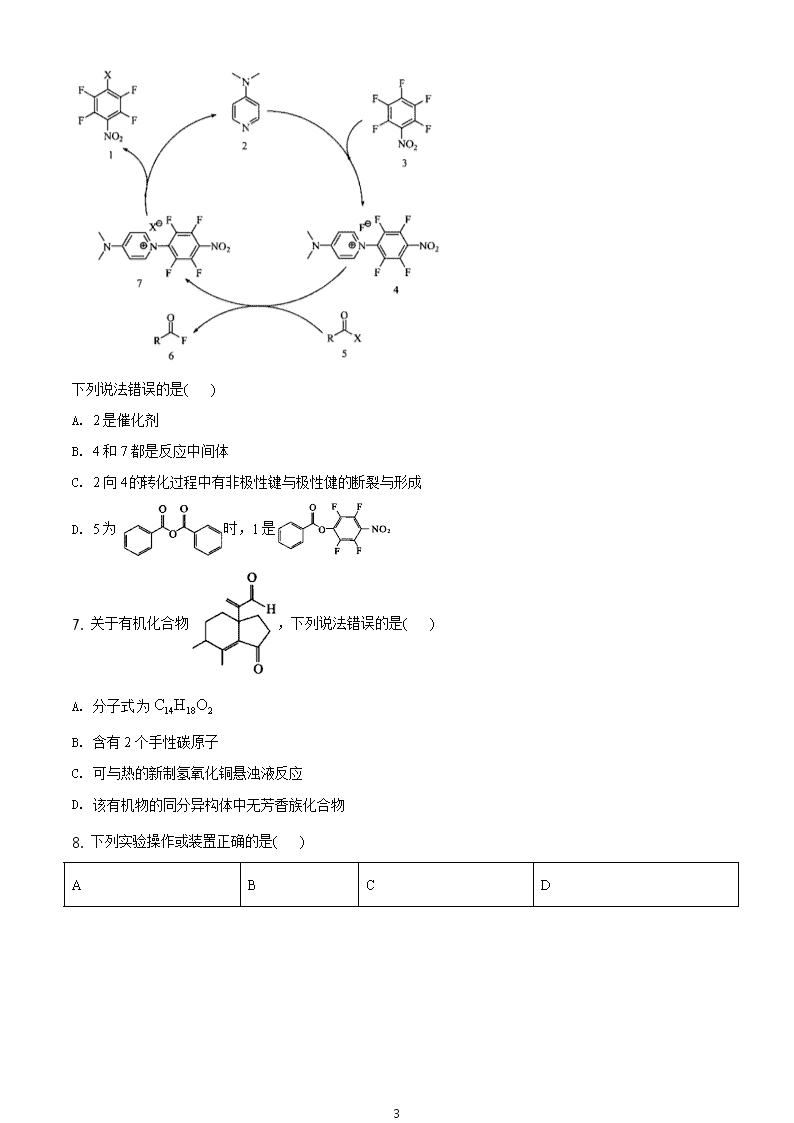
6. 最新文献报道,有机小分子可催化多氟芳烃的取代反应,机理如图所示。
3
下列说法错误的是( )
A. 2 是催化剂
B. 4 和 7 都是反应中间体
C. 2 向 4的转化过程中有非极性键与极性健的断裂与形成
D. 5 为 时,1 是
7. 关于有机化合物 ,下列说法错误的是( )
A. 分子式为 14 18 2C H O
B. 含有 2 个手性碳原子
C. 可与热的新制氢氧化铜悬浊液反应
D. 该有机物的同分异构体中无芳香族化合物
8. 下列实验操作或装置正确的是( )
A B C D
4
蒸发除去苯甲酸中的乙醇 除去水中的苯酚 实验室纯化工业乙酸乙酯 用氢氧化钠溶液滴定醋酸溶液
A. A B. B C. C D. D
9. B 和 Al 为同族元素,下列说法错误的是( )
A. 3BF 和 3AlF 都可以与 -F 形成配位键
B. 3 3H BO 为三元酸, 3Al(OH) 呈两性
C. 共价键的方向性使晶体 B 有脆性,原子层的相对滑动使金属 Al 有延展性
D. B 和 Al 分别与 N 形成的共价晶体,均具有较高硬度和熔点
10. 研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。
下列说法错误的是( )
A. 加入 3HNO 降低了正极反应的活化能
B. 电池工作时正极区溶液的 pH 降低
C. 3 21molCH CH OH 被完全氧化时有 23molO 被还原
D. 负极反应为 - +
3 2 2 2CH CH OH+3H O-12e =2CO +12H
5
11. 下列实验的现象描述和结论都正确的是( )
实验操作 实验现象 实验结论
A
将水滴入盛有 2 2Na O 固体的试管中,立即把带
火星的木条放在试管口
可观察到有气泡产生,木
条复燃
2 2Na O 固体遇水产生
2O
B
向盛有 10 滴 1
30.1mol L AgNO 溶液的试管中
滴加 10.1mol L KCl 溶液至不再生成沉淀后,
再向其中滴加 -10.1mol L KI 溶液
先观察到白色沉淀,后沉
淀颜色变为黄色
sp sp(AgCl) (AgI)K K<
C
向两支盛有少量溴的四氯化碳溶液的试管中分
别加入适量苯和通入足量乙烯
溶液均褪色
溴与苯和乙烯都能发生
反应
D
向两支盛有 1
44mL0.01mol L KMnO 溶液的
试管中分别加入 12mL0.1mol L 和
1
2 2 42mL0.2mol L H C O 溶液
前者比后者褪色快
其他条件不变,反应物浓
度增加,反应速率增大
A. A B. B C. C D. D
12. 在碱性溶液中, 2+Cu 可以与缩二脲形成紫色配离子,其结构如图所示。
下列说法错误的是( )
A. 该配离子与水分子形成氢键的原子只有 N 和 O
B. 该配离子中铜离子的配位数是 4
C. 基态 Cu 原子的价电子排布式是 10 13d 4s
D. 该配离子中非金属元素的电负性大小顺序为 O>N>C>H
6
13. 已知 x 1-xNi Mg O 晶体属立方晶系,晶胞边长 a。将 +Li 掺杂到该晶胞中,可得到一种高性能的 p 型太阳
能电池材料,其结构单元如图所示。
假定掺杂后的晶胞参数不发生变化,下列说法正确的是( )
A. 该结构单元中 O 原子数为 3 B. Ni 和 Mg 间的最短距离是 2 a2
C. Ni 的配位数为 4 D. 该物质的化学式为 0.5 1.12 2.38 4Li Mg Ni O
14. 水泥是人类最伟大的发明之一,主要成分为硅酸三钙(3CaO∙SiO2)。将其与适量的水反应,形成相互交
联的结构,反应式如下 2(3CaO∙SiO2)+6H2O=3CaO∙2SiO2∙3H2O+3Ca(OH)2 ∆H<0。但是,需要避免交联过程
热膨胀及产生的水蒸气在建筑结构中造成空隙。我国三峡大坝的建设者在全世界首创了以冰代水的浇灌方
法,有效解决了这一问题,保证了大坝建筑质量。下列说法错误的是( )
A. 水泥由黏土和石灰石等研磨、煅烧制得
B. 水泥生产过程中加入石膏,可以调节水泥的硬化速率
C. 水的作用是提供结晶水以稳定交联结构
D. 以冰代水的优点是减少了热膨胀及水蒸气的产生
15. 25℃时,按下表配制两份溶液.
一元弱酸溶液 加入的 NaOH 溶液 混合后所得溶液
1HA 10.0mL0.20mol L 15.0mL0.20mol L 溶液Ⅰ pH=5.0
1HB10.0mL0.20mol L 15.0mL0.20mol L 溶液Ⅱ pH=4.0
下列说法错误的是( )
A. 溶液Ⅰ中, - + + -c A >c Na >c H >c OH
7
B. Ⅰ和Ⅱ的 pH 相差 1.0,说明 a
a
K (HA) =10K (HB)
C. 混合Ⅰ和Ⅱ: + + - - -c Na +c H =c A +c(B )+c(OH )
D. 混合Ⅰ和Ⅱ: c(HA)>c(HB)
二、非选择题:本题共 4 小题,共 55 分。
16. 无水 3FeCl 是常用的芳香烃取代反应催化剂,它具有易水解、易升华的性质。铁粉与氯气反应制备无水
3FeCl 的实验装置如图所示:
E 和 G 用来收集产物。回答下列问题:
(1)通入氯气后,A 中观察到有酸雾产生,C 中 2 5P O 的作用是_______。
(2)在 E、G 处收集产物是利用了 3FeCl _______的性质。
(3)实验过程中若 F 处出现堵塞,则在 B 处可观察到的现象是_______。可通过_______(填简单操作),使实
验能继续进行。
(4)Ⅰ中反应的离子方程式为_______。
(5)某同学用 5.60g 干燥铁粉制得无水 3FeCl 样品13.00g ,该次实验的产率是_______。
(6)实验室中还常用 2SOCl 与 3 2FeCl 6H O 晶体共热制备无水 3FeCl ,其化学反应方程式为_______.检验水合
三氯化铁原料中是否存在 2FeCl 的试剂是_______。
17. 熟地吡喃酮是从中药熟地中提取的有效成分,化合物 F 是合成熟地吡喃酮的一种中间体,合成路线如
图所示。
8
已知:
回答下列问题:
(1)F 中含氧官能团的名称是_______。
(2)A→B 的反应类型为_______。
(3)C 的核磁共振氢谱有_______组吸收峰。
(4)D的结构简式是_______。
(5)E 和 F_______同分异构体(填“是”或“不是”)。
(6)化合物 是合成抗菌药磺胺甲 唑的一种中间体,写出以乙二酸和丙酮
( )为原料合成该化合物的反应方程式_______(其他无机及有机试剂任选)。
18. 甲烷和水蒸气催化制氢主要有如下两个反应:
① 4 2 2CH (g)+H O(g)=CO(g)+3H (g) ΔH=+206kJ/mol
② 2 2 2CO(g)+H O(g)=CO (g)+H (g) ΔH=-41kJ/mol
恒定压强为100kPa 时,将 n(CH4)∶n(H2O)=1∶3 的混合气体投入反应器中,平衡时,各组分的物质的量分
数与温度的关系如图所示。
9
回答下列问题:
(1)写出 4CH 与 2CO 生成 2H 和 CO 的热化学方程式:_______。
(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是_______(填标号)。
A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快
B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快
C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
D.加入合适的催化剂,降低反应温度也能实现单位时间转化率不变
(3)系统中 2H 的含量,在 700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
①低于 700℃,_______;
②高于 700℃,_______。
(4)已知投料比为 n(CH4)∶n(H2O)=1∶3 的混合气体,p=100kPa 。600℃时, 4CH 的平衡转化率为_______,
反应①的平衡常数的计算式为 pK = _______( pK 是以分压表示的平衡常数,分压=总压×物质的量分数)。
19. 某化学兴趣小组通过查阅文献,设计了从某厂阳极泥(成分为 Cu、Ag2Se、Au、Pt)中回收贵重金属的工
艺,其流程如图所示。
10
回答下列问题:
(1)写出“焙烧”时,生成 2SeO 的化学反应方程式_______。
(2)“滤液”中的金属阳离子有_______;“酸浸氧化”中通入氧气的目的是_______、_______。
(3)“酸溶”时 Pt、Au 分别转化为 2-
6PtCl 和 -
4AuCl ,写出 Au 溶解的离子方程式_______。
(4)可从“有机层”回收的金属是_______。实验室“萃取分液”的玻璃仪器有_______、_______。
(5)电解 4 3 2NH Au SO 溶液回收 Au 的阴极反应式为_______。
11
2021 年湖北省普通高中学业水平选择性模拟演练
化学
本试卷共 10 页,19 题。全卷满分 100 分。用时 75 分钟。
注意事项:
1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并将准考证
号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑.写在试
卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内.写在试卷、草稿纸和
答题卡上的非答题区域均无效。
4.结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 F 19 Mg 24 Si 28 S 32 Cl
35.5 Fe 56 Ni59
一、选择题:本题共 15 小题,每小题 3 分,共 45 分.在每小题给出的四个选项中,只有一项
是符合题目要求的。
1. 科学佩戴口罩对防控新冠病毒疫情有重要作用,生产一次性医用口罩的主要原料为聚丙烯树脂。下列说
法错误的是( )
A. 聚丙烯结构简式为 B. 由丙烯合成聚丙烯的反应类型为缩聚反应
C. 聚丙烯为热塑性合成树脂 D. 聚丙烯在自然环境中不容易降解
【答案】B
【解析】
【分析】
【详解】A.聚丙烯由丙烯(CH2=CHCH3)通过加聚反应制得,结构简式为 ,A 正确;
B.聚丙烯由丙烯(CH2=CHCH3)通过加聚反应制得,B 错误;
C.由聚丙烯的结构可知聚丙烯为线型结构,具有热塑性,C 正确;
D.聚丙烯结构中化学键为单键,不易被氧化、不能水解,因此聚丙烯在自然环境中不容易降解,D 正确;
答案选 B。
12
2. 14
6 C的衰变反应为 14 14 0
6 z -1C X+ e ,其半衰期(反应物的量被消耗到其初始量的一半需要的时间)为 5730
年。下列说法正确的是( )
A. 14
6 C与 14
z X 互为同位素
B. 14
6 C与 14
z X 的中子数相同
C. 12
6 C和 14
6 C的价层轨道电子数相差 2
D. 某考古样品中 14
6 C的量应为其 11460 年前的 1
4
【答案】D
【解析】
【分析】
由 14 14 0
6 z -1C X+ e ,可知 z=7,X 为 N,因此 14 14 0
6 7 -1C N+ e 。
【详解】A.z=7, 14
6 C与 14
z X 质子数不相同,不互为同位素,A 错误;
B. 14
6 C与 14
z X 的中子数分别为 14-6=8、14-7=7,中子数不同,B 错误;
C. 12
6 C和 14
6 C的核外电子数均为 6,核外电子排布相同,价层轨道电子数相同,C 错误;
D.根据半衰期的定义,某考古样品中 14
6 C的量应为其 5730 年前的 1
2
,为 5730×2=11460 年前的 1
4
,D 正确;
答案选 D。
3. AN 为阿伏加德罗常数的值。下列说法正确的是( )
A. 21molH S 分子中,S 原子的价层电子对数目为 A4N
B. 标准状况下, 2.24L 环己烷的分子数为 A0.1N
C. -11L0.01mol L 溶液中, 和 的离子数目之和为 A0.01N
D. 电极反应 - +
4 1-x 4LiFePO -xe =xLi +Li FePO ,每转移1mol 电子释放 A2N 个 +Li
【答案】A
【解析】
【分析】
13
【详解】A.H2S 中 S 的价层电子对数=2+ 6-2 1
2
=4,因此 21molH S 分子中,S 原子的价层电子对数目为 A4N ,
A 正确;
B.标准状况下,环己烷不是气体,因此无法计算,B 错误;
C. -11L0.01mol L 溶液中,根据物料守恒可知 、 、
的总物质的量为 0.01mol,因此 和 的离子数目之和小于 A0.01N ,C 错误;
D.由 - +
4 1-x 4LiFePO -xe =xLi +Li FePO 可知,每转移 xmol 电子,释放 xmolLi+,因此每转移1mol 电子释
放 AN 个 +Li ,D 错误;
答案选 A。
4. 不能正确表示下列反应的离子方程式是( )
A. 将少量溴水滴入过量 2 3Na SO 溶液中: 2- - + 2-
2 2 3 4Br +H O+SO =2Br +2H +SO
B. 将足量 2 4 3Fe SO 溶液滴入 2Mg(OH) 浊液中: 3 2
2 32Fe 3Mg(OH) 2Fe(OH) 3Mg
C. 将过量 2SO 通入 2K S 溶液中: 2
2 2 35SO 2S 2H O 3S 4HSO
D. 将葡萄糖溶液与足量银氨溶液共热:
+ -
2 4 3 2CH OH(CHOH) CHO+2 Ag NH +2OH Δ
- + -
2 4 4 3 2CH OH(CHOH) COO +NH +2Ag +3NH +H O
【答案】A
【解析】
【分析】
【详解】A. 2 3Na SO 过量,溴和亚硫酸根发生氧化还原反应生成的 H+和过量的 2-
3SO 反应生成 H2O 和 SO2,
反应的离子方程式为 2- - 2-
2 3 2 3 4Br +3SO +H O=2Br +2HSO +SO ,A 错误;
B.氢氧化铁的溶度积远远小于氢氧化镁的溶度积,因此氢氧化镁能转换为氢氧化铁,即将足量 2 4 3Fe SO
溶液滴入 2Mg(OH) 浊液中: 3 2
2 32Fe 3Mg(OH) 2Fe(OH) 3Mg ,B 正确;
14
C.将过量 2SO 通入 2K S 溶液中,二氧化硫和硫离子发生氧化还原反应生成硫和亚硫酸氢钾,反应的离子方
程式为 2
2 2 35SO 2S 2H O 3S 4HSO ,C 正确;
D.葡萄糖中的醛基能被银氨溶液氧化,发生银镜反应,反应的离子方程式为
+ -
2 4 3 2CH OH(CHOH) CHO+2 Ag NH +2OH Δ
- +
2 4 4 3 2CH OH(CHOH) COO +NH +2Ag +3NH +H O ,D 正确;
答案选 A。
5. 短周期元素 W、X、Y 和 Z 的原子序数依次增大。W 是宇宙中最丰富的元素, 2W X 是维持生命过程的
必需物质,WY 可用于玻璃的刻蚀, 2ZX 是酸雨的主要形成原因之一,室温下化合物 4ZY 是气体。下列说
法错误的是( )
A. Y 的第一电离能在四种元素中最大 B. 2W X 和 2ZX 的中心原子分别为 3sp 和 2sp 杂化
C. 2W X 的沸点高于 2W Z 的沸点 D. 4ZY 分子中原子均为 8 电子结构
【答案】D
【解析】
【分析】
W 是宇宙中最丰富的元素,则 W 是 H; 2W X 是维持生命过程的必需物质,则 X 为 O;WY 可用于玻璃的
刻蚀,则 WY 为 HF,Y 为 F; 2ZX 是酸雨的主要形成原因之一,且 Z 的原子序数比 Y 大,则 Z 为 S;综
上所述,W、X、Y 和 Z 分别为 H、O、F、S,据此解答。
【详解】A.一般规律:非金属性越强,第一电离能越大,第ⅡA 族、第ⅤA 族元素的第一电离能比同周期
相邻元素大,因此 F 的第一电离能在四种元素中最大,A 正确;
B.H2O 中 O 的价层电子对数为 2+ 6-2 1
2
=4,SO2 中 S 的价层电子对数为 2+ 6-2
2
2
=3,因此 H2O 和 SO2
的中心原子分别为 3sp 和 2sp 杂化,B 正确;
C.O 和 S 属于同主族元素,但 H2O 分子间存在氢键,而 H2S 分子间不存在氢键,因此 H2O 的沸点高于 H2S
的沸点,C 正确;
D.SF4 中,S的最外层电子数为 10,D 错误;
答案选 D。
6. 最新文献报道,有机小分子可催化多氟芳烃的取代反应,机理如图所示。
15
下列说法错误的是( )
A. 2 是催化剂
B. 4 和 7 都是反应中间体
C. 2 向 4 的转化过程中有非极性键与极性健的断裂与形成
D. 5 为 时,1 是
【答案】C
【解析】
【分析】
分析图可知反应历程为:2+3→4,4+5→6+7,7→1+2,总反应为:3+5→7,2 是催化剂,4 和 7 是反应中间
体。
【详解】A.由分析可知,2 是催化剂,A 正确;
B.由分析可知,4 和 7 都是反应中间体,B 正确;
C.由图可知,2 向 4 的转化过程中有碳氟键断裂,有碳氮键形成,即有极性键的断裂和形成,无非极性键
的断裂与形成,C 错误;
D.5 到 1 的总变化为 4 中-NO2 对位的 C 上的原子团被 X 取代,若 5 为 ,则 X 为 ,
则 1 是 ,D 正确;
答案选 C。
16
7. 关于有机化合物 ,下列说法错误的是( )
A. 分子式为 14 18 2C H O
B. 含有 2 个手性碳原子
C. 可与热的新制氢氧化铜悬浊液反应
D. 该有机物的同分异构体中无芳香族化合物
【答案】D
【解析】
【分析】
【详解】A.由结构式可知该有机物分子式为 14 18 2C H O ,A 正确;
B.含有 2 个手性碳原子,如图 ,B 正确;
C.该有机物含醛基,可与热的新制氢氧化铜悬浊液反应,C 正确;
D.该分子的不饱和度为 6,苯环不饱和度为 4,则该有机物的同分异构体中一定有芳香族化合物,D 错误;
答案选 D。
8. 下列实验操作或装置正确的是( )
A B C D
蒸发除去苯甲酸中的乙醇 除去水中的苯酚 实验室纯化工业乙酸乙酯 用氢氧化钠溶液滴定醋酸溶液
17
A. A B. B C. C D. D
【答案】C
【解析】
【分析】
【详解】A.蒸发多用于固液分离,乙醇和苯甲酸为液液分离,苯甲酸沸点高于乙醇的沸点,应该应用蒸馏
的方法,故 A 错误;
B.苯酚微溶于水,水中苯酚形成乳浊液,故不能用过滤分离,故 B 错误;
C.杂质沸点低于乙酸乙酯采用蒸馏的方法纯化效果更好,装置无错误,故 C 正确;
D.氢氧化钠溶液为碱性,应该用碱式滴定管而不是酸式滴定管,故 D 错误;
故选 C。
9. B 和 Al 为同族元素,下列说法错误的是( )
A. 3BF 和 3AlF 都可以与 -F 形成配位键
B. 3 3H BO 为三元酸, 3Al(OH) 呈两性
C. 共价键的方向性使晶体 B 有脆性,原子层的相对滑动使金属 Al 有延展性
D. B 和 Al 分别与 N 形成的共价晶体,均具有较高硬度和熔点
【答案】B
【解析】
【分析】
【详解】A. 3BF 和 3AlF 中 B 和 Al 均有空轨道, -F 有孤电子,因此 3BF 和 3AlF 都可以与 -F 形成配位键,A
正确;
B. 3 3H BO 为一元弱酸, 3Al(OH) 为两性氢氧化物,具有两性,B 错误;
C.晶体 B 为共价晶体,共价键的方向性使晶体 B 有脆性,Al 为金属晶体,原子层的相对滑动使金属 Al
有延展性,C 正确;
D.B 和 Al 分别与 N 通过共价键形成共价晶体,共价晶体具有较高硬度和熔点,D 正确;
答案选 B。
10. 研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。
18
下列说法错误的是( )
A. 加入 3HNO 降低了正极反应的活化能
B. 电池工作时正极区溶液的 pH 降低
C. 3 21molCH CH OH 被完全氧化时有 23molO 被还原
D. 负极反应为 - +
3 2 2 2CH CH OH+3H O-12e =2CO +12H
【答案】B
【解析】
【分析】
乙醇燃料电池中,通入乙醇的一极为负极,电极反应式为 - +
3 2 2 2CH CH OH+3H O-12e =2CO +12H ,通入
氧 气 的 一 极 为 正 极 , 由 工 作 原 理 图 可 知 , 正 极 发 生 反 应 - +
3 2HNO +3e +3H =NO +2H O ,
2 2 34NO+3O +2H O=4HNO ,二者加合可得 - +
2 2O +4e +4H =2H O ,则 3HNO 在正极起催化作用,据此分
析解答。
【详解】A. 由分析知, 3HNO 在正极起催化作用,作催化剂,则加入 3HNO 降低了正极反应的活化能,
故 A 正确;
B. 电池工作时正极区的总反应为 - +
2 2O +4e +4H =2H O ,则溶液中氢离子浓度减小,pH 增大,故 B 错误;
C. 根据得失电子守恒可知, 3 21molCH CH OH 被完全氧化时,转移 12mol 电子,则有 23molO 被还原,
故 C 正确;
D. 由分析知,负极反应为 - +
3 2 2 2CH CH OH+3H O-12e =2CO +12H ,故 D 正确;
故选 B。
11. 下列实验的现象描述和结论都正确的是( )
19
实验操作 实验现象 实验结论
A
将水滴入盛有 2 2Na O 固体的试管中,立即把带
火星的木条放在试管口
可观察到有气泡产生,木
条复燃
2 2Na O 固体遇水产生
2O
B
向盛有 10 滴 1
30.1mol L AgNO 溶液的试管中
滴加 10.1mol L KCl 溶液至不再生成沉淀后,
再向其中滴加 -10.1mol L KI 溶液
先观察到白色沉淀,后沉
淀颜色变为黄色
sp sp(AgCl) (AgI)K K<
C
向两支盛有少量溴的四氯化碳溶液的试管中分
别加入适量苯和通入足量乙烯
溶液均褪色
溴与苯和乙烯都能发生
反应
D
向两支盛有 1
44mL0.01mol L KMnO 溶液的
试管中分别加入 12mL0.1mol L 和
1
2 2 42mL0.2mol L H C O 溶液
前者比后者褪色快
其他条件不变,反应物浓
度增加,反应速率增大
A. A B. B C. C D. D
【答案】A
【解析】
【分析】
【详解】A. 2 2Na O 与水反应生成氢氧化钠和氧气,将水滴入盛有 2 2Na O 固体的试管中,立即把带火星
的木条放在试管口,可观察到有气泡产生,木条复燃,证明 2 2Na O 固体遇水产生了 2O ,故 A 正确;
B. 向盛有 10 滴 1
30.1mol L AgNO 溶液的试管中滴加 10.1mol L KCl 溶液,生成 AgCl 白色沉淀,至不
再生成沉淀后,再向其中滴加 -10.1mol L KI 溶液,可观察到白色沉淀转化为黄色沉淀,即生成了 AgI,证
明 AgI 比 AgCl 更难溶,则 sp sp(AgCl) (AgI)K K> ,故 B 错误;
C. 苯不与溴发生反应,则加入苯的溴的四氯化碳溶液不会褪色,故 C 错误;
D. 向两支盛有 1
44mL0.01mol L KMnO 溶液的试管中分别加入 12mL0.1mol L 和
20
1
2 2 42mL0.2mol L H C O 溶液,前者草酸的浓度小,反应速率慢,褪色时间长,故 D 错误;
故选 A。
12. 在碱性溶液中, 2+Cu 可以与缩二脲形成紫色配离子,其结构如图所示。
下列说法错误的是( )
A. 该配离子与水分子形成氢键的原子只有 N 和 O
B. 该配离子中铜离子的配位数是 4
C. 基态 Cu 原子的价电子排布式是 10 13d 4s
D. 该配离子中非金属元素的电负性大小顺序为 O>N>C>H
【答案】A
【解析】
【分析】
【详解】A.根据其结构可知,该配离子中的 N 和 O 可与水分子中的 H 形成氢键,而水分子中的 O 也可与
配离子中的 H 形成氢键,A 错误;
B.根据配离子的结构可知,铜离子的配位数为 4,B 正确;
C.根据铜原子的电子排布式可知,基态 Cu 原子的价电子排布式是 10 13d 4s ,C 正确;
D.根据同一周期,主族元素的电负性从左到右逐渐增大,同一主族,元素的电负性从上到下呈现减小的趋
势,非金属元素电负性大小排列顺序可知,该配离子中非金属元素的电负性大小顺序为 O>N>C>H ,D 正
确;
故选 A。
13. 已知 x 1-xNi Mg O 晶体属立方晶系,晶胞边长 a。将 +Li 掺杂到该晶胞中,可得到一种高性能的 p 型太阳
能电池材料,其结构单元如图所示。
21
假定掺杂后的晶胞参数不发生变化,下列说法正确的是( )
A. 该结构单元中 O 原子数为 3 B. Ni 和 Mg 间的最短距离是 2 a2
C. Ni 的配位数为 4 D. 该物质的化学式为 0.5 1.12 2.38 4Li Mg Ni O
【答案】B
【解析】
【分析】
【详解】A.由均摊法可知该结构单元中 O 原子数=1+12× 1
4 =4,A 错误;
B.由图可知,Ni 和 Mg 间的最短距离为晶胞面对角线的一半,即 2 21 (a +a )2 = 2 a2
,B 正确;
C.由晶胞可知 Ni 的配位数为 6,C 错误;
D.1 个晶胞中 Li 的个数=1×0.5=0.5,Mg 的个数=2×0.5+1× 1
8 =1.125,Ni 的个数=7× 1
8 +3×0.5=2.375,O 的
个数=4,因此该物质的化学式为 0.5 1.125 2.375 4Li Mg Ni O ,D 错误;
答案选 B。
14. 水泥是人类最伟大的发明之一,主要成分为硅酸三钙(3CaO∙SiO2)。将其与适量的水反应,形成相互交
联的结构,反应式如下 2(3CaO∙SiO2)+6H2O=3CaO∙2SiO2∙3H2O+3Ca(OH)2 ∆H<0。但是,需要避免交联过程
热膨胀及产生的水蒸气在建筑结构中造成空隙。我国三峡大坝的建设者在全世界首创了以冰代水的浇灌方
法,有效解决了这一问题,保证了大坝建筑质量。下列说法错误的是( )
A. 水泥由黏土和石灰石等研磨、煅烧制得
B. 水泥生产过程中加入石膏,可以调节水泥的硬化速率
C. 水的作用是提供结晶水以稳定交联结构
D. 以冰代水的优点是减少了热膨胀及水蒸气的产生
22
【答案】C
【解析】
【分析】
【详解】A.水泥由石灰石和粘土等混合,经高温煅烧制得,A 说法正确;
B.水泥生产过程中加入石膏的目的是为了调节水泥的凝结硬化速度,调整水泥的凝结时间,B 说法正确;
C.水与硅酸三钙(3CaO∙SiO2)发生化学反应,生成的产物形成相互交联的结构,C 说法错误;
D.硅酸三钙(3CaO∙SiO2)与水反应放热,以冰代水减少了热膨胀及水蒸气产生的气泡,保证建筑质量,D 说
法正确;
答案为 C。
15. 25℃时,按下表配制两份溶液.
一元弱酸溶液 加入的 NaOH 溶液 混合后所得溶液
1HA 10.0mL0.20mol L 15.0mL0.20mol L 溶液Ⅰ pH=5.0
1HB10.0mL0.20mol L 15.0mL0.20mol L 溶液Ⅱ pH=4.0
下列说法错误的是( )
A. 溶液Ⅰ中, - + + -c A >c Na >c H >c OH
B. Ⅰ和Ⅱ的 pH 相差 1.0,说明 a
a
K (HA) =10K (HB)
C. 混合Ⅰ和Ⅱ: + + - - -c Na +c H =c A +c(B )+c(OH )
D. 混合Ⅰ和Ⅱ: c(HA)>c(HB)
【答案】B
【解析】
【分析】
根据酸碱用量可知溶液Ⅰ为等浓度的 HA 和 NaA 混合溶液,溶液Ⅱ为 HB 和 NaB 的混合溶液,且溶液Ⅰ和
溶液Ⅱ中 HA、NaA、HB、NaB 的浓度相等。
【详解】A.由电荷守恒可知溶液Ⅰ中 + + - -c Na +c H =c OH +c A ,pH=5.0,则 + -c H c OH> ,
因此 - + + -c A >c Na >c H >c OH ,A 正确;
23
B.溶液Ⅰ的 pH=5.0 ,溶液Ⅱ的 pH=4.0 ,则 HB 的电离常数大于 HA 的电离常数, a
a
K (HA) 1 10K (HB)
< < ,B
错误;
C.由电荷守恒可知混合Ⅰ和Ⅱ有 + + - - -c Na +c H =c A +c(B )+c(OH ) ,C 正确;
D.由于 HB 的电离常数大于 HA 的电离常数,则混合Ⅰ和Ⅱ后有: c(HA)>c(HB) ,D 正确;
答案选 B。
二、非选择题:本题共 4 小题,共 55 分。
16. 无水 3FeCl 是常用的芳香烃取代反应催化剂,它具有易水解、易升华的性质。铁粉与氯气反应制备无水
3FeCl 的实验装置如图所示:
E 和 G 用来收集产物。回答下列问题:
(1)通入氯气后,A 中观察到有酸雾产生,C 中 2 5P O 的作用是_______。
(2)在 E、G 处收集产物是利用了 3FeCl _______的性质。
(3)实验过程中若 F 处出现堵塞,则在 B 处可观察到的现象是_______。可通过_______(填简单操作),使实
验能继续进行。
(4)Ⅰ中反应的离子方程式为_______。
(5)某同学用 5.60g 干燥铁粉制得无水 3FeCl 样品13.00g ,该次实验的产率是_______。
(6)实验室中还常用 2SOCl 与 3 2FeCl 6H O 晶体共热制备无水 3FeCl ,其化学反应方程式为_______.检验水合
三氯化铁原料中是否存在 2FeCl 的试剂是_______。
【答案】 (1). 除去酸雾 (2). 易升华 (3). B 处有气泡产生 (4). 适当加热 F 处 (5).
Cl2+2OH-=Cl-+ClO-+H2O (6). 80.00% (7). 3 2FeCl 6H O +6SOCl2=FeCl3+12HCl+6SO2 (8). 铁氰化
钾
【解析】
24
【分析】
潮湿的氯气通过浓硫酸时,水与浓硫酸相遇放出大量的热使三氧化硫逸出,三氧化硫遇到瓶内的空气中水
蒸气形成酸雾,C 中五氧化二磷的作用是除去酸雾,干燥的氯气和铁粉在 D 中反应生成氯化铁,因氯化铁
易升华,到达 E、G 后重新凝华收集得到氯化铁,反应不完的氯气用 I 中 NaOH 溶液吸收,H 中无水氯化钙
防止 I 中水蒸气进入 G 中使氯化铁水解。
【详解】(1)由分析可知,C 中 2 5P O 的作用是除去酸雾;
(2)在 E、G 处收集产物是利用了 3FeCl 易升华的性质;
(3)实验过程中若 F 处出现堵塞,则氯气将到达 B 处,看到有气泡产生,然后进入 NaOH 溶液中与 NaOH 反
应;氯化铁易升华,则可通过适当加热 F 处,使实验能继续进行;
(4)Ⅰ中未反应完的氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的离子方程式为
Cl2+2OH-=Cl-+ClO-+H2O;
(5)由 2Fe+3Cl2
Δ
2FeCl3 可知,每 2molFe 反应生成 2mol FeCl3,则 5.60g(0.1mol)干燥铁粉理论上可制得
0.1molFeCl3,质量为 0.1mol×162.5g/mol=16.25g,因此该次实验的产率是 13.00g 100%16.25g
=80.00%;
(6)若直接加热 3 2FeCl 6H O ,氯化铁会水解得氢氧化铁和 HCl,HCl 挥发,促进氯化铁水解,最终得到氢氧
化铁,实验室中常用 2SOCl 与 3 2FeCl 6H O 晶体共热制备无水 3FeCl ,说明该过程产生了 HCl 抑制了氯化铁
水解,结合原子守恒可知该反应的化学方程式为 3 2FeCl 6H O +6SOCl2=FeCl3+12HCl+6SO2;亚铁离子与铁氰
化钾相遇产生蓝色沉淀,因此检验水合三氯化铁原料中是否存在 2FeCl 的试剂是铁氰化钾溶液。
17. 熟地吡喃酮是从中药熟地中提取的有效成分,化合物 F 是合成熟地吡喃酮的一种中间体,合成路线如
图所示。
25
已知:
回答下列问题:
(1)F 中含氧官能团的名称是_______。
(2)A→B 的反应类型为_______。
(3)C 的核磁共振氢谱有_______组吸收峰。
(4)D 的结构简式是_______。
(5)E 和 F_______同分异构体(填“是”或“不是”)。
(6)化合物 是合成抗菌药磺胺甲 唑的一种中间体,写出以乙二酸和丙酮
( )为原料合成该化合物的反应方程式_______(其他无机及有机试剂任选)。
【答案】 (1). 醚键、羟基 (2). 酯化(取代)反应 (3). 6 (4). (5).
是 (6). CH3CH2OH 与 HOOCCOOH Δ浓硫酸 CH3CH2OOCCOOCH2CH3 与
2
(1)NaH
(2)H O
【解析】
【分析】
C 与 CH3-COCl 发生已知的反应,结合 F 的结构简式,可知 CH3-CO-取代 C 中醚键相邻碳原子上的氢原子,
26
则 D 为 。
【详解】(1)根据 F 的结构简式,含氧官能团的名称是醚键、羟基;
(2)A→B 为 A 与甲醇在浓硫酸加热的条件下发生酯化反应,反应类型为酯化(取代)反应;
(3)C 为对称结构 ,其中 C2H5-有 2 组氢原子,-OCH3 有 1 组,苯环上 1 组,-CH2COOCH3
有 2 组氢原子,核磁共振氢谱有 6 组;
(4)D 的结构简式为 ;
(5)E 和 F 的分子式均为 C14H16O4,其结构不同,互为同分异构体;
(6)生成化合物 ,需要 与乙二酸二乙酯反应制取,乙二酸二乙酯则需要乙二
酸与足量的乙醇反应制取,流程为 CH3CH2OH 与 HOOCCOOH Δ浓硫酸 CH3CH2OOCCOOCH2CH3 与
2
(1)NaH
(2)H O 。
18. 甲烷和水蒸气催化制氢主要有如下两个反应:
① 4 2 2CH (g)+H O(g)=CO(g)+3H (g) ΔH=+206kJ/mol
② 2 2 2CO(g)+H O(g)=CO (g)+H (g) ΔH=-41kJ/mol
恒定压强为100kPa 时,将 n(CH4)∶n(H2O)=1∶3 的混合气体投入反应器中,平衡时,各组分的物质的量分
数与温度的关系如图所示。
27
回答下列问题:
(1)写出 4CH 与 2CO 生成 2H 和 CO 的热化学方程式:_______。
(2)关于甲烷和水蒸气催化制氢反应,下列叙述正确的是_______(填标号)。
A.恒温、恒容条件下,加入惰性气体,压强增大,反应速率加快
B.恒温、恒容条件下,加入水蒸气,活化分子百分数增大,反应速率加快
C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快
D.加入合适的催化剂,降低反应温度也能实现单位时间转化率不变
(3)系统中 2H 的含量,在 700℃左右出现峰值,试从化学平衡的角度解释出现峰值的原因:
①低于 700℃,_______;
②高于 700℃,_______。
(4)已知投料比为 n(CH4)∶n(H2O)=1∶3 的混合气体,p=100kPa 。600℃时, 4CH 的平衡转化率为_______,
反应①的平衡常数的计算式为 pK = _______( pK 是以分压表示的平衡常数,分压=总压×物质的量分数)。
【答案】 (1). 4 2 2CH (g)+CO (g)=2CO(g)+2H (g) ΔH=247kJ/mol (2). C (3). 由于正反应方向吸
热,随着温度的升高,反应向正反应方向进行的程度较大,氢气的物质的量逐渐增大 (4). 随着反应的
进行,一氧化碳的物质的量增大,发生反应②,反应②正反应放热,当温度升高时,平衡逆向移动,使氢
气的物质的量减小 (5). 77.78% (6). 5859.375
【解析】
28
【分析】
【详解】(1)① 4 2 2CH (g)+H O(g)=CO(g)+3H (g) ΔH=+206kJ/mol
② 2 2 2CO(g)+H O(g)=CO (g)+H (g) ΔH=-41kJ/mol
根据盖斯定律,①-②,ΔH=+206kJ/mol+41kJ/mol=247kJ/mol,得到 4CH 和 2CO 生成 2H 和 CO 的热化学方
程式: 4 2 2CH (g)+CO (g)=2CO(g)+2H (g) ΔH=247kJ/mol;
(2)由反应 4 2 2CH (g)+H O(g)=CO(g)+3H (g) ΔH=+206kJ/mol;
A.恒温、恒容条件下,加入惰性气体,总压强增大,各物质的分压不变,各气体的浓度没变,化学反应速
率不变,故 A 不符合题意;
B.恒温、恒容条件下,加入水蒸气,活化分子百分数不变,单位体积活化分子数增加,有效碰撞几率增大,
反应速率加快,故 B 不符合题意;
C.升高温度,活化分子百分数增大,有效碰撞频率增大,反应速率加快,故 C 符合题意;
D.反应为吸热反应,加入合适的催化剂,缩短达到平衡的时间,但不影响平衡的移动,单位时间内气体的
转化率不变;降低反应温度,平衡逆向移动,单位时间内气体的转化率减小,故 D 不符合题意;
答案选 C;
(3)①温度低于 700℃时,由于正反应方向吸热,随着温度的升高,反应向正反应方向进行的程度较大,氢
气的物质的量逐渐增大;
②温度高于 700℃,随着反应的进行,一氧化碳的物质的量增大,发生反应②,反应②正反应放热,当温度
升高时,平衡逆向移动,使氢气的物质的量减小;
(4)已知投料比为 4 2n(CH ):n(H O)=1:3 的混合气体,设甲烷的初始物质的量为 1mol,水蒸气的物质的量为
3mol,设转化的甲烷的物质的量为 x,设转化的一氧化碳的物质的量为 y,
4 2 2
(mol) 1 3 0 0
CH (g) + H
(mo
O(g) CO(g) + 3H
l) x x x 3x
(mol) 1-x 3-x x
g
3x
( )
开始
变化
平衡
2 2 2CO(g) + H O(g) CO (g) + H (g)
(mol) x 3-x 0 3x
(mol) y y y y
(mol) x-y 3-x-y y 3x+y
开始
变化
平衡
由图可知,600℃时,CH4 的物质的量分数为 0.04,各气体的总物质的量为 1-x+3-x-y+x+3x+y=4+2x,
29
1-x
1-x+3-x+x+3x = 1-x
4+2x =0.04,解得 x= 7
9 mol, 4CH 的平衡转化率为
7 mol9
1mol
×100%=77.78%;
600℃时,由图可知,p=100kPa ,平衡时 H2 的物质的量分数为 0.50,可以得到:
21+y9
50
9
=0.5,解得 y= 4
9 mol,
平衡时 CO 的物质的量= 7
9 mol- 4
9 mol= 1
3 mol,CO 的物质的量分数为
1
3
50
9
=0.06,CH4 的物质的量分数为 0.04,
H2O 的物质的量分数为 0.32,H2 的物质的量分数为 0.50,反应①的平衡常数的计算式为
Kp=
3
2
2 4
p (H )p(CO)
p(H O)p(CH ) =
3(100 0.5) (100 0.06)
(100 0.32) (100 0.04)
=5859.375。
19. 某化学兴趣小组通过查阅文献,设计了从某厂阳极泥(成分为 Cu、Ag2Se、Au、Pt)中回收贵重金属的工
艺,其流程如图所示。
回答下列问题:
(1)写出“焙烧”时,生成 2SeO 的化学反应方程式_______。
(2)“滤液”中的金属阳离子有_______;“酸浸氧化”中通入氧气的目的是_______、_______。
(3)“酸溶”时 Pt、Au 分别转化为 2-
6PtCl 和 -
4AuCl ,写出 Au 溶解的离子方程式_______。
(4)可从“有机层”回收的金属是_______。实验室“萃取分液”的玻璃仪器有_______、_______。
(5)电解 4 3 2NH Au SO 溶液回收 Au 的阴极反应式为_______。
【答案】 (1). 2Ag2Se+3O2=2 2SeO +2Ag2O (2). Cu2+、Ag+ (3). 氧化可能存在的 Cu、 2SeO (4).
防止硝酸产生的 NO 排放到空气中污染空气 (5). 2Au+3Cl2+2Cl-=2 -
4AuCl (6). Pt (7). 烧杯
(8). 分液漏斗 (9). Au3++3e-=Au
【解析】
【分析】
30
阳极泥(成分为 Cu、Ag2Se、Au、Pt)通入氧气焙烧得 CuO、Ag2O、SeO2、Au、Pt,Se 以 SeO2 形式除去,烧
渣成分为 CuO、Ag2O、Au、Pt;将烧渣酸浸氧化,CuO、Ag2O 溶解,滤液为硝酸铜、硝酸银溶液,滤渣为
Au、Pt;酸溶时,Au、Pt 转化为[AuCl4]-、[PtCl6]2-,用磷酸三丁酯萃取-分液,得到 H2[PtCl6]的有机溶液,
水层为 H[AuCl4]-(aq),加入 KOH、(NH4)2SO3 转化为 NH4[Au(SO3)2]。
【 详 解 】 (1)“ 焙 烧 ” 时 , Ag2Se 被 氧 气 氧 化 生 成 2SeO 和 Ag2O , 反 应 的 化 学 反 应 方 程 式 为
2Ag2Se+3O2=2 2SeO +2Ag2O;
(2)由分子可知“滤液”中的金属阳离子有 Cu2+、Ag+;烧渣中可能还含有 Cu、 2SeO ,与硝酸直接反应会产生
NO 有毒气体,因此“酸浸氧化”中通入氧气的目的是氧化可能存在的 Cu、 2SeO ;防止硝酸产生的 NO 排放
到空气中污染空气;
(3)“酸溶”时 Pt、Au 分别转化为 2-
6PtCl 和 -
4AuCl ,则 Au 溶解的离子方程式为
2Au+3Cl2+2Cl-=2 -
4AuCl ;
(4)由分析可知,可从“有机层”回收的金属是 Pt;实验室“萃取分液”的玻璃仪器有烧杯;分液漏斗;
(5)电解 4 3 2NH Au SO 溶液回收 Au 的阴极反应式为 Au3++3e-=Au。
相关文档
- 40篇短文搞定高考3500个单词2021-05-1321页
- 2020-2021学年高考数学(理)考点:直线2021-05-1310页
- 高考数学考点归纳之 直线、平面垂2021-05-1312页
- 高考数学考点归纳之参数方程2021-05-1312页
- 2020-2021年高考文言文解题技巧概2021-05-139页
- 2020-2021年高考生物一轮复习知识2021-05-1310页
- 2020年高考真题——理综(全国卷Ⅲ) W2021-05-1348页
- 2021年高考语文一轮复习论述类文本2021-05-1310页
- 高考数学考点归纳之导数的概念及运2021-05-1315页
- 2020年高考真题——理科数学(全国卷2021-05-1324页