- 281.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
2019年人教高考化学一轮选练习题(4)及答案
1、(2019届湖北省荆州中学高三全真模拟考试一)设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 一定条件下,丁烷催化裂化生成1mol乙烯时,消耗丁烷的数目为NA
B. 常温常压下,0.5 molO3与11.2 LO2 所含的分子数均为0.5NA
C. 用惰性电极电解CuSO4溶液一段时间后,若加入29.4 gCu(OH)2 能使溶液复原,则电解过程中转移电子的数目为1.2NA
D. 25℃时,1LpH=10的NaHCO3溶液中含有H2CO3的数目为10-4NA
【答案】C
【解析】A. 一定条件下,丁烷催化裂化除生成乙烯和乙烷这种均裂外,还会裂解成甲烷和丙烯,则生成1mol乙烯时,消耗丁烷的数目大于NA,A错误;B. 常温常压下,11.2LO2的物质的量小于0.5ml,0.5molO3与11.2LO2所含的分子数不相等,B错误;C.若加入29.4gCu(OH)2能使溶液复原,则相当于阴极析出铜和氢气,29.4gCu(OH)2的物质的量为0.3mol,相当于0.3molCuO和0.3molH2O,生成0.3mol铜转移电子个数为0.6NA,根据原子守恒,生成0.3mol水需要0.3mol氢气,生成0.3mol氢气转移电子的个数为0.6NA,所以电解过程中共转移电子的数目为1.2NA,C正确;D. 25℃时,1LpH=10的NaHCO3溶液中,根据电荷守恒有:c(H+)+c(Na+)=c(OH-)+2c(CO32-)+c(HCO3-),根据物料守恒有:c(Na+)=c(H2CO3)+c(CO32-)+c(HCO3-),两式削去c(Na+),可得:c(H+)+ c(H2CO3)= c(OH-), 所以c(H2CO3)= c(OH-)-c(H+)=10-4mol/L-10-10mol/L<10-4mol/L,即含有H2CO3的数目小于10-4NA,故D错误;综合以上分析,本题选C。
2、在标准状况下①6.72L CH4 ②3.0l×l023个HC1分子 ③13.6g H2S ④0.2molNH3,下列对这四种气体的关系从小到大表示不正确的是( )
A.氢原子数:②<④<③<① B.密度:①<④<③<②
C.质量:④<①<③<② D.体积:④<①<②<③
【答案】D
【解析】A、①氢原子物质的量为6.72×4/22.41mol=1.2mol,②氢原子物质的量为
3.01×1023/6.02×1023mol=0.5mol,③氢原子物质的量为13.6×2/34mol=0.8mol,④氢原子物质的量为0.2×3mol=0.6mol,因此氢原子物质的量大小为①>③>④>②,故说法正确;B、相同条件下,密度之比等于摩尔质量之比,摩尔质量分别是16g·mol-1、36.5g·mol-1、34g·mol-1、17g·mol-1,密度由大到小的顺序是②③④①,故说法正确;C、质量分别是0.3×16=4.8g、0.5×36.5g=18.25g、13.6g、0.2×17g=3.4g,质量由大到小的顺序是②③①④,故说法正确;D、体积之比等于物质的量之比,物质的量分别是0.3mol、0.5mol、0.4mol、0.2mol,体积由大到小的顺序是②③①④,故说法错误。
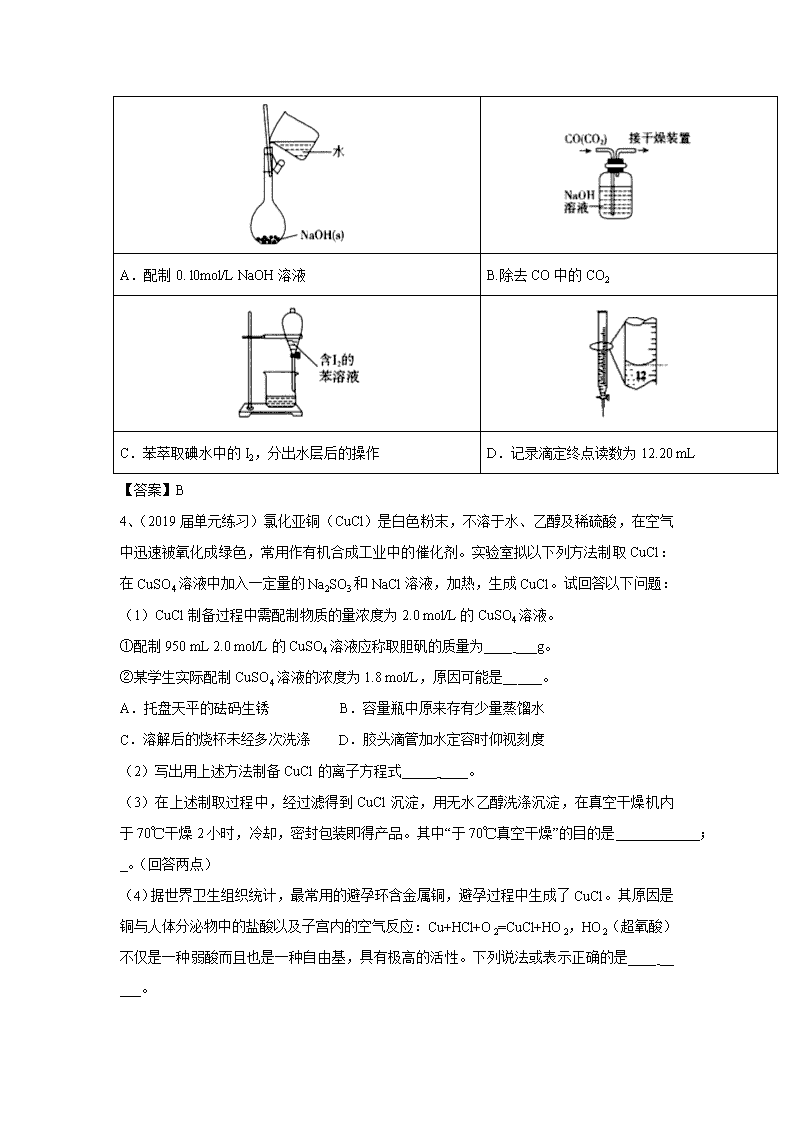
3、(2019届安徽省合肥市高三上学期第一次教学质量检测)下列有关实验的选项正确的是
A.配制0. l0mol/L NaOH溶液
B.除去CO中的CO2
C.苯萃取碘水中的I2,分出水层后的操作
D.记录滴定终点读数为12.20 mL
【答案】B
4、(2019届单元练习)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。实验室拟以下列方法制取CuCl:在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl。试回答以下问题:
(1)CuCl制备过程中需配制物质的量浓度为2.0 mol/L的CuSO4溶液。
①配制950 mL 2.0 mol/L的CuSO4溶液应称取胆矾的质量为____ ___g。
②某学生实际配制CuSO4溶液的浓度为1.8 mol/L,原因可能是__ ___。
A.托盘天平的砝码生锈 B.容量瓶中原来存有少量蒸馏水
C.溶解后的烧杯未经多次洗涤 D.胶头滴管加水定容时仰视刻度
(2)写出用上述方法制备CuCl的离子方程式_____ ____。
(3)在上述制取过程中,经过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。其中“于70℃真空干燥”的目的是 ; _。(回答两点)
(4)据世界卫生组织统计,最常用的避孕环含金属铜,避孕过程中生成了CuCl。其原因是铜与人体分泌物中的盐酸以及子宫内的空气反应:Cu+HCl+O2=CuCl+HO2,HO2(超氧酸) 不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是____ __ ___。
A. 氧化产物是HO2
B. HO2在碱中能稳定存在
C. HO2的电离方程式是HO2H+ + O2-
D. 1mol Cu 参加反应有2mol电子发生转移
【答案】(1)①500;②CD;(2)2Cu2++SO32—+2Cl—+H2O2CuCl↓+SO42—+2H+;
(3)加快乙醇和水的蒸发,防止CuCl被空气氧化;(4)C。
根据题目中信息,离子反应方程式为:2Cu2++SO32-+2Cl-+H2O2CuCl↓+2H++SO42-;(3)乙醇易挥发,水易蒸发,70℃有利于乙醇和水的蒸发,根据信息CuCl在空气中迅速被氧化,真空的目的防止CuCl的氧化,因此70℃真空干燥的目的:加快乙醇和水的蒸发,防止CuCl被空气氧化;(4)A、HO2由O2产生,O2是氧化剂,则HO2属于还原产物,故错误;B、HO2是超氧酸,和碱发生中和反应,故错误;C、HO2是弱酸,应是部分电离,HO2H+O2-,故正确;D、Cu由0价→+1价,因此1molCu参加反应转移1mole-,故错误。
【易错辨析】
1. 定容、摇匀后液面下降也不要继续滴加蒸馏水,否则会导致结果偏低。
2. 配制时不需要计算水的用量,因此容量瓶不必是干燥的,有少量蒸馏水不影响结果。
3. 如果没有冷却到室温就定容,所配溶液浓度偏大。
4. 定容时俯视、仰视对结果的影响是最容易判断错误的,务必确保按眼睛视线→刻度线→凹液面最低点的次序,做到“三点一线”。
①仰视刻度线(图1),导致溶液体积偏大。
②俯视刻度线(图2),导致溶液体积偏小。
其他如量筒、滴定管的分析也一样。
5、(2019届新疆乌鲁木齐地区高三第一次诊断测试)下列实验方案能达到实验目的的是
实验目的
实验方案
A
检验Na2SO3晶体是否已氧化变质
将Na2SO3样品溶于稀硝酸后,滴加BaCl2
溶液,观察是否有沉淀生成
B
证明酸性条件下H2O2氧化性强于I2
向淀粉KI溶液中滴入3滴稀硫酸,未见溶液变蓝;再加入10%的H2O2溶液,溶液立即变蓝色
C
制备氢氧化铁胶体
向沸水中滴加氯化铁稀溶液,继续煮沸至溶液呈红褐色
D
证明Mg(OH)2沉淀可转化为Fe(OH)3沉淀
向2 mL1mol/L NaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液
【答案】B
水中滴加5~6滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热,C项错误;D,NaOH溶液与MgCl2溶液反应生成Mg(OH)2沉淀后NaOH过量,过量的NaOH与FeCl3溶液形成红褐色Fe(OH)3沉淀,不能证明发生了沉淀的转化,D项错误;答案选B。
6、(2019届山东省济南第一中学高三10月阶段测试)下列说法正确的是
A. 酸化高锰酸钾溶液时可以用盐酸酸化
B. 金属钠着火时不能用泡沫灭火器灭火
C. 氢氧化铁胶体的电泳实验,证明了氢氧化铁胶体带电荷
D. 能与碱反应生成盐和水的氧化物一定是酸性氧化物
【答案】B
【解析】A、盐酸与高锰酸钾会发生氧化还原反应,故酸化高锰酸钾溶液时不可以用盐酸酸化,选项A错误;B、Na点燃生成过氧化钠,过氧化钠与CO2反应生成O2,反而使燃烧更加剧烈,选项B正确;C、胶体能发生电泳现象是由于胶体带电荷,而胶体是电中性分散系,选项C错误;D、Al2O3是两性氧化物,能与酸反应生成盐和水,也能与碱反应生成盐和水,选项D错误。答案选B。
7、(2019届江苏省普通高中学业水平测试)下列反应的离子方程式书写正确的是( )
A. H2SO4溶液与氨水反应:H++OH-===H2O
B. CuO与稀盐酸反应:CuO+2H+===Cu2++H2O
C. AlCl3溶液与氢氧化钠溶液反应:AlCl3+3OH-===Al(OH)3↓+3Cl-
D. Cl2与氢氧化钠溶液反应:Cl2+2OH-===2ClO-+H2O
【答案】B
【解析】A. 一水合氨是弱电解质,应该用化学式表示,A错误;B. CuO与稀盐酸反应:CuO+2H+=Cu2++H2O,B正确;C. AlCl3在溶液中完全电离,应该用离子符号表示,C错误;D. Cl2与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,D错误。答案选B。
8、若溶液中由水电离产生的c(OH-)=1×10-14mol·L-1,满足此条件的溶液中一定可以大量共存的离子组是 ( )
A.Al3+ Na+ NO-3 Cl- B.K+ Na+ Cl- NO3-
C.K+ Na+ Cl- AlO2- D.K+ NH4+ SO42- NO3
A项Al3+不能在碱性溶液中大量共存;C项AlO2-不能在酸性溶液中大量共存;D项NH4+不能在碱性溶液中大量共存。选B。
9、(2019届安徽省A10联盟高三开年考试)下列对KNO3的古代文献的说明不合理的是( )
选项
目的
古代文献
说明
A
提纯
“…(KNO3)所在山泽,冬月地上有霜,扫” 取以水淋汁后,乃煎炼而成”——《开宝本草》
溶解,蒸发结晶
B
鉴别
区分硝石(KNO3)和朴消(Na2SO 4), “强烧之,紫青烟起,云是硝石也”—— 《本草经集注》
利用焰色反应
C
性质
“(火药) 乃焰消 (KNO3),硫磺,山木碳所合,以为烽燧铜用诸药者”——《木草纲目》
利用KNO3
的氧化性
D
使用
“…凡研消(KNO3) 不以铁碾入石臼,想激火生,锅不可测”——《天工开物》
KNO3能自燃
【答案】D
10、(2019届河北省邯郸市高三1月教学质量检测)硫代硫酸钠溶液与氯气能发生反应:Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4。下列说法错误的是( )
A. 氧化产物、还原产物的物质的量之比为1∶1
B. 若0.5molNa2S2O3作还原剂;则转移4mol电子
C. 当Na2S2O3过量时,溶液能出现浑浊
D. 硫代硫酸钠溶液吸收氯气后,溶液的pH降低
【答案】A
【解析】硫代硫酸钠溶液与氯气能发生反应:Na2S2O3+4Cl2+5H2O=2NaCl+6HCl+2H2SO4。由化学方程式可知,氯气是氧化剂、硫代硫酸钠是还原剂、氯化钠和盐酸是还原产物、硫酸是氧化产物,反应中电子转移的数目为8e-。A. 氧化产物、还原产物的物质的量之比为1∶3,A不正确;B. 若0.5molNa2S2O3作还原剂,则转移4mol电子,B正确;C. 当Na2S2O3过量时,过量的部分可以与硫酸反应生成硫,所以溶液能出现浑浊,C正确;D. 硫代硫酸钠溶液吸收氯气后生成了酸,故溶液的pH降低,D正确。本题选A。
11、(2019届山东省潍坊市昌乐县第二中学高三下学期一模拉练)CoCl2•6H2O是一种饲料营养强化剂。可由水钴矿[主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等]制取,其工艺流程如下:
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等.
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表.
沉淀物
Fe(OH)3
Fe(OH)2
Co(OH)2
Al(OH)3
Mn(OH)2
开始沉淀
2.7
7.6
7.6
4.0
7.7
完全沉淀
3.7
9.6
9.2
5.2
9.8
③CoCl2•6H2O熔点为86℃,加热至110﹣120℃时,失去结晶水生成CoCl2.
回答下列问题:
(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为________________________。
(2)向浸出液中加入适量NaClO3目的是______________________________________。
(3)“加Na2CO3调pH至a”,a=______;过滤所得沉淀的主要成分为_________(填化学式)。
(4)萃取剂对金属离子的萃取与溶液pH的关系如下图所示,向“滤液”中加入该萃取剂的目的是__________,使用该萃取剂的最佳pH范围是_____(填选项字母)
A. 5.0﹣5.5 B. 4.0﹣4.5 C. 3.0﹣3.5 D. 2.0﹣2.5
(5)实验操作“操作1”为_______________、_________、过滤和减压烘干;制得的CoCl2•6H2O在烘干时需减压烘干的原因是________________________。
【答案】 Fe2O3+Na2SO3+4HCl=2FeCl2+Na2SO4+2H2O 将Fe2+氧化为Fe3+,易于除去铁元素 5.2 Fe(OH)3、Al(OH)3 除去溶液中的Mn2+ C; 蒸发浓缩 冷却结晶 降低烘干温度,防止产品分解
要含有CoCl2,为得到CoCl2•6H2O晶体,将溶液蒸发浓缩、冷却结晶而得到粗产品。(1)浸出水钴矿过程中,Fe2O3发生反应的化学方程式为Fe2O3+Na2SO3+4HCl=2FeCl2+Na2SO4+2H2O;(2)向浸出液中加入适量NaClO3目的是将Fe2+氧化为Fe3+,易于除去铁元素;(3) “加Na2CO3调pH至a”,a=5.2,保证铝离子沉淀完全,铝离子能与碳酸根离子发生双水解生成氢氧化铝和二氧化碳,水解的离子方程式为:2Al3++3CO32-+3H2O=2Al(OH)3↓+3CO2↑;铁离子能与碳酸根离子发生双水解生成氢氧化铁和二氧化碳,水解的离子方程式为:2Fe3++3CO32-+3H2O=2Fe(OH)3↓+3CO2↑,所以沉淀成分为:Fe(OH)3、Al(OH)3;(4)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;故答案为:除去溶液中的Mn2+;C ;(5)实验操作“操作1”为蒸发浓缩、冷却结晶、过滤和减压烘干;根据CoCl2•6H2O的组成分析,造成产品中CoCl2•6H2O的质量分数大于100%的原因可能是:含有杂质,导致氯离子含量大或结晶水化物失去部分水,导致相同质量的固体中氯离子含量变大。
12、(2019年江西省赣州市高三(5月)适应性考试)铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(含BeO:25%、CuS:71%、少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
已知:I.铍、铝元素化学性质相似
II.常温下:Ksp[Cu(OH)2]=2.2×10-20、Ksp[Fe(OH)3]=4.0×10-38、Ksp[Mn(OH)2]=-2.1×10-13
(1)滤液A的主要成分除NaOH外,还有_____ (填化学式),写出反应I中含铍化合物与过量盐酸反应的离子方程式_____________。
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择最合理步骤顺序______。
a.加入过量的NaOH b.通入过量的CO2 c.加入过量的氨水
d.加入适量的HC1 e.过滤 f.洗涤
②从BeCl2溶液中得到BeCl2固体的操作是________________。
(3)①MnO2能将金属硫化物中的硫元素氧化为硫单质,写出反应II中CuS 发生反应的化学方程式______________。
②若用浓HNO3溶解金属硫化物,缺点是____________(任写一条)。
(4)溶液D中含c(Cu2+)=2.2mol/L、c(Fe3+)=0.008mol/L c(Mn2+)=0.01mol/L,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是___ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于____。
【答案】 Na2SiO3、Na2BeO2 BeO22-+4H+=Be2++2H2O cefd
在氯化氢气流中蒸发结晶(或蒸发结晶时向溶液中持续通入氯化氢气体) MnO2+CuS+2H2SO4=S+MnSO4+CuSO4+2H2O 产生污染环境的气体 Fe3+ 4
【解析】考查化学工艺流程,(1)旧铍铜原件的成分BeO、CuS、FeS、SiO2,根据信息I,BeO属于两性氧化物,CuS不与氢氧化钠溶液反应,FeS不与氢氧化钠反应,SiO2属于酸性氧化物,能与氢氧化钠溶液反应,因此滤液A中主要成分是NaOH、Na2SiO3、Na2BeO2;根据信息I,BeO2-与过量盐酸反应生成氯化铍和水。其离子方程式为BeO22-+4H+=Be2++2H2O;答案:Na2SiO3、Na2BeO2,BeO22-+4H+=Be2++2H2O。
(2)①利用Be元素、铝元素化学性质相似,向溶液C中先加入过量的氨水,生成Be(OH)2沉淀,然后过滤、洗涤,再加入适量的HCl,生成BeCl2,合理步骤是cefd;
②为了抑制Be2+的水解,因此需要在HCl的氛围中对BeCl2溶液蒸发结晶;
(3)①根据信息,CuS中S转化为S单质,MnO2中Mn被还原为Mn2+,根据化合价升降法进行配平,其化学反应方程式为MnO2+CuS+2H2SO4=S↓+MnSO4+CuSO4+2H2O;②用浓硝酸作氧化剂,浓HNO3被还原成NO2,NO2有毒污染环境;
(4)三种金属阳离子出现沉淀,根据浓度商与Ksp的关系,Cu2+转化成沉淀,c(OH-)=mol·L-1,Fe3+转化成沉淀,c(OH-)=mol·L-1,Mn2+转化成沉淀,c(OH-)=mol·L-1,因此首先沉淀的是Fe3+,为使Cu2+沉淀,此时c(OH-)=1×10-10mol·L-1,c(H+)=10-14/10-10=10-4mol·L-1,即pH=4,当pH>4时,Cu2+出现沉淀;