- 851.50 KB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
课时作业25 原电池 化学电源
(时间:45分钟 分数:100分)
一、选择题(本题共10小题,每小题5分,共50分,每小题只有一个选项符合题目要求)
1.下列有关原电池的叙述中错误的是( )。
A.原电池是将化学能转化为电能的装置
B.用导线连接的两种不同金属同时插入液体中,能形成原电池
C.在原电池中,电子流出的一极是负极,发生氧化反应
D.在原电池放电时,电解质溶液中的阳离子向正极移动
2.(2019浙江温州三模)综合下图判断,下列说法中正确的是( )。
A.装置Ⅰ和装置Ⅱ中负极反应均是:Fe-2e-===Fe2+
B.装置Ⅰ和装置Ⅱ中正极反应均是:O2+4e-+2H2O===4OH-
C.装置Ⅰ和装置Ⅱ中盐桥中的阳离子均向右侧烧杯移动
D.放电过程中,装置Ⅰ左侧烧杯和装置Ⅱ右侧烧杯中溶液的pH均增大
3.可用于电动汽车的铝空气燃料电池,通常以NaCl溶液或NaOH溶液为电解液,铝合金为负极,空气电极为正极。下列说法中正确的是( )。
A.以NaOH溶液为电解液时,负极反应为:Al+3OH--3e-===Al(OH)3↓
B.以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-===4OH-
C.以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变
D.电池工作时,电子通过外电路从正极流向负极
4. (2019山东济南外国语学校训练)据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示。下列说法中正确的是( )。
A.电池放电时Na+从b极区移向a极区
B.每消耗3 mol H2O2,转移的电子为3 mol
C.电极a采用MnO2,MnO2既作电极材料又有催化作用
D.该电池的负极反应为:BH+8OH--8e-===BO+6H2O
5.(2019河北保定一模)“人造树叶”能够像树叶的光合作用那样,将太阳光进行俘获并就地产生氢燃料。当太阳光照射到“人造树叶”上,在催化剂作用下把水变成氧气和氢离子,氢离子向下穿过塑料薄膜结合电子产生氢气;将人造树叶与碱式燃料电池进行组合而成的太阳能燃料电池的工作原理如图所示。下列有关说法中不正确的是( )。
A.太阳能燃料电池可以将太阳能转化为电能
B.太阳能燃料电池最大的优点在于它的发电方式
C.该塑料薄膜上部的反应为:2H2O-4e-===O2↑+4H+
D.该燃料电池负极的电极反应式为:H2-2e-===2H+
6.(2019浙江部分重点中学联考)高效能电池的研发制约电动汽车的推广。有一种新型的燃料电池,它以多孔镍板为电极插入KOH溶液中,然后分别向两极通入乙烷和氧气,其总反应为:2C2H6+7O2+8KOH===4K2CO3+10H2O,有关此电池的推断中正确的是( )。
A.负极反应为:14H2O+7O2+28e-===28OH-
B.放电过程中KOH的物质的量浓度不变
C.每消耗1 mol C2H6,则电路上转移的电子为14 mol[来源:学.科.网Z.X.X.K]
D.放电一段时间后,负极周围的pH升高
7.控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。下列判断中不正确的是( )。
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
8.(2019湖北三校联考)根据下图所标电子流向,判断下列说法中错误的是( )。
A.石墨电极为正极,Ag电极为负极
B.负极电极反应:Fe3++e-===Fe2+
C.盐桥中阴离子移向AgNO3 溶液
D.总反应为Fe3++Ag===Fe2++Ag+
9.用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂KNO3的U形管)构成一个原电池。以下有关该原电池的叙述正确的是( )。
①在外电路中,电流由铜电极流向银电极 ②正极反应:Ag++e-===Ag ③实验过程中取出盐桥,原电池仍继续工作 ④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
A.①② B.②③ C.②④ D.③④
10.将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如下图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大)
金属
电子流动方向
电压/V
甲
甲―→Cu
+0.78
乙
Cu―→乙
-0.15
丙
丙―→Cu
+1.35
丁
丁―→Cu
+0.30
依据记录数据判断,下列结论中正确的是( )。
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀[来源:Zxxk.Com]
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极
二、非选择题(本题共4小题,共50分)
11.(12分)(1)ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。该电池的负极材料是______。电池工作时,电子流向______极(填“正”或“负”)。
(2)在下图装置中,观察到图1装置铜电极上产生大量的无色气泡,而图2装置中铜电极上无气体产生,铬电极上产生大量有色气体。由图1知金属铬的活动性比铜______(填“强”或“弱”),图2装置中铬电极的电极反应______________________________。
(3)有人设想寻求合适的催化剂和电极材料,分别以N2、H2为电极反应物,以HClNH4Cl溶液为电解质溶液制造新型燃料电池,试写出该电池的正极电极反应__________________ _____________________________________________________________________________。
12.(12分)第三代混合动力车,可以用电动机、内燃机或二者结合驱动车轮。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如下图,其总反应式为:H2+2NiOOH2Ni(OH)2
根据所给信息判断,混合动力车上坡或加速时,乙电极周围溶液的pH______(填“增大”“减小”或“不变”),该电极的电极反应为___________________________________。
(2)氨气在纯氧中燃烧,生成一种单质和水,试写出该反应的化学方程式____________,科学家利用此原理,设计成氨气—氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应为__________________________。
13.(14分)熔融碳酸盐燃料电池(MCFS),发明于1889年。现有一个碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650 ℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接作燃料,其工作原理如图所示。
请回答下列问题:
(1)B极为______极,发生______(填“氧化”或“还原”)反应。
(2)电池总反应为________________________________________________________。
(3)以此电源电解足量的CuSO4溶液,阳极产生气体0.56 L(标准状况下),则阴极产物的质量为______ g。电解后溶液体积为1 L,溶液的pH约为______。
(4)电池中的电解质碳酸钠形成的水溶液体系不能用带玻璃塞的试剂瓶保存,其原因是__________________________(用离子方程式表示)。
14.(12分)(1)Fe和KClO4反应放出的热量,能为熔融盐电池提供550~660 ℃的温度,使低熔点盐熔化导电,从而激活电池。这类电池称为热电池。Li/FeS2热电池工作时,Li转变为硫化锂,FeS2转变为铁,该电池工作时,电池总反应为:_________________________。
(2)下图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测。则该电池的负极反应为____________________。正极反应为________________________________________________________________________。
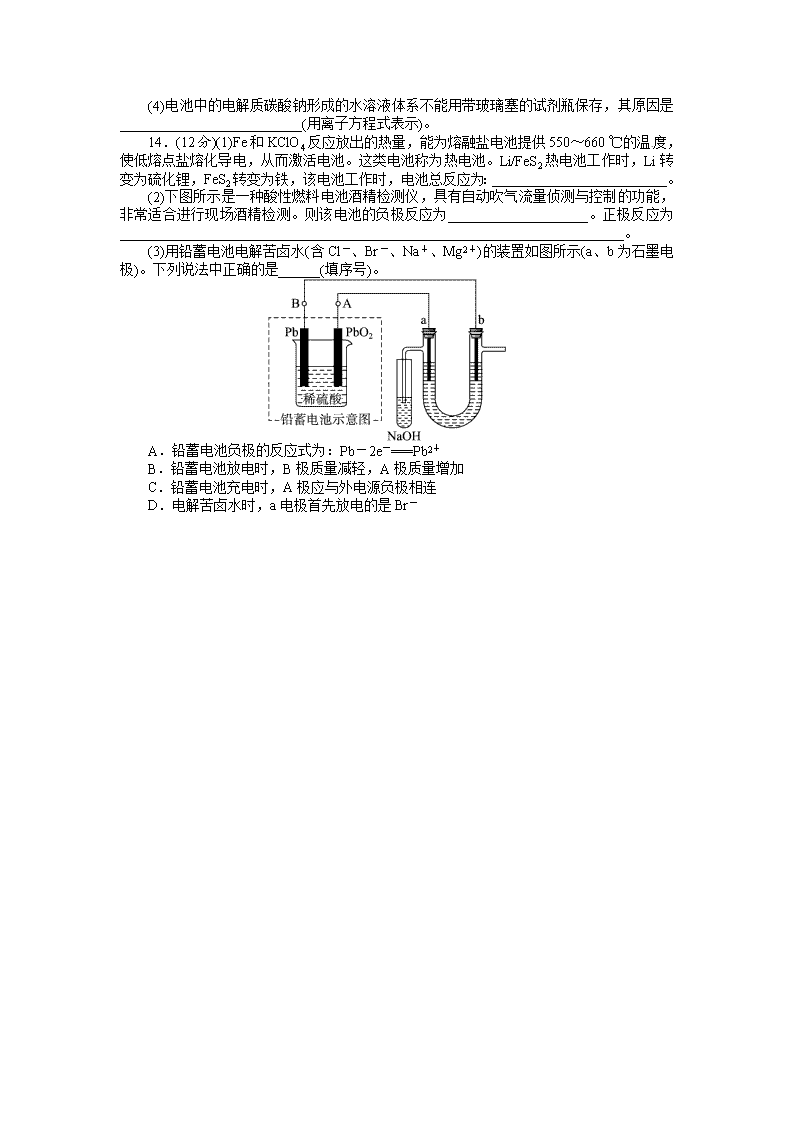
(3)用铅蓄电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极)。下列说法中正确的是______(填序号)。
[来源:Z|xx|k.Com]
A.铅蓄电池负极的反应式为:Pb-2e-===Pb2+
B.铅蓄电池放电时,B极质量减轻,A极质量增加
C.铅蓄电池充电时,A极应与外电源负极相连
D.电解苦卤水时,a电极首先放电的是Br-
参考答案
1.B 解析:B选项,液体不一定导电、也不一定能形成自发进行的氧化还原反应,错误。
2.D 解析:装置Ⅰ中Zn为负极,电极反应为Zn-2e-===Zn2+,A、C选项错误;装置ⅡCu为正极,电极反应为O2+4e-+4H+===2H2O,可知B选项错误;由电极反应式可知装置Ⅰ正极生成OH-、装置Ⅱ消耗H+,D选项正确。
3.B 解析:A项,由于电解液为NaOH溶液,所以一定不会存在Al(OH)3沉淀;C项,电池反应为:4Al+3O2+4OH-===4AlO+2H2O,所以电解液的pH减小;D项,电子应从负极流向正极。
4.D 解析:NaBH4中的H化合价为-1,反应中失电子生成水,D选项正确,a为负极,阳离子从负极流向正极,A、C选项错误;H2O2生成OH-,O的化合价由-1降低为-2,3 mol H2O2转移的电子为6 mol,B选项错误。
5.D 解析:由碱式燃料电池可知D选项错误。
6.C 解析:燃料作负极,氧气作正极,A选项错误;由总反应可知放电过程中消耗KOH,B选项错误;分析总反应,7个O2参加反应转移28个电子,C选项正确;负极电极反应式为C2H6+18OH--14e-===2CO+12H2O,可知D选项错误。
7.D 解析:对于本题,甲中石墨作正极,发生还原反应,电极反应为2Fe3++2e-===2Fe2+;乙中石墨作负极,发生氧化反应,电极反应为2I--2e-===I2。当反应达到平衡时,正逆反应速率相等,此时电路中电流为零,故灵敏电流计的读数为零,选项A、B、C均正确。当灵敏电流计的读数为零后,在甲中再溶入FeCl2,导致化学平衡逆向移动,即把该反应的逆反应设置成原电池,甲中石墨作负极,发生氧化反应,电极反应为2Fe2+-2e-===2Fe3+;乙中石墨作正极,发生还原反应,电极反应为I2+2e-===2I-,D错。
8.B 解析:由电子流动的方向可知石墨为正极,B选项错误。
9.C 解析:Cu作负极,Ag作正极,构成原电池。负极:Cu-2e-===Cu2+,正极:Ag++e-===Ag,②对。在外电路中,电子由Cu电极流向Ag电极,而电流方向与电子流向相反,所以①错。没有盐桥,原电池不能继续工作,③错。反应实质相同,均为2Ag++Cu===Cu2++2Ag,④对。
10.B 解析:由电子流向可知金属活泼性:甲>Cu、Cu>乙、丙>Cu、丁>Cu,乙最不活泼,A、C选项错误,B正确;由电压表的读数可知甲的活泼性大于丁,所以D错误。
11.答案:(1)Zn(或锌) 正
(2)强 NO+4H++3e-===NO↑+2H2O
(3)N2+8H++6e-===2NH
解析:(2)由图1和图2的实验现象可知:图1铜电极上产生氢气为正极,图2中Cr电极生成NO,所以NO在正极得电子,用H+、H2O配平即可;(3)正极N2得6个电子,由电解质HClNH4Cl溶液显酸性,所以生成NH,最后用H+配平即可。
12.答案:(1)增大 NiOOH+e-+H2O===Ni(OH)2+OH-
(2)4NH3+3O22N2+6H2O 负极 2NH3-6e-+6OH-===N2+6H2O
解析:(1)上坡或加速时电动机工作,为原电池,因为实线部分,乙电极为正极,电极反应为NiOOH+e-+H2O===Ni(OH)2+OH-,pH增大;(2)燃料作负极;NH3中N的化合价升高3,所以2NH3-6e-―→N2,碱性溶液中用OH-配平电荷2NH3-6e-+6OH-―→N2,用水配平H。
13.答案:(1)正 还原 (2)CO+H2+O2===CO2+H2O
(3)3.2 1 (4)CO+H2OHCO+OH-
解析:(2)由图可知产物为CO2、H2O,且CO、H2的体积比为1∶1,即可写出方程式;[来源:学*科*网Z*X*X*K]
(3)阳极4OH--4e-===O2↑+2H2O,产生0.025 mol的O2,则消耗0.1 mol OH-、失0.1 mol电子,生成H+为0.1 mol,所以阴极得0.1 mol电子,依Cu2++2e-===Cu可知生成0.05 mol Cu;
(4)碳酸钠水解呈碱性,能腐蚀玻璃,使塞与瓶粘在一起。
14.答案:(1)FeS2+4Li===Fe+2Li2S
(2)CH3CH2OH+H2O-4e-===CH3COOH+4H+
O2+4e-+4H+===4H2O
(3)D
解析:(1)依据信息可知反应物为FeS2、Li,生成物为Fe、Li2S,依据得失电子守恒配平即可;(2)由信息可知电解质溶液为酸性,正极1个O2得到4个电子生成H2O,由CH3CH2OH、CH3COOH的分子式分别为C2H6O、C2H4O2,碳原子化合价分别为-2、0,可得CH3CH2OH-4e-―→CH3COOH,依据电荷守恒前面减4个负电荷,后面加4个H+,最后用水配平;(3)负极Pb失电子生成PbSO4,B极质量增大,A、B选项错误;A极为正极充电时应与电源正极相连,C选项错误;a极与电源正极相连为电解池阳极,阴离子失电子,D选项正确。