- 1.11 MB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
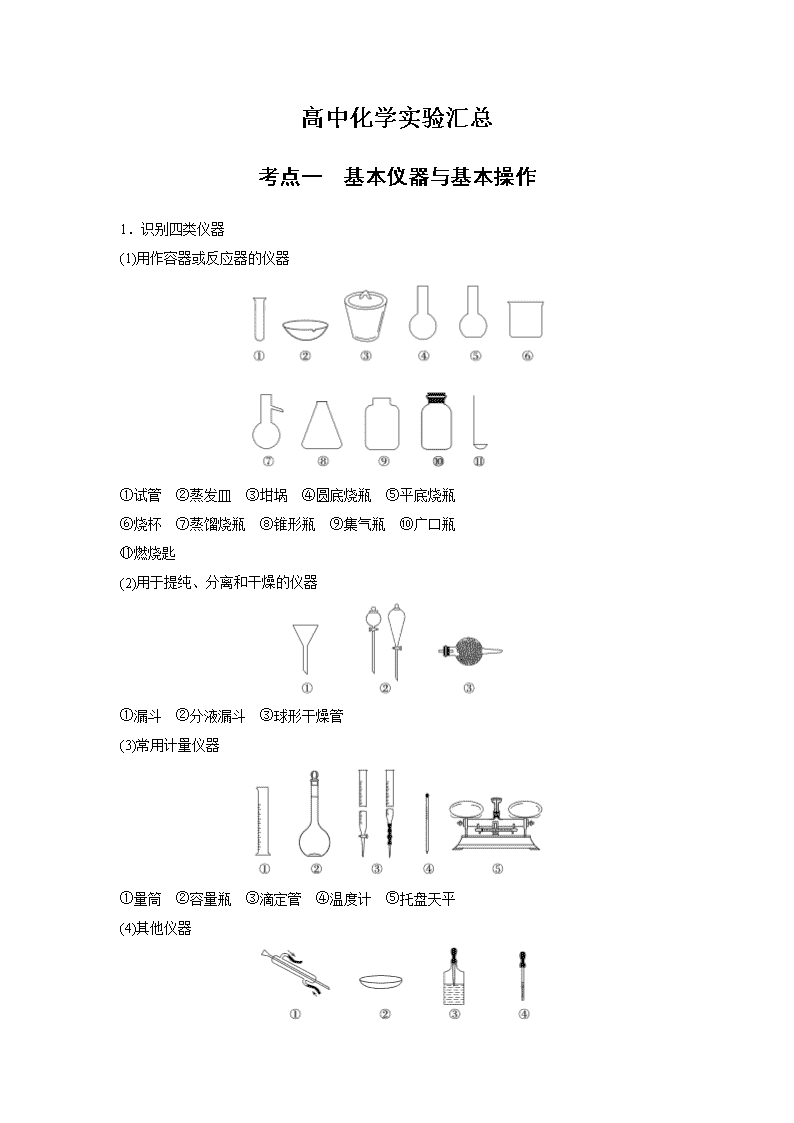
高中化学实验汇总
考点一 基本仪器与基本操作
1.识别四类仪器
(1)用作容器或反应器的仪器
①试管 ②蒸发皿 ③坩埚 ④圆底烧瓶 ⑤平底烧瓶
⑥烧杯 ⑦蒸馏烧瓶 ⑧锥形瓶 ⑨集气瓶 ⑩广口瓶
⑪燃烧匙
(2)用于提纯、分离和干燥的仪器
①漏斗 ②分液漏斗 ③球形干燥管
(3)常用计量仪器
①量筒 ②容量瓶 ③滴定管 ④温度计 ⑤托盘天平
(4)其他仪器
①冷凝管 ②表面皿 ③滴瓶 ④胶头滴管
2.熟记十大基本操作
下面 10 个基本操作在高考中经常考到,要熟练记忆。
(1)测定溶液 pH 的操作
将一小块 pH 试纸放在洁净的表面皿上,用清洁干燥的玻璃棒蘸取少量待测液点到 pH 试纸
中央,待变色稳定后再和标准比色卡对照,读出对应的 pH。
(2)沉淀剂是否过量的判断方法
①静置,向上层清液中继续滴加少量沉淀剂,若无沉淀产生,则证明沉淀剂已过量,否则沉
淀剂不过量。
②静置,取上层清液适量于另一洁净试管中,向其中加入少量与沉淀剂作用产生沉淀的试剂,
若产生沉淀,证明沉淀剂已过量,否则沉淀剂不过量。
(3)洗涤沉淀操作
把蒸馏水沿着玻璃棒注入到过滤器中至浸没沉淀,静置,使蒸馏水滤出,重复 2~3 次即可。
(4)判断沉淀是否洗净的操作
取最后一次洗涤液,滴加……(试剂),若没有……现象,证明沉淀已经洗净。
(5)装置气密性检查
①简易装置:将导气管一端放入水中(液封气体),用手捂热试管,观察现象:若导管口有气
泡冒出,冷却到室温后,导管口有一段稳定的水柱,表明装置气密性良好。
②有长颈漏斗的装置如下图:用止水夹关闭烧瓶右侧的导气管,向长颈漏斗中加入适量水,
长颈漏斗中会形成一段液柱,停止加水,过一段时间后,若漏斗中的液柱无变化,则装置气
密性良好。
[答题模板]
形成密闭体系―→操作―→描述现象―→得出结论
(6)气体验满和检验操作
①氧气验满:将带火星的木条平放在集气瓶口,若木条复燃,则说明收集的氧气已满。
②可燃性气体(如氢气)的验纯方法:用排水法收集一小试管的气体,将大拇指摁住管口移近
火焰,放开手指,若听到尖锐的爆鸣声,则气体不纯;若听到轻微的“噗”的一声,则气体
纯净。
③二氧化碳验满:将燃着的木条平放在集气瓶口,若火焰熄灭,则气体已满。
④氨气验满:用湿润的红色石蕊试纸放在集气瓶口,若试纸变蓝说明气体已满。
⑤氯气验满:用湿润的淀粉碘化钾试纸放在集气瓶口,若试纸变蓝说明气体已满。
(7)萃取分液操作
关闭分液漏斗活塞,将混合液倒入分液漏斗中,塞上塞子,用右手心顶住塞子,左手握住活
塞部分,将分液漏斗倒置,充分振荡、静置、分层,在漏斗下面放一个小烧杯,先打开上口
塞子再打开分液漏斗活塞,使下层液体从下口沿烧杯壁流下,上层液体从上口倒出。
(8)浓 H2SO4 稀释操作
将浓 H2SO4 沿烧杯壁缓缓注入水中,并用玻璃棒不断搅拌。
(9)粗盐的提纯
①实验室提纯粗盐的实验操作依次为取样、溶解、沉淀、过滤、蒸发、冷却结晶、过滤、烘
干。
②若过滤时发现滤液中有少量浑浊,从实验操作的角度分析,可能的原因是过滤时漏斗中液
面高出滤纸边缘、玻璃棒靠在单层滤纸一边弄破滤纸。
(10)从某物质稀溶液中结晶的实验操作
①溶解度受温度影响较小的:蒸发→结晶→过滤。
②溶解度受温度影响较大或带结晶水的:蒸发浓缩→冷却结晶→过滤。
3.化学实验中的几个数据
4.几种操作的“第一步”
(1)检查装置的气密性——制取气体、验证气体的性质等与气体有关的实验操作。
(2)检查是否漏水——滴定管、容量瓶、分液漏斗等的使用。
(3)调“0”点——天平等的使用。
(4)验纯——点燃可燃性气体。
(5)分别取少量溶液——未知溶液的鉴别。
(6)润湿——用红色石蕊试纸、蓝色石蕊试纸、碘化钾淀粉试纸检验或验证某些气体时
考点二 常见离子的检验及物质鉴别
1.常见阴离子的检验
(1)利用酸碱指示剂检验
(2)利用盐酸和其他试剂检验
CO2-3 :加入 BaCl2 或 CaCl2 溶液后生成白色沉淀,再加稀盐酸沉淀溶解,并放出无色无味的
气体。
SO2-4 :先加入足量稀盐酸,无沉淀生成,再加入 BaCl2 溶液,产生白色沉淀。
SO2-3 :加入 BaCl2 溶液,产生白色沉淀,再加稀盐酸,放出无色有刺激性气味且能使品红
溶液褪色的气体。
(3)利用 AgNO3(HNO3 酸化)溶液检验
(4)利用某些特征反应检验
I-:滴入淀粉溶液和氯水,溶液变蓝色(或加入氯水和四氯化碳,四氯化碳层呈紫红色)。
2.常见阳离子的检验
H+―→滴入紫色石蕊溶液,溶液变红色
3.离子检验实验操作的答题模板
操作 ⇒ 现象 ⇒ 结论
取样,加入…… ⇒ 有……生成 ⇒ ……的是……
例如:检验某溶液中含有 Fe2+而不含 Fe3+的方法是取适量溶液于洁净的试管中,滴加几滴
KSCN 溶液,无明显现象,再向溶液中滴加几滴 H2O2(或新制氯水),溶液变为血红色,说明
溶液中含有 Fe2+而不含 Fe3+。
4.物质鉴别遵循的原则
(1)选择的方法或试剂要简单,实验现象要明显。
(2)用物理方法时,一般可按观察法→嗅试法→水溶法的顺序进行。
(3)用化学方法时,对固体可按加热法、水溶法、指示剂测试法、指定试剂法等进行;对液
体可按照指示剂测试法、指定试剂法等进行;对气体可用点燃法、通入指定试剂法等进行。
考点三 物质的分离和提纯
1.物质分离与提纯的基本原理
(1)“四原则”
①不增,不得引入新杂质;②不减,尽量不减少被提纯的物质;③易分,使被提纯或分离的
物质跟其他物质易分离;④复原,被提纯的物质要易被还原。
(2)“三必须”
①除杂试剂必须过量;②过量试剂必须除尽(除去过量试剂带入的新杂质,同时注意加入试
剂的顺序);③选择最佳的除杂途径。
2.物质分离与提纯的常用方法
(1)升华法;(2)过滤法;(3)蒸馏法;(4)萃取分液法;(5)洗气法;(6)燃烧法。
3.物质分离与提纯的常见类型
(1)“固+固”混合物的分离(提纯)
(2)“固+液”混合物的分离(提纯)
(3)“液+液”混合物的分离(提纯)
(4)“气+气”混合物的分离(提纯)
考点四 评价型实验题
评价型实验题包括的题型很多,其中比较典型的有物质性质探究型、组成成分探究型、物质
制备和应用探究型等,该类试题一般以实验装置图的形式给出实验的流程,其实验流程与考
查内容一般为
1.常见的气体发生装置
2.常见的净化装置——用于除去气体中的杂质气体
3.常见的气体收集装置
4.常见的量气装置——通过排液法测量气体的体积
5.有毒气体的处理装置
考点五 定量测定型实验题
常见的定量测定型实验题包括混合物成分的测定、物质纯度的测定以及化学式的确定等。该
类试题常涉及物质的称量、物质的分离与提纯、中和滴定、一定物质的量浓度溶液的配制等
实验操作。实验过程中或问题解答中要特别注意以下几个问题:
1.气体体积的测量
(1)量气装置的改进
(2)量气时应注意的问题
①量气时应保持装置处于室温状态。
②读数时要特别注意消除“压强差”,保持液面相平还要注意视线与液面最低处相平。如上
图(Ⅰ)(Ⅳ)应使左侧和右侧的液面高度保持相平。
2.测定实验中要有消除干扰气体的意识
如用“惰性”气体将干扰气体排出,或用溶液吸收干扰气体等。
3.测定实验中要有被测量气体全部被测量的意识
如可采取反应结束后继续向装置中通入“惰性”气体以使被测量气体全部被吸收剂吸收的方
法。
4.测定实验中要有“数据”的采集处理意识
实验数据的采集是化学计算的基础,一般来讲,固体试剂称质量,而液体试剂和气体试剂则
测量体积。
(1)称量固体质量时,中学一般用托盘天平,可估读到 0.1 g,精确度要求高的实验中可以用
分析天平或电子天平,可精确到 0.000 1 g。
(2)测量液体体积时,一般实验中选用适当规格的量筒,可估读到 0.1 mL,准确度要求高的
定量实验如中和滴定中选用滴定管(酸式或碱式),可估读到 0.01 mL。容量瓶作为精密的定
容仪器,用于配制一定物质的量浓度的溶液,一般不用于量取液体的体积。
(3)气体除了量取外,还可以称量。称气体的质量时一般有两种方法:一种方法是称反应装
置在放出气体前后的质量减小值;另一种方法是称吸收装置前后的质量增大值。
(4)用 pH 试纸(测得整数值)或 pH 计(精确到 0.01)直接测出溶液的 pH,经过计算可以得到溶
液中 H+或 OH-的物质的量浓度。为了数据的准确性,实验中要采取必要的措施,确保离子
完全沉淀、气体完全被吸收等,必要时可以进行平行实验,重复测定,然后取其平均值进行
计算。如中和滴定实验中测量酸或碱的体积要平行做 2~3 次滴定,取体积的平均值求算未
知溶液的浓度,但对于“离群”数据(指与其他数据有很大差异的数据)要舍弃,因为数据“离
群”的原因可能是操作中出现了较大的误差。
考点六 高考实验的新宠——有机制备实验
“有机实验”在高考中频频出现,主要涉及到有机物的制备、有机物官能团性质实验探究等。
常常考查蒸馏和分液操作、反应条件的控制、产率的计算等问题。
(1)分离液体混合物的方法
方法 适用条件 实例 说明
萃取 互不相溶的液体混合物 分离 CCl4 和水等
分液时下层液体从下口流出,上
层液体从上口倒出
蒸馏
两种或两种以上互溶的液体,
沸点相差较大
分离酒精和水
在蒸馏烧瓶中放少量碎瓷片,防
止液体暴沸
(2)蒸馏装置
化学实验基础知识点
1.物质分离和提纯时,一般遵循“四原则”和“三必须”:
“四原则”:一不增,不得引入新杂质;二不减,尽量不减少被提纯和分离
的物质;三易分,使被提纯或分离的物质与其他物质易分离;四复原,被提
纯物质要易被复原。
“三必须”:①除杂试剂必须过量;②过量试剂必须除尽(去除过量试剂带入
的新杂质,同时应注意加入试剂的顺序);③选择最佳的除杂途径。
2.“固+固”混合物的分离(提纯)
3.“固+液”混合物的分离(提纯)
固+液Error!
4.“液+液”混合物的分离(提纯)
液+液Error!
5.“气+气”混合物的分离(提纯)
气+气Error!
6.必记的 20 个特征实验现象
(1)镁条在空气中燃烧:发出耀眼的白光,有白色粉末生成。
(2)硫在空气中燃烧:淡蓝色火焰;在氧气中燃烧:蓝紫色火焰。
(3)铁丝在氧气中燃烧:剧烈燃烧,火星四射,放出热量,生成黑色固体。
(4)氢气在氯气中燃烧:安静的燃烧,发出苍白色火焰,瓶口有大量白雾生成。
(5)一氧化碳在空气中燃烧:发出淡蓝色的火焰,放出热量。
(6)细铜丝在氯气中燃烧后加入水:有棕黄色的烟生成,加水后生成绿色的溶
液。
(7)新制氯水中加石蕊试液:先变红色后褪色。
(8)磷在氯气中燃烧:有白色烟雾生成。
(9)湿润的淀粉KI 试纸遇氯气:试纸变蓝。
(10)氯气遇到润湿的有色布条:有色布条的颜色褪去。
(11)溴(碘)水中加入四氯化碳:溶液分层,上层接近无色,下层接近橙(紫)色。
(12)二氧化硫气体通入品红溶液:红色褪去,加热后又恢复原来的颜色。
(13)钠在空气中燃烧:火焰呈黄色,生成淡黄色物质。
(14)把水滴入盛有过氧化钠的试管,放入带火星的木条:木条复燃。
(15)加热碳酸氢钠固体,并将产生的气体通入澄清石灰水:澄清石灰水变浑
浊。
(16)氨气与氯化氢相遇:有大量白烟产生。
(17)铜片与浓硝酸反应:反应剧烈,有红棕色气体产生。
(18)铜片与稀硝酸反应:产生无色气体,气体上升逐渐变成红棕色。
(19)向含 Fe2+的溶液中加入氢氧化钠:有白色沉淀出现,立即转变为灰绿色,
最终转变成红褐色沉淀。
(20)向含 Fe3+的溶液中加入 KSCN 溶液:溶液变血红色。
实验化学
一、化学实验安全
1、(1)做有毒气体的实验时,应在通风厨中进行,并注意对尾气进行适当处理(吸收或点燃等)。进
行易燃易爆气体的实验时应注意验纯,尾气应燃烧掉或作适当处理。
(2)烫伤宜找医生处理。
(3)浓酸撒在实验台上,先用 Na2CO3 (或 NaHCO3)中和,后用水冲擦干净。浓酸沾在皮肤上,宜先
用干抹布拭去,再用水冲净。浓酸溅在眼中应先用稀 NaHCO3 溶液淋洗,然后请医生处理。
(4)浓碱撒在实验台上,先用稀醋酸中和,然后用水冲擦干净。浓碱沾在皮肤上,宜先用大量水冲洗,
再涂上硼酸溶液。浓碱溅在眼中,用水洗净后再用硼酸溶液淋洗。
(5)钠、磷等失火宜用沙土扑盖。
(6)酒精及其他易燃有机物小面积失火,应迅速用湿抹布扑盖。
二.混合物的分离和提纯
三、离子检验
离子 所加试剂 现象 离子方程式
Cl- AgNO3、稀 HNO3 产生白色沉淀 Cl-+Ag+=AgCl↓
SO42- 稀 HCl、BaCl2 白色沉淀 SO42-+Ba2+=BaSO4↓
四.一定物质的量浓度的配制
(1)基本原理:根据欲配制溶液的体积和溶质的物质的量浓度,用有关物质的量浓度计算的方法,求出
所需溶质的质量或体积,在容器内将溶质用溶剂稀释为规定的体积,就得欲配制得溶液.
(2)主要操作
分离和提纯
的方法
分离的物质 应注意的事项 应用举例
过滤 用于固液混合的分离 一贴、二低、三靠 如粗盐的提纯
蒸馏
提纯或分离沸点不同的液
体混合物
防止液体暴沸,温度计水银球的位置,如石油的蒸馏中
冷凝管中水的流向
如石油的蒸馏
萃取
利用溶质在互不相溶的溶
剂里的溶解度不同,用一种
溶剂把溶质从它与另一种
溶剂所组成的溶液中提取
出来的方法
选择的萃取剂应符合下列要求:和原溶液中的溶剂互不
相溶;对溶质的溶解度要远大于原溶剂
用四氯化碳萃取溴
水里的溴、碘
分液 分离互不相溶的液体
打开上端活塞或使活塞上的凹槽与漏斗上的水孔,使漏
斗内外空气相通。打开活塞,使下层液体慢慢流出,及
时关闭活塞,上层液体由上端倒出
如用四氯化碳萃取溴水里
的溴、碘后再分液
蒸发和结晶
用来分离和提纯几种可溶
性固体的混合物
加热蒸发皿使溶液蒸发时,要用玻璃棒不断搅动溶液;
当蒸发皿中出现较多的固体时,即停止加热
分离 NaCl 和 KNO3 混合物
a.检验是否漏水.b.配制溶液:○1 计算.○2 称量.○3 溶解.○4 转移.○5 洗涤.○6 定容.○7 摇匀.○8 贮存溶液.
注意事项:
A 选用与欲配制溶液体积相同的容量瓶.
B 使用前必须检查是否漏水.
C 不能在容量瓶内直接溶解.
D 溶解完的溶液等冷却至室温时再转移.
E 定容时,当液面离刻度线 1―2cm 时改用滴管,以平视法观察加水至液面最低处与刻度相切为止.
3.溶液稀释:C(浓溶液)·V(浓溶液) =C(稀溶液)·V(稀溶液)
相关文档
- 2020-2021年高考生物一轮复习知识2021-05-1415页
- 高考物理一轮复习实验10练习使用多2021-05-144页
- 上海市黄浦嘉定区高三下学期高考模2021-05-1411页
- 高考真题汇编——文科数学解析版6 2021-05-1429页
- 邢台市捷径高考高三第三次模拟考试2021-05-1415页
- 高考英语必备词组500个句型汇总2021-05-1411页
- 高考语文总复习 古代诗文阅读突破2021-05-147页
- 高考试题——理综天津卷含答案moon2021-05-1419页
- 青岛市2014高考英语阅读理解完形填2021-05-148页
- 至广东高考地理试题分析2021-05-147页