- 1.11 MB
- 2021-05-14 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
高考化学冲刺训练(9)
1.诺贝尔奖评委会介绍说,2005年诺贝尔化学奖——“烯烃复分解反应”是朝着‘绿色化学’方向前进的一大步”。因为应用该成果一方面提高了化工生产中的产量和效率,同时减少了副产品;另一方面其副产品主要是乙烯,而乙烯是可以再利用的。下列关于乙烯及其产品的有关叙述不正确的是:
A.乙烯是制造塑料、合成乙醇、乙醛、合成纤维等重要原料
B.聚乙烯是当今世界用量最多的一种塑料
C.由于乙烯存在双键,化学性质活泼,因此,能与氯气取代生成二氯乙烷。
D.碳-碳双键的键能与碳-碳单键相比要高得多,因此要切断前者并使其按照希望的方式重新结合,则需要更高的能量,所以反应条件往往使用催化剂。
2.某有机物X(C4H6O5)广泛存在于许多水果中,尤以苹果、葡萄、西瓜、山楂内为多,经测试,该化合物具有如下性质:①l mol X与足量的金属钠反应产生1.5 mol H2
②X与醇(ROH)或羧酸(RCOOH)在浓H2SO4和加热条件下均可反应生成有香味的产物
③X在一定条件下的分子内脱水产物(不是环状化合物)可和溴水发生加成反应
根据上述信息,下列对X的结构的判断正确的是
A.X分子中肯定有碳碳双键 B.X分子中可能有三个羟基和一个-COOR官能团
C.X分子中可能有三个羧基 D.X分子中可能有一个羟基二个羧基
3. 已知1L溶液中已电离的水是10-3moL,则此溶液中可能大量存在的离子组是
①Na+、K+、NO3-、SO42- ②CO32-、Cl-、Na+、K+ ③NO3-、Cu2+、K+、Cl-
④NO3-、NH4+、SO42-、K+ ⑤Fe3+、Cl-、SO32-、NO3- ⑥S2-、K+、Cl-、ClO-
A.除①外,均可以 B.① C. ②③⑤⑥ D.②③④
①
②
③
④
4. 足量的铝粉分别和等体积pH=12的氢氧化钠溶液以及pH=2的某酸溶液反应,放出氢气的体积分别为V1、V2,则在相同状况下,V1、V2的关系可能是
A. V1V2 D.上述三种情况都有可能
5.在硫酸工业生产中,SO3的吸收过程是在吸收塔(如右图)中进行的,
吸收塔里还装入了大量瓷环。下列有关SO3说法中,不正确的是
A.从①处通入SO3,整个吸收操作采取逆流的形式
B.从②处喷下98.3%的硫酸,瓷环的作用是增大接触面积
C.从③处导出的气体只含有少量SO2,可直接排入大气
D.从④处流出的是可用水或稀硫酸稀释的硫酸
6.下列离子方程式书写正确的是
A 等体积的氯气和二氧化硫同时通入一定量水中:Cl2+SO2+2H2O==4H+ +2Cl- +SO42-
B 过量二氧化碳通入偏铝酸钠溶液中 CO2+2H2O+AlO==Al(OH)3↓+HCO
C 在溶液中亚硫酸氢铵与等物质的量氢氧化钠混合 NH+HSO+2OH-==SO+NH3↑+2H2O
D 碳酸氢镁溶液中加入过量石灰水 Mg2++2HCO+Ca2++2OH-==CaCO3↓+2H2O+MgCO3↓
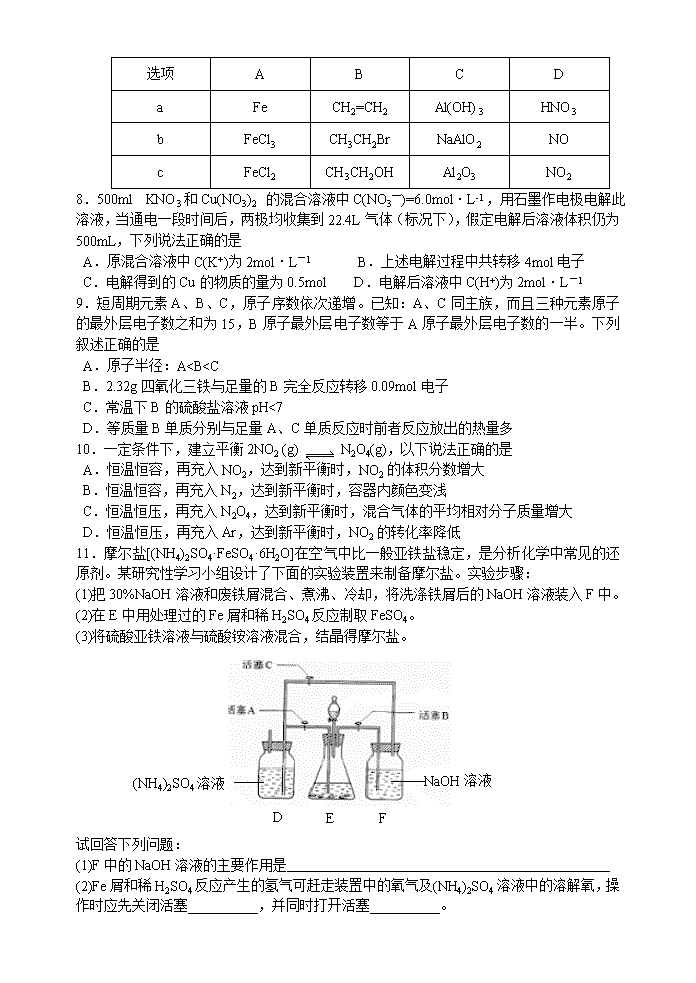
7.下列各组物质中,不是按(“→”表示一步完成)关系相互转化的是
选项
A
B
C
D
a
Fe
CH2=CH2
Al(OH)3
HNO3
b
FeCl3
CH3CH2Br
NaAlO2
NO
c
FeCl2
CH3CH2OH
Al2O3
NO2
8.500ml KNO3和Cu(NO3)2 的混合溶液中C(NO3—)=6.0mol·L-1 ,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标况下),假定电解后溶液体积仍为500mL,下列说法正确的是
A.原混合溶液中C(K+)为2mol·L-1 B.上述电解过程中共转移4mol电子
C.电解得到的Cu的物质的量为0.5mol D.电解后溶液中C(H+)为2mol·L-1
9.短周期元素A、B、C,原子序数依次递增。已知:A、C同主族,而且三种元素原子的最外层电子数之和为15,B原子最外层电子数等于A原子最外层电子数的一半。下列叙述正确的是
A.原子半径:A